FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Pergunte a um médico sobre a prescrição de FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Como usar FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Introdução
Prospecto:informação para o utilizador
Fulvestrant Teva 250 mg solução injetável em seringa pré-carregada EFG
Leia todo o prospecto atentamente antes de começar a usar este medicamento,porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Fulvestrant Teva e para que é utilizado
- O que necessita saber antes de começar a usar Fulvestrant Teva
- Como usar Fulvestrant Teva
- Possíveis efeitos adversos
- Conservação de Fulvestrant Teva
- Conteúdo do envase e informações adicionais
1. O que é Fulvestrant Teva e para que é utilizado
Fulvestrant Teva contém o princípio ativo fulvestrante, que pertence ao grupo de bloqueantes de estrogénio. Os estrogénios, um tipo de hormonas sexuais femininas, podem estar em alguns casos implicados no desenvolvimento do cancro da mama.
Fulvestrant Teva é utilizado:
- sozinho, para tratar mulheres pós-menopáusicas com um tipo de cancro da mama chamado cancro da mama com receptor de estrogénio positivo, que é localmente avançado ou que se espalhou para outras partes do corpo (metastásico) ou,
- em combinação com palbociclib para tratar mulheres com um tipo de cancro da mama chamado cancro da mama com receptor hormonal positivo, cancro da mama com receptor 2 do factor de crescimento epidérmico humano negativo, que está localmente avançado ou que se espalhou para outras partes do corpo (metastásico). As mulheres que não tenham chegado à menopausa também serão tratadas com um medicamento chamado agonista da hormona liberadora de hormona luteinizante (LHRH).
Fulvestrante pode ser administrado em combinação com palbociclib. É importante que si leia também o prospecto de palbociclib. Se tiver alguma pergunta sobre palbociclib, consulte o seu médico.
2. O que necessita saber antes de começar a usar Fulvestrant Teva
NÃO useFulvestrant Teva:
- se é alérgica a fulvestrante ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6)
- se está grávida ou em período de amamentação (ver secção “Gravidez e amamentação”)
- se tem problemas hepáticos graves
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Fulvestrant Teva se algo disto se aplica:
- problemas de rim ou fígado
- contagem baixa de plaquetas (que ajudam à coagulação do sangue) ou alterações hemorrágicas
- problemas prévios de coágulos sanguíneos
- osteoporose (perda de densidade óssea)
- alcoolismo (ver secção “Fulvestrant Teva contém etanol 96% (álcool)”).
Não se estudou a eficácia e segurança de fulvestrante (como monoterapia ou em combinação com palbociclib) em pacientes com doença visceral crítica.
Crianças e adolescentes
Fulvestrant Teva NÃO está indicado em crianças e adolescentes menores de 18 anos.
Uso de Fulvestrant Tevacomoutros medicamentos
Informa o seu médico ou farmacêutico se está a tomar, tomou recentemente ou possa ter que tomar qualquer outro medicamento.
Em particular, deve dizer ao seu médico se está a utilizar anticoagulantes (medicamentos para prevenir os coágulos sanguíneos).
Gravidez eamamentação
NÃO deve utilizar Fulvestrant Teva se está grávida. Se pode ficar grávida, deve utilizar um método anticonceptivo eficaz enquanto estiver em tratamento com Fulvestrant Teva e durante 2 anos após a sua última dose.
NÃO deve amamentar enquanto estiver em tratamento com Fulvestrant Teva.
Condução e uso de máquinas
Não se espera que Fulvestrant Teva afete a sua capacidade para conduzir ou utilizar máquinas. No entanto, se se sentir cansada após o tratamento NÃO conduza nem utilize máquinas.
Fulvestrant Tevacontém etanol 96% (álcool)
Este medicamento contém 474 mg de álcool (etanol) em cada seringa pré-carregada de 5 ml, que se corresponde a 94,8 mg/ml. A quantidade em uma dose de 10 ml deste medicamento equivale a menos de 24 ml de cerveja ou 10 ml de vinho.
A pequena quantidade de álcool neste medicamento não terá nenhum efeito notável.
Fulvestrant Tevacontém álcool benzílico
Este medicamento contém 500 mg de álcool benzílico em cada seringa pré-carregada de 5 ml, equivalente a 100 mg por ml.
O álcool benzílico pode provocar reações alérgicas.
Consulte o seu médico ou farmacêutico se tiver doenças de fígado ou rim. Isto é devido a que se podem acumular no organismo grandes quantidades de álcool benzílico e provocar efeitos adversos (acidose metabólica).
Fulvestrant Tevacontém benzoato de benzilo
Este medicamento contém 750 mg de benzoato de benzilo em cada seringa pré-carregada de 5 ml equivalente a 150 mg por ml.
3. Como usar Fulvestrant Teva
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose recomendada é 500 mg de fulvestrante (duas injeções de 250 mg/5ml) administrada uma vez por mês com uma dose adicional de 500 mg administrada 2 semanas após a dose inicial.
O seu médico ou enfermeiro administrará Fulvestrant Teva mediante uma injeção intramuscular lenta em cada um dos seus glúteos.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Pode necessitar tratamento médico urgente se experimentar algum dos seguintes efeitos adversos:
- reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta que podem ser sinais de reações anafilácticas
- tromboembolismo (aumento do risco de coágulos sanguíneos)*
- inflamação do fígado (hepatite)
- falha hepática.
Informa o seu médico, farmacêutico ou enfermeiro se notar algum dos seguintes efeitos adversos:
Efeitos adversos notificados em pacientes tratados com fulvestrante em monoterapia:
Muito frequentes:podem afetar mais de 1 em cada 10 pessoas
- reações no local da injeção, como dor e/ou inflamação
- níveis anormais de enzimas hepáticos (em análise de sangue)*
- náuseas (sensação de mal-estar)
- fraqueza, cansaço*
- dor articular e musculoesquelética
- sofocos
- erupção cutânea
- reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta
Todos os efeitos adversos restantes:
Frequentes: podem afetar até 1 em cada 10 pessoas
- dor de cabeça
- vómitos, diarreia ou perda de apetite*
- infecções do trato urinário
- dor de costas*
- aumento de bilirrubina (um pigmento da bile produzido pelo fígado).
- tromboembolismo (aumento do risco de coágulos sanguíneos)*
- níveis diminuídos de plaquetas (trombocitopenia)
- hemorragia vaginal
- dor lombar que se reflete em um lado da perna (ciática)
- fraqueza súbita, entorpecimento, formigamento ou perda de movimento na sua perna, especialmente em um só lado do corpo, problemas súbitos para caminhar ou de equilíbrio (neuropatia periférica)
Pouco frequentes:podem afetar até 1 em cada 100 pessoas
- fluxo vaginal espesso, branco e candidíase (infecção)
- hematoma e hemorragia no local da injeção
- aumento de gama-GT, uma enzima hepática que se identifica em uma análise de sangue
- inflamação do fígado (hepatite)
- falha hepática
- entorpecimento, formigamento e dor
- reações anafilácticas.
*Inclui efeitos adversos para os quais não se pode avaliar o papel exato de Fulvestrant Teva devido à doença subjacente.
Efeitos adversos notificados em pacientes tratados com fulvestrante em combinação com palbociclib:
Muito frequentes:podem afetar mais de 1 em cada 10 pessoas
- diminuição da contagem de neutrófilos (neutropenia)
- diminuição da contagem de glóbulos brancos (leucopenia)
- infecções
- cansaço
- náuseas
- redução de glóbulos vermelhos (anemia)
- inflamação ou ulceração da boca
- diarreia
- diminuição dos níveis de plaquetas (trombocitopenia)
- vómitos
- perda de cabelo
- erupção
- perda de apetite
- febre
Frequentes: podem afetar até 1 em cada 10 pessoas
- sensação de fraqueza
- aumento dos níveis de enzimas hepáticas
- perda de gosto
- hemorragia nasal
- olho excessivamente húmido
- pele seca
- visão borrosa
- olho seco
Pouco frequentes:podem afetar até 1 em cada 100 pessoas
- febre com outros sinais de infecção (neutropenia febril).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, si pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Fulvestrant Teva
Mantenhaeste medicamentofora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase ou nas etiquetas das seringas após CAD. A data de validade é o último dia do mês que se indica.
Não utilize este medicamento se observar partículas ou decoloração antes da sua administração.
Conservar e transportar em frigorífico (entre 2ºC e 8ºC).
As desvições de temperatura fora do intervalo de entre 2ºC e 8ºC devem ser controladas. Isto inclui evitar a conservação a temperaturas superiores a 25ºC, e que não exceda um período de 4 meses, durante o qual a temperatura média de conservação do medicamento seja inferior a 25ºC (mas por cima de entre 2ºC e 8ºC). Após as desvições de temperatura, o medicamento deve ser retornado imediatamente às condições de conservação recomendadas (conservar e transportar em frigorífico entre 2ºC e 8ºC). As desvições de temperatura têm um efeito acumulativo na qualidade do medicamento, não devendo superar o período de 4 meses por cima da duração da validade de 2 anos de Fulvestrant Teva. A exposição a temperaturas inferiores a 2ºC não danificará o medicamento, desde que este não seja conservado por debaixo de -20ºC.
Conservar a seringa pré-carregada no embalagem original para protegê-la da luz.
O seu profissional de saúde será o responsável pela conservação, uso e eliminação corretos de Fulvestrant Teva.
Este medicamento pode apresentar um risco para o meio aquático. Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Fulvestrant Teva
- O princípio ativo é fulvestrant. Cada seringa precarregada contém 250 mg de fulvestrant. Cada ml de solução contém 50 mg de fulvestrant.
- Os demais componentes (excipientes) são etanol (96%), álcool benzílico, benzoato de benzilo e óleo de rícino refinado.
Aspecto do produto e conteúdo do envase
Fulvestrant Teva é uma solução viscosa, clara, de incolora a amarela em uma seringa precarregada equipada com um conector Luer-Lock que contém 5 ml de solução injetável. Devem ser administradas duas seringas para receber a dose mensal recomendada de 500 mg.
Fulvestrant Teva apresenta 2 formatos:
- 1 envase que contém 1 seringa de vidro precarregada e 1 agulha com sistema de segurança para sua conexão com o corpo da seringa.
- 1 envase que contém 2 seringas de vidro precarregadas e são fornecidas além disso 2 agulhas com sistema de segurança para sua conexão com o corpo da seringa.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Teva Pharma, S.L.U.
Rua Anabel Segura, 11. Edifício Albatros B, 1ª planta
28108 Alcobendas, Madrid
Espanha
Responsável pela fabricação
Pliva Croatia Ltd.
Prilaz baruna Filipovica 25
10000 Zagreb
Croácia
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Áustria: Fulvestrant ratiopharm 250 mg Injektionslösung in einer Fertigspritze
Bélgica: Fulvestrant Teva 250 mg oplossing voor injectie/solution injectable/Injektionslösung
Bulgária: ??????????? ???? 250 mg ?????????? ??????? ? π???????????? ??π?????? ?π????????
Croácia: Fulvestrant Pliva 250 mg otopina za injekciju u napunjenoj štrcaljki
República Checa: Fulvestrant Teva
Dinamarca: Fulvestrant Teva
Finlândia: Fulvestrant ratiopharm 250 mg injektioneste, liuos, esitäytetty ruisku
França: Fulvestrant Teva 250mg solution injectable en seringue préremplie
Alemanha: Fulvestrant Teva 250 mg Injektionslösung in einer Fertigspritze
Hungria: Fulvestrant Teva 250 mg/5 ml oldatos injekció eloretöltött fecskendoben
Islândia: Fulvestrant Teva 250 mg stungulyf, lausn í áfylltri sprautu
Irlanda: Fulvestrant Teva 250 mg Solution for Injection in Pre-filled Syringe
Itália: Fulvestrant Teva
Letônia: Fulvestrant Teva 250 mg škidums injekcijam pilnšlirce
Lituânia: Fulvestrant Teva 250mg injekcinis tirpalas užpildytame švirkšte
Luxemburgo: Fulvestrant Teva 250 mg oplossing voor injectie/solution injectable/Injektionslösung
Países Baixos: Fulvestrant Teva 250 mg, oplossing voor injectie voorgevulde spuit
Polônia: Fulvestrant Teva
Portugal: Fulvestrant Teva
Romênia: Fulvestrant Teva 250 mg solutie injectabila în seringa preumpluta
Eslováquia: Fulvestrant Teva 250 mg
Eslovênia: Fulvestrant Teva 250 mg raztopina za injicirnaje v napolnjeni injekcijski brizgi
Espanha: Fulvestrant Teva 250 mg solução injetável em seringa precargada EFG
Suécia: Fulvestrant Teva 250 mg injektionsvätska, lösning, förfylld spruta
Reino Unido: Fulvestrant Teva 250mg solution for injection in pre-filled syringe
(Irlanda do Norte)
Data da última revisão desteprospecto: Julho 2025
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) https://www.aemps.gob.es/
Pode aceder a informação detalhada e atualizada sobre este medicamento escaneando com seu telefone móvel (smartphone) o código QR incluído no cartonagem. Também pode aceder a esta informação na seguinte direção de internet: https://cima.aemps.es/cima/dochtml/p/80910/P_80910.html
Código QR + URL
----------------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do setor sanitário:
Fulvestrant Teva 500 mg (2 x 250 mg/5 ml solução injetável) deve ser administrado utilizando duas seringas precarregadas (ver seção 3).
Instruções de administração
Administre a injeção de acordo com as diretrizes locais para a injeção intramuscular de grandes volumes.
NOTA: Devido à proximidade do nervo ciático, deve-se ter precaução se Fulvestrant Teva for injetado na zona dorsoglútea (ver seção 4.4).
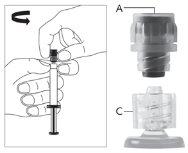
Advertência- NÃO esterilize em autoclave a agulha com sistema de segurança antes de seu uso. As mãos devem permanecer por trás da agulha em todo momento durante seu uso e eliminação.
Para cada uma das duas seringas:
| Figura 1
|
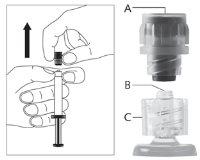
| Figura 2
|
| Figura 3
|
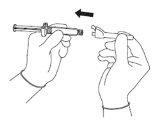
| Figura 4
|
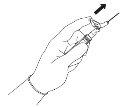
NOTA: Ative afastado de seu corpo e dos demais. Escute o clique e confirme visualmente que a ponta da agulha está totalmente protegida. | Figura 5
|
Eliminação
As seringas precarregadas são sópara um único uso.
Este medicamento pode apresentar um risco para o meio aquático. A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.

Quanto custa o FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Espanha em 2025?
O preço médio do FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em dezembro de 2025 é de cerca de 225.7 EUR. Os valores podem variar consoante a região, a farmácia e a necessidade de receita. Confirme sempre com uma farmácia local ou fonte online para obter informações atualizadas.
- País de registo
- Preço médio em farmácia225.7 EUR
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, 250 mg/5 mlSubstância ativa: fulvestrantFabricante: Bexal Farmaceutica S.A.Requer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Ever Valinject GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Astrazeneca AbRequer receita médica
Alternativas a FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Polónia
Alternativa a FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Ukraine
Médicos online para FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de FULVESTRANT TEVA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.