FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL

Como usar FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Faslodex250mg solução injetável
fulvestrante
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas a si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver Seção 4.
Conteúdo do prospecto
- O que é Faslodex e para que é utilizado
- O que precisa saber antes de começar a usar Faslodex
- Como usar Faslodex
- Possíveis efeitos adversos
- Conservação de Faslodex
- Conteúdo do envase e informação adicional
1. O que é Faslodex e para que é utilizado
Faslodex contém o princípio ativo fulvestrante, que pertence ao grupo de bloqueantes de estrogénio. Os estrogénios, um tipo de hormonas sexuais femininas, podem estar em alguns casos implicados no desenvolvimento do cancro da mama.
Faslodex é utilizado:
- sozinho, para tratar mulheres pós-menopáusicas com um tipo de cancro da mama chamado cancro da mama com receptor de estrogénio positivo, que é localmente avançado ou que se espalhou para outras partes do corpo (metastásico) ou,
- em combinação com palbociclib para tratar mulheres com um tipo de cancro da mama chamado cancro da mama com receptor hormonal positivo, cancro da mama com receptor 2 do factor de crescimento epidérmico humano negativo, que está localmente avançado ou que se espalhou para outras partes do corpo (metastásico). As mulheres que não tenham atingido a menopausa também serão tratadas com um medicamento chamado agonista da hormona liberadora de hormona luteinizante (LHRH).
Faslodex pode ser administrado em combinação com palbociclib. É importante que você também leia o prospecto de palbociclib. Se tiver alguma pergunta sobre palbociclib, consulte o seu médico
2. O que precisa saber antes de começar a usar Faslodex
Não use Faslodex:
- se é alérgica a fulvestrante ou a qualquer um dos outros componentes deste medicamento (incluídos na seção 6)
- se está grávida ou em período de amamentação
- se apresenta problemas hepáticos graves
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Faslodex se algo disto se aplicar a si:
- problemas de rim ou fígado
- contagem baixa de plaquetas (que ajudam à coagulação do sangue) ou alterações hemorrágicas
- problemas prévios de coágulos sanguíneos
- osteoporose (perda de densidade óssea)
- alcoolismo
Crianças e adolescentes
Faslodex não é indicado em crianças e adolescentes menores de 18 anos.
Uso de Faslodex com outros medicamentos
Informa o seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Em particular, deve dizer ao seu médico se está a utilizar anticoagulantes (medicamentos para prevenir os coágulos sanguíneos).
Gravidez e amamentação
Não deve utilizar Faslodex se está grávida. Se pode ficar grávida, deve utilizar um método anticonceptivo eficaz enquanto estiver em tratamento com Faslodex e durante dois anos após a sua última dose.
Não deve amamentar enquanto estiver em tratamento com Faslodex.
Condução e uso de máquinas
Não se espera que Faslodex afete a sua capacidade para conduzir ou utilizar máquinas. No entanto, se se sentir cansada após o tratamento, não conduza nem utilize máquinas.
Faslodex contém10%p/v de etanol (álcool),ou seja, até 500 mg por injeção, o que equivale a 12 ml de cerveja ou 5 ml de vinho.
Este medicamento é prejudicial para pessoas que padecem de alcoolismo.
O conteúdo em álcool deve ser tido em conta no caso de grupos de alto risco, como pacientes com doenças do fígado, ou epilepsia.
Faslodex contém 500 mg de álcool benzílico em cada injeção, equivalente a 100 mg/ml.
O álcool benzílico pode provocar reações alérgicas.
Faslodex contém 750 mg de benzoato de benzilo em cada injeção, equivalente a 150 mg/ml
3. Como usar Faslodex
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose recomendada é 500 mg de fulvestrante (duas injeções de 250 mg/5 ml) administrada uma vez por mês com uma dose adicional de 500 mg administrada 2 semanas após a dose inicial.
O seu médico ou enfermeiro administrará Faslodex mediante uma injeção intramuscular lenta em cada um dos seus glúteos.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, Faslodex pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Pode necessitar de tratamento médico urgente se experimentar algum dos seguintes efeitos adversos:
- Reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta, que podem ser sintomas de reações anafilácticas
- Tromboembolismo (aumento do risco de coágulos sanguíneos)*
- Inflamação do fígado (hepatite)
- Falha hepática
Informa imediatamente o seu médico, farmacêutico ou enfermeiro se notar algum dos seguintes efeitos adversos:
Efeitos adversos muito frequentes(pode afetar mais de 1 em cada 10 pessoas)
- Reações no local da injeção, como dor e/ou inflamação
- Níveis anormais de enzimas hepáticos (em análise de sangue)*
- Náuseas (sensação de mal-estar)
- Debilidade, cansaço*
- Dor articular e musculoesquelética
- Sofocos
- Erupção cutânea
- Reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta
Todos os efeitos adversos restantes:
Efeitos adversos frequentes(pode afetar até 1 em cada 10 pessoas)
- Dor de cabeça
- Vómitos, diarreia ou perda de apetite*
- Infecções do tracto urinário
- Dor de costas*
- Aumento de bilirrubina (um pigmento da bile produzido pelo fígado)
- Tromboembolismo (aumento do risco de coágulos sanguíneos)*
- Níveis diminuídos de plaquetas (trombocitopenia)
- Hemorragia vaginal
- Dor lombar que se reflete num lado da perna (ciática)
- Debilidade súbita, entorpecimento, formigamento ou perda de movimento na sua perna, especialmente num só lado do corpo, problemas repentinos para caminhar ou de equilíbrio (neuropatia periférica)
Efeitos adversos pouco frequentes(pode afetar até 1 em cada 100 pessoas)
- Fluxo vaginal espesso, branco e candidíase (infecção)
- Hematoma e hemorragia no local da injeção
- Aumento de gama-GT, uma enzima hepática que se identifica num análise de sangue
- Inflamação do fígado (hepatite)
- Falha hepática
- Entorpecimento, formigamento e dor
- Reações anafilácticas
- Inclui efeitos adversos para os quais não se pode avaliar o papel exacto de Faslodex devido à doença subjacente.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V*. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Faslodex
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase ou nas etiquetas das seringas após a abreviatura CAD. A data de validade é o último dia do mês que se indica.
Conservar e transportar em frigorífico (entre 2°C e 8°C).
As desvições de temperatura fora do intervalo de entre 2°C e 8°C devem ser controladas. Isto inclui evitar a conservação a temperaturas superiores a 30°C, e que não exceda um período de 28 dias, durante o qual a temperatura média de conservação do medicamento seja inferior a 25°C (mas por cima de entre 2°C e 8°C). Após as desvições de temperatura, o medicamento deve ser retornado de forma imediata às condições de conservação recomendadas (conservar e transportar em frigorífico entre 2°C e 8°C). As desvições de temperatura têm um efeito acumulativo na qualidade do medicamento, não devendo superar o período de 28 dias por cima da duração da validade de 4 anos de Faslodex. A exposição a temperaturas inferiores a 2°C não danificará o medicamento, desde que este não seja conservado por debaixo dos -20°C.
Conservar a seringa pré-carregada no embalagem original para protegê-la da luz.
O seu profissional de saúde será o responsável pela conservação, uso e eliminação correctos de Faslodex.
Este medicamento pode apresentar um risco para o meio aquático. Os medicamentos não devem ser deitados por os esgotos nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Faslodex
- O princípio ativo é fulvestrante. Cada seringa pré-carregada (5 ml) contém 250 mg de fulvestrante.
- Os outros componentes (excipientes) são etanol (96 por cento), álcool benzílico, benzoato de benzilo e óleo de rícino refinado.
Aspecto do produto e conteúdo do envase
Faslodex é uma solução viscosa, transparente, de incolora a amarela em uma seringa pré-carregada equipada com um fecho à prova de manipulação, que contém 5 ml de solução injetável. Devem ser administradas duas seringas para receber a dose mensal recomendada de 500 mg.
Faslodex apresenta 2 formatos, bem um envase que contém 1 seringa de vidro pré-carregada ou bem um envase que contém 2 seringas de vidro pré-carregadas. São fornecidas, além disso, agulhas com sistema de segurança (“BD SafetyGlide”) para a sua conexão ao corpo de cada seringa.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização
AstraZeneca AB
SE-151 85 Södertälje
Suécia
Responsável pela fabricação
AstraZeneca AB
Karlebyhusentrén
Astraallén
SE-152 57 Södertälje
Suécia
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica/Bélgica/Bélgica AstraZeneca S.A./N.V. Tel: +32 2 370 48 11
| Lituânia UAB AstraZeneca Lituânia Tel: +370 5 2660550 Luxemburgo/Luxemburgo AstraZeneca S.A./N.V. Tel/Tel: +32 2 370 48 11 |
República Checa AstraZeneca República Checa s.r.o. Tel: +420 222 807 111 | Hungria AstraZeneca Kft Tel: +36 1 883 6500 |
Dinamarca AstraZeneca A/S Tlf: +45 43 66 64 62 | Malta Associated Drug Co. Ltd Tel: +356 2277 8000 |
Alemanha AstraZeneca GmbH Tel: +49 40 809034100 | Países Baixos AstraZeneca BV Tel: +31 85 808 9900 |
Estônia AstraZeneca Tel: +372 6549 600 | Noruega AstraZeneca AS Tlf: +47 21 00 64 00 |
Grécia AstraZeneca a.e. Τηλ: + 30 2 106871500 | Áustria AstraZeneca Áustria GmbH Tel: +43 1 711 31 0 |
Espanha AstraZeneca Farmacêutica Espanha, S.A. Tel: +34 91 301 91 00 | Polônia AstraZeneca Pharma Polônia Sp. z o.o. Tel.: +48 22 245 73 00 |
França AstraZeneca Tél: +33 1 41 29 40 00 | Portugal AstraZeneca Produtos Farmacêuticos, Lda. Tel: +351 21 434 61 00 |
Croácia AstraZeneca d.o.o. Tel: +385 1 4628 000 Irlanda AstraZeneca Pharmaceuticals (Irlanda) DAC Tel: +353 1609 7100 | Romênia AstraZeneca Pharma SRL Tel: +40 21 317 60 41 Eslovênia AstraZeneca UK Limited Tel: +386 1 51 35 600 |
Islândia Vistor hf. Sími: +354 535 7000 | República Eslovaca AstraZeneca AB o.z. Tel: +421 2 5737 7777 |
Itália AstraZeneca S.p.A. Tel: +39 02 00704500 | Finlândia AstraZeneca Oy Puh/Tel: +358 10 23 010 |
Chipre Αλ?κτωρ Φαρµακευτικ? Λτδ Τηλ: +357 22490305 | Suécia AstraZeneca AB Tel: +46 8 553 26 000 |
Letônia SIA AstraZeneca Letônia Tel: +371 67377100 | |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: https://www.ema.europa.eu.
--------------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do sector sanitário:
Faslodex 500 mg (2 x 250 mg/5 ml solução injetável) deve ser administrado utilizando duas seringas pré-carregadas, ver seção 3.
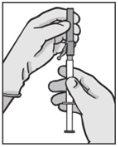
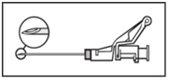
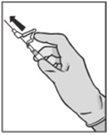
Instruções de administração
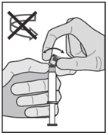
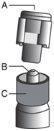
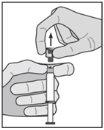
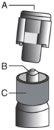
Advertência – Não esterilize em autoclave a agulha com sistema de segurança (Aguja Hipodérmica Protegida “BD SafetyGlide”) antes de a usar. As mãos devem permanecer por detrás da agulha em todo o momento durante a sua utilização e eliminação.
Para cada uma das duas seringas:
| Figura 1
Figura 2
|
| Figura 3
|
| Figura 4
|
NOTA: Active afastado do seu corpo e dos outros. Escute o clique e confirme visualmente que a ponta da agulha está totalmente protegida. | Figura 5
|
Eliminação
As seringas pré-carregadas são sópara um único uso.
Este medicamento pode apresentar um risco para o meio aquático. A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contacto com ele será realizada de acordo com a normativa local.

Quanto custa o FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL em Espanha em 2025?
O preço médio do FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL em dezembro de 2025 é de cerca de 225.7 EUR. Os valores podem variar consoante a região, a farmácia e a necessidade de receita. Confirme sempre com uma farmácia local ou fonte online para obter informações atualizadas.
- País de registo
- Preço médio em farmácia225.7 EUR
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 250 mg/5 mlSubstância ativa: fulvestrantFabricante: Bexal Farmaceutica S.A.Requer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Ever Valinject GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Reddy Pharma Iberia S.A.Requer receita médica
Alternativas a FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL em Polónia
Alternativa a FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de FASLODEX 250 mg/5 ml SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.