
Fulvestrant Medical Vallei
Pergunte a um médico sobre a prescrição de Fulvestrant Medical Vallei

Como usar Fulvestrant Medical Vallei
Folheto informativo para o utilizador
Fulvestrant Medical Valley, 250 mg, solução injectável em seringa pré-cheia
Fulvestranto
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Se tiver alguma dúvida, deve consultar o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito secundário, incluindo possíveis efeitos secundários não mencionados neste folheto, deve informar o seu médico, farmacêutico ou enfermeiro. Ver ponto 4.
Sumário do folheto:
- 1. O que é o Fulvestrant Medical Valley e para que é utilizado
- 2. Informações importantes antes de tomar o Fulvestrant Medical Valley
- 3. Como tomar o Fulvestrant Medical Valley
- 4. Efeitos secundários possíveis
- 5. Como conservar o Fulvestrant Medical Valley
- 6. Conteúdo da embalagem e outras informações
1. O que é o Fulvestrant Medical Valley e para que é utilizado
O Fulvestrant Medical Valley contém a substância ativa fulvestranto, que pertence a um grupo de medicamentos que bloqueiam a ação dos receptores de estrogénio. Os estrogénios, hormonas sexuais femininas, podem por vezes influenciar o desenvolvimento do cancro da mama.
O Fulvestrant Medical Valley é utilizado:
- Como medicamento único, no tratamento de mulheres pós-menopáusicas com um determinado tipo de cancro da mama, designado cancro da mama com receptores de estrogénio positivos, que é localmente avançado ou metastático (espalhado para outras partes do corpo)
ou
- Em combinação com palbociclib no tratamento de mulheres com um determinado tipo de cancro da mama designado cancro da mama com receptores hormonais, sem superexpressão do receptor de crescimento epidérmico humano 2, que é localmente avançado ou metastático. As mulheres que ainda não atingiram a menopausa também receberão um medicamento designado agonista do hormona liberador de hormona luteinizante (LHRH).
Quando o Fulvestrant Medical Valley é administrado em combinação com palbociclib, é importante também ler o folheto informativo do palbociclib. Se tiver alguma dúvida sobre o palbociclib, deve consultar o seu médico.
2. Informações importantes antes de tomar o Fulvestrant Medical Valley
Quando não tomar o Fulvestrant Medical Valley
- se o doente for alérgico ao fulvestranto ou a qualquer outro componente deste medicamento (listados no ponto 6);
- se o doente estiver grávida ou a amamentar;
- se o doente tiver doença hepática grave.
Advertências e precauções
Antes de iniciar o tratamento com o Fulvestrant Medical Valley, deve discutir com o seu médico, farmacêutico ou enfermeiro se o doente:
- tiver doença renal ou hepática;
- tiver contagem baixa de plaquetas (que permitem a coagulação do sangue) ou distúrbios da coagulação;
- tiver tido distúrbios da coagulação do sangue no passado;
- tiver osteoporose (diminuição da densidade mineral dos ossos);
- for dependente de álcool.
Crianças e adolescentes
O Fulvestrant Medical Valley não é recomendado para uso em crianças e adolescentes com menos de 18 anos.
Fulvestrant Medical Valley e outros medicamentos
Deve informar o seu médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar.
Em particular, deve informar o seu médico se estiver a tomar medicamentos anticoagulantes (medicamentos que previnem a formação de coágulos sanguíneos).
Gravidez e amamentação
O Fulvestrant Medical Valley não deve ser utilizado durante a gravidez. Se o doente puder engravidar, é recomendado o uso de métodos anticoncepcionais eficazes durante o tratamento com o Fulvestrant Medical Valley e durante 2 anos após a última dose.
Durante o tratamento com o Fulvestrant Medical Valley, não deve amamentar.
Condução de veículos e utilização de máquinas
Não se espera que o Fulvestrant Medical Valley afete a capacidade de conduzir veículos ou operar máquinas. No entanto, se após a administração do Fulvestrant Medical Valley ocorrer sensação de fadiga, não deve conduzir veículos ou operar máquinas.
O Fulvestrant Medical Valley contém 500 mg de álcool (etanol) em cada injeção,
o que é equivalente a 100 mg/mL (10% em volume). A quantidade de álcool em cada injeção deste medicamento é equivalente a 13 mL de cerveja ou 5 mL de vinho.
A quantidade de álcool neste medicamento provavelmente não terá efeito nos adultos e adolescentes.
O álcool contido neste medicamento pode alterar a ação de outros medicamentos.
Deve falar com o seu médico ou farmacêutico se estiver a tomar outros medicamentos.
Se o doente estiver grávida ou a amamentar, deve consultar o seu médico antes de tomar este medicamento.
Se o doente for dependente de álcool, deve consultar o seu médico antes de tomar este medicamento.
O Fulvestrant Medical Valley contém 500 mg de álcool benzílico em cada injeção,
o que corresponde a 100 mg/mL. O álcool benzílico pode causar reações alérgicas.
O Fulvestrant Medical Valley contém 750 mg de benzoato de benzilo em cada injeção,
o que corresponde a 150 mg/mL.
3. Como tomar o Fulvestrant Medical Valley
O médico ou enfermeiro administrará o Fulvestrant Medical Valley por injeção lenta intramuscular, cada injeção será administrada em um glúteo diferente.
A dose recomendada é de 500 mg de fulvestranto (duas injeções de 250 mg/5 mL), administradas uma vez por mês, e uma dose adicional de 500 mg, administrada 2 semanas após a primeira dose.
Se tiver alguma dúvida adicional sobre a administração deste medicamento, deve consultar o seu médico, farmacêutico ou enfermeiro.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não ocorram em todos.
Efeitos secundários graves
Se ocorrer algum dos seguintes efeitos secundários, pode ser necessário procurar ajuda médica de emergência.
- Reações de hipersensibilidade (alergia), incluindo inchaço do rosto, lábios, língua e (ou) garganta, que podem ser sintomas de reações anafiláticas
- Doença tromboembólica (aumento do risco de formação de coágulos venosos)*
- Hepatite
- Insuficiência hepática.
Se ocorrer algum dos seguintes efeitos secundários, deve informar o seu médico, farmacêutico ou enfermeiro:
Efeitos secundários muito frequentes(podem ocorrer em mais de 1 em cada 10 doentes)
- Sintomas no local da injeção, como dor e (ou) inflamação;
- Alterações na atividade das enzimas hepáticas (em exames de sangue)*;
- Náuseas;
- Sensação de fraqueza, fadiga*;
- Dor nas articulações e dores musculoesqueléticas;
- Ondas de calor;
- Erupções cutâneas;
- Reações de hipersensibilidade (alergia), incluindo inchaço do rosto, lábios, língua e (ou) garganta.
Todos os outros efeitos secundários:
Efeitos secundários frequentes(podem ocorrer em até 1 em cada 10 doentes)
- Dor de cabeça;
- Vômitos, diarreia ou perda de apetite*;
- Infecção do trato urinário;
- Dor nas costas*;
- Aumento da bilirrubina (pigmento produzido pelo fígado);
- Doença tromboembólica (aumento do risco de formação de coágulos venosos)*;
- Contagem baixa de plaquetas (trombocitopenia);
- Sangramento vaginal;
- Dor na parte inferior das costas que irradia para a perna de um lado do corpo (ciática);
- Fraqueza súbita, formigamento, dormência ou perda de mobilidade na perna, especialmente de um lado do corpo, dificuldade súbita em caminhar ou manter o equilíbrio (neuropatia periférica).
Efeitos secundários não muito frequentes(podem ocorrer em até 1 em cada 100 doentes)
- Descarga vaginal espessa e branca e candidíase vaginal (infecção);
- Hematoma e sangramento no local da injeção;
- Aumento da atividade da gamma-glutamiltransferase, enzima hepática medida em exames de sangue;
- Hepatite;
- Insuficiência hepática;
- Formigamento, dormência e dor;
- Reações anafiláticas.
* Inclui efeitos secundários para os quais não é possível avaliar o impacto do Fulvestrant Medical Valley devido à presença de doença subjacente.
Notificação de efeitos secundários
Se ocorrerem algum efeito secundário, incluindo possíveis efeitos secundários não mencionados neste folheto, deve informar o seu médico, farmacêutico ou enfermeiro. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos do Instituto Nacional de Farmacologia, Rua Jerozolimskie 181 C, 02-222 Varsóvia, Tel.: +48 22 49 21 301, Fax: + 48 22 49 21 309, site: https://smz.ezdrowie.gov.pl .
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar o Fulvestrant Medical Valley
O medicamento deve ser conservado em local seguro e fora do alcance das crianças.
Não deve usar este medicamento após o prazo de validade impresso na caixa ou na etiqueta da seringa após "Validade (EXP)". O prazo de validade é o último dia do mês indicado.
Não há recomendações especiais para a temperatura de conservação do medicamento.
Deve conservar a seringa pré-cheia no embalagem original para proteger da luz.
O pessoal médico será responsável pela conservação, uso e eliminação adequados do Fulvestrant Medical Valley.
Este medicamento pode representar um perigo para o meio ambiente aquático.
Não deve jogar medicamentos no esgoto ou em lixeiras domésticas. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são necessários. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o Fulvestrant Medical Valley
- A substância ativa é o fulvestranto. Cada seringa pré-cheia (5 mL) contém 250 mg de fulvestranto.
- Os outros componentes (substâncias auxiliares) são: etanol (96%), álcool benzílico, benzoato de benzilo e óleo de rícino, purificado.
Como é o Fulvestrant Medical Valley e que conteúdo tem a embalagem
O Fulvestrant Medical Valley é uma solução injectável transparente, incolor a amarela, viscosa em seringa pré-cheia, contendo 5 mL de solução para injeção. Deve usar 2 seringas pré-cheias para administrar a dose mensal recomendada de 500 mg.
O Fulvestrant Medical Valley está disponível em embalagem de cartão contendo 2 seringas pré-cheias de vidro. A embalagem de cartão inclui duas agulhas com sistema de proteção (BD SafetyGlide), destinadas a serem conectadas a cada seringa.
Titular da autorização de comercialização
Medical Valley Invest AB
Brädgårdsvägen 28
236 32 Höllviken
Suécia
Fabricante
Laboratorios Farmalán, S.A.
Calle La Vallina, s/n, Edificio 2
Polígono Industrial Navatejera
24193 Villaquilambre, León
Espanha
Este medicamento está autorizado para comercialização nos países membros da Área Económica Europeia sob as seguintes denominações:
Dinamarca
Fulvestrant Medical Valley 250 mg injecção, solução em seringa pré-cheia
Espanha
Kileza 250 mg solução injectável em seringa pré-cheia
Países Baixos
Fulvestrant Xiromed 250 mg solução para injeção em seringa pré-cheia
Islândia
Fulvestrant Medical Valley 250 mg solução injectável em seringa pré-cheia
Alemanha
Fulvestrant AXiromed 250 mg solução para injeção em seringa pré-cheia
Noruega
Fulvestrant Medical Valley
Polónia
Fulvestrant Medical Valley
Suécia
Fulvestrant Medical Valley 250 mg solução injectável em seringa pré-cheia
Reino Unido
Fulvestrant 250 mg, solução para injeção em seringa pré-cheia
Data da última revisão do folheto: 10/2024
Outras fontes de informação
Informação detalhada sobre este medicamento está disponível no site do Instituto Nacional de Farmacologia:
https://www.gov.pl/web/urpl
---------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
O Fulvestrant Medical Valley, 500 mg (2 x 250 mg/5 mL solução para injeção), deve ser administrado usando duas seringas pré-cheias, ver ponto 3.
Instruções de administração
Atenção – não deve esterilizar a agulha com sistema de proteção (BD SafetyGlide Shielding Hypodermic Needle) antes de usá-la. Ao manipular o medicamento e eliminar resíduos, deve evitar o contato das mãos com a agulha.
Aplica-se a ambas as seringas:
- Retirar a ampola de vidro do recipiente e verificar se não está danificada.
- Abrir o pacote exterior da agulha com sistema de proteção (SafetyGlide).
- As soluções para administração parenteral devem ser inspecionadas visualmente antes da administração para verificar se contêm partículas sólidas ou se a cor mudou.
- Segurar a seringa na vertical na parte estrangulada (C). Com a outra mão, segurar a tampa
- (A) e girar suavemente a tampa plástica rígida da tampa no sentido contrário ao dos ponteiros do relógio (ver Figura 1).
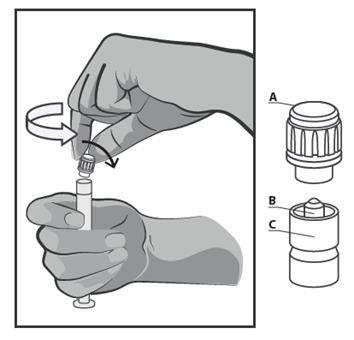
Figura 1.
- Remover a tampa (A) na direção vertical para cima. Para manter a esterilidade, não tocar na ponta da seringa (B) (ver Figura 2).
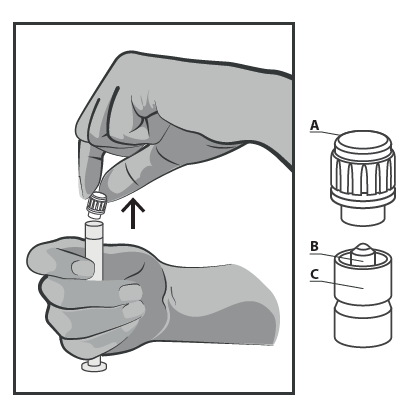
Figura 2.
- Conectar a agulha com sistema de proteção à ponta Luer-Lock e apertar firmemente até o fim (ver Figura 3).
- Verificar se a agulha está conectada à ponta Luer-Lock antes de prosseguir para a posição vertical.
- Puxar a capa da agulha com um movimento decidido para não danificar a ponta afiada.
- Aproximar a agulha cheia do local da injeção.
- Remover a capa da agulha.
- Remover o excesso de ar da seringa.
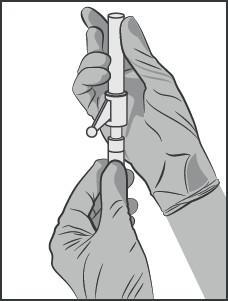
Figura 3.
- Administrar o medicamento por injeção lenta intramuscular (injeção que dura 1-2 minutos), no músculo do glúteo. Para a conveniência da pessoa que administra o medicamento, a ponta da agulha está no mesmo lado da agulha que a alavanca do sistema de proteção da agulha (Ver Figura 4).
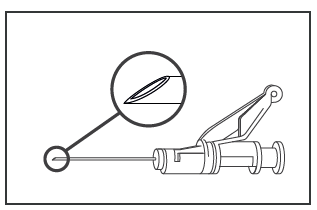
Figura 4.
- Imediatamente após a administração do medicamento, ativar o sistema de proteção da agulha com o dedo, empurrando a alavanca para a frente (ver Figura 5).
ATENÇÃO: Proceda de forma a garantir a segurança para si e para os outros. Escute o clique e verifique visualmente se a ponta da agulha está completamente coberta.
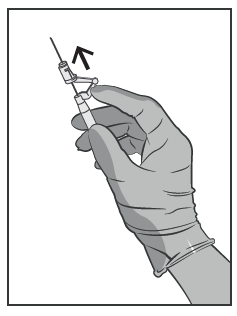
Figura 5.
Eliminação de resíduos
As seringas pré-cheias são destinadas apenasa uso único.
Este medicamento pode representar um perigo para o meio ambiente aquático. Todos os resíduos não utilizados do medicamento ou seus resíduos devem ser eliminados de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorLaboratorios Farmalán, S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Fulvestrant Medical ValleiForma farmacêutica: Solução, 250 mgSubstância ativa: fulvestrantNão requer receita médicaForma farmacêutica: Solução, 250 mgSubstância ativa: fulvestrantRequer receita médicaForma farmacêutica: Solução, 250 mg/ 5 mlSubstância ativa: fulvestrantRequer receita médica
Alternativas a Fulvestrant Medical Vallei noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Fulvestrant Medical Vallei em Espanha
Alternativa a Fulvestrant Medical Vallei em Ukraine
Médicos online para Fulvestrant Medical Vallei
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Fulvestrant Medical Vallei – sujeita a avaliação médica e regras locais.












