
Fulvestrant Pharmascience
Pergunte a um médico sobre a prescrição de Fulvestrant Pharmascience

Como usar Fulvestrant Pharmascience
Folheto informativo para o utilizador
Fulvestrant Pharmascience, 250 mg/5 ml, solução para injeção em seringa pré-cheia
Fulvestrant
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém
informações importantes para a paciente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de alguma dúvida, deve consultar um médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para uma pessoa. Não deve ser dado a outras pessoas. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se a paciente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Fulvestrant Pharmascience e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Fulvestrant Pharmascience
- 3. Como tomar o medicamento Fulvestrant Pharmascience.
- 4. Efeitos não desejados
- 5. Como armazenar o medicamento Fulvestrant Pharmascience
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Fulvestrant Pharmascience e para que é utilizado
O medicamento Fulvestrant Pharmascience contém a substância ativa fulvestrante, que pertence a uma classe de medicamentos
que bloqueiam a ação dos receptores de estrogênio. Os estrogênios, hormônios sexuais femininos, podem
influenciar o desenvolvimento do cancro da mama.
O medicamento Fulvestrant Pharmascience é utilizado:
- como medicamento único, no tratamento de mulheres pós-menopáusicas com um tipo específico de cancro da mama chamado cancro da mama com receptores de estrogênio, que é localmente avançado ou metastático ou
- em combinação com palbociclib no tratamento de mulheres com um tipo específico de cancro da mama chamado cancro da mama com receptores hormonais, sem superexpressão do receptor de crescimento epidérmico humano 2, que é localmente avançado ou metastático. As mulheres que ainda não atingiram a menopausa também receberão um medicamento chamado agonista do hormônio liberador de hormônio luteinizante (LHRH).
Quando o Fulvestrant Pharmascience é administrado em combinação com palbociclib, é importante também
ler o folheto informativo do palbociclib. Em caso de alguma dúvida sobre o palbociclib, deve consultar o médico assistente.
2. Informações importantes antes de tomar o medicamento Fulvestrant Pharmascience
Quando NÃO tomar o medicamento Fulvestrant Pharmascience
- se a paciente tiver hipersensibilidade ao fulvestrante ou a qualquer um dos outros
componentes do medicamento (listados no ponto 6)
- se a paciente estiver grávida ou amamentando
- se a paciente tiver doença hepática grave.
Precauções e advertências
Deve informar o médico, farmacêutico ou enfermeiro antes de tomar o medicamento Fulvestrant
Pharmascience, se a paciente tiver apresentado os seguintes problemas de saúde:
- tem doenças renais ou hepáticas
- tem contagem de plaquetas diminuída (que permitem a coagulação do sangue), ou trombocitopenia
- teve distúrbios de coagulação do sangue no passado;
- tem osteoporose (diminuição da densidade mineral dos ossos)
- é dependente de álcool.
Crianças e adolescentes
O medicamento Fulvestrant Pharmascience não é utilizado em crianças e adolescentes com menos de 18 anos.
Interacções com outros medicamentos
Deve informar o médico, farmacêutico ou enfermeiro sobre todos os medicamentos que a paciente está
tomando atualmente ou recentemente, bem como sobre os medicamentos que a paciente planeia tomar.
Em particular, deve informar o médico se a paciente estiver tomando medicamentos anticoagulantes
(medicamentos que previnem a formação de coágulos sanguíneos).
Gravidez, amamentação e fertilidade
O medicamento Fulvestrant Pharmascience não deve ser utilizado durante a gravidez. Se a paciente puder
engravidar, é recomendado o uso de métodos anticoncepcionais eficazes durante o tratamento com
Fulvestrant Pharmascience e por 2 anos após a última dose do medicamento.
Durante o tratamento com Fulvestrant Pharmascience, não é recomendado amamentar.
Condução de veículos e uso de máquinas
Não se espera que o medicamento Fulvestrant Pharmascience afete a capacidade de conduzir veículos ou
operar máquinas. No entanto, se após a administração do medicamento Fulvestrant Pharmascience
ocorrer sensação de fadiga, não é recomendado conduzir veículos ou operar máquinas.
Fulvestrant Pharmascience contém etanol (álcool)
O medicamento Fulvestrant Pharmascience contém 500 mg de etanol em cada injeção, o que corresponde a
100 mg/ml (10% m/v). Esta quantidade em cada injeção do medicamento corresponde a 13 ml de cerveja
ou 5 ml de vinho.
É pouco provável que a quantidade de álcool contida no medicamento tenha efeitos nos adultos e
adolescentes.
O álcool contido no medicamento pode afetar a ação de outros medicamentos. Se a paciente estiver
tomando outros medicamentos, deve consultar o médico ou farmacêutico.
Se a paciente estiver grávida ou amamentando, antes de tomar o medicamento, deve informar o
médico ou farmacêutico.
Se a paciente for dependente de álcool, antes de tomar o medicamento, deve informar o médico ou
farmacêutico.
Fulvestrant Pharmascience contém álcool benzílico
O medicamento Fulvestrant Pharmascience contém 500 mg de álcool benzílico em cada seringa
pré-cheia, o que corresponde a 100 mg/ml. O álcool benzílico pode causar reações alérgicas.
Fulvestrant Pharmascience contém benzoato de benzilo
O medicamento Fulvestrant Pharmascience contém 750 mg de benzoato de benzilo em cada seringa
pré-cheia, o que corresponde a 150 mg/ml.
3. Como tomar o medicamento Fulvestrant Pharmascience
O medicamento Fulvestrant Pharmascience será administrado por um médico ou enfermeiro. O
medicamento será injetado lentamente por via intramuscular, cada injeção será administrada em um
glúteo diferente.
A dose recomendada é de 500 mg de fulvestrante (duas injeções de 250 mg/5 ml), administradas
uma vez por mês, e uma dose adicional de 500 mg administrada 2 semanas após a primeira dose.
Em caso de alguma dúvida adicional sobre como tomar o medicamento, deve consultar o médico,
farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, o medicamento Fulvestrant Pharmascience pode causar efeitos não
desejados, embora não todos os pacientes os apresentem.
Em caso de ocorrência dos seguintes efeitos não desejados, deve procurar ajuda médica imediatamente:
- reações de hipersensibilidade (alergia), incluindo inchaço facial, labial, lingual e (ou) faríngeo, que podem ser sintomas de uma reação anafilática
- doença tromboembólica (aumento do risco de formação de coágulos venosos)*
- hepatite (inflamação do fígado)
- insuficiência hepática.
Se ocorrer algum dos seguintes efeitos não desejados, deve informar o médico, farmacêutico ou enfermeiro:
Efeitos não desejados muito frequentes (podem ocorrer em mais de 1 em 10 pessoas)
- reações no local da injeção, como dor e (ou) inflamação
- alterações na atividade de enzimas hepáticos (em exames de sangue)*
- náuseas (sensação de enjoo)
- sensação de fraqueza, fadiga*
- dor articular e dor musculoesquelética
- ondas de calor
- erupções cutâneas
- reações de hipersensibilidade (alergia), incluindo inchaço facial, labial, lingual e (ou) faríngeo.
Todos os outros efeitos não desejados:
Efeitos não desejados frequentes (podem ocorrer em até 1 em 10 pessoas)
- dores de cabeça
- vômitos, diarreia ou perda de apetite*
- infecções do trato urinário
- dores nas costas*
- aumento da bilirrubina (pigmento produzido pelo fígado).
- doença tromboembólica (aumento do risco de formação de coágulos venosos)*
- contagem de plaquetas diminuída (trombocitopenia)
- sangramento vaginal
- dor na parte inferior das costas que irradia para a perna de um lado do corpo (ciática)
- fraqueza súbita, formigamento, dormência ou perda de mobilidade na perna, especialmente de um lado do corpo, dificuldade súbita para caminhar ou manter o equilíbrio (neuropatia periférica).
Efeitos não desejados não muito frequentes (podem ocorrer em até 1 em 100 pessoas)
- corrimento vaginal espesso e branco e candidíase vaginal (infecção)
- hematoma e sangramento no local da injeção
- aumento da atividade da gamma-glutamiltransferase, enzima hepática medida em exames de sangue
- hepatite (inflamação do fígado)
- insuficiência hepática
- formigamento, dormência e dor
- reações anafiláticas.
* refere-se a efeitos não desejados para os quais o impacto do medicamento Fulvestrant Pharmascience não
pode ser avaliado devido à doença subjacente.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste
folheto, deve informar o médico ou farmacêutico. Os efeitos não desejados podem ser notificados
diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Produtos Farmacêuticos
da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas, Al.
Jerozolimskie 181C, 02-222 Varsóvia, Tel.: + 48 22 49 21 301, Fax: + 48 22 49 21 309,
site: https://smz.ezdrowie.gov.pl .
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode ajudar a obter mais informações sobre a segurança do
medicamento.
5. Como armazenar o medicamento Fulvestrant Pharmascience
O medicamento deve ser armazenado em local não visível e inacessível a crianças.
Não use este medicamento após o prazo de validade impresso na caixa ou rótulo da seringa
pré-cheia após a abreviação: EXP. O prazo de validade é o último dia do mês indicado.
Armazenar e transportar em temperatura refrigerada (2°C - 8°C).
Deve limitar o armazenamento do medicamento em temperatura diferente de 2°C - 8°C. Deve evitar
armazenar em temperatura superior a 30°C e não exceder o período de 28 dias com temperatura
média de armazenamento abaixo de 25°C (mas acima do intervalo de 2°C - 8°C). Se o intervalo de
temperatura for excedido, deve aplicar imediatamente as condições de armazenamento recomendadas
(armazenar e transportar em temperatura refrigerada a 2°C - 8°C). A exposição a temperatura
inadequada pode ter um efeito cumulativo na qualidade do medicamento e o período de 28 dias não
pode ser excedido durante os 2 anos de validade do medicamento Fulvestrant Pharmascience. A exposição
a temperatura abaixo de 2°C não causa danos ao produto, desde que não seja armazenado em
temperatura abaixo de -20°C.
A seringa pré-cheia deve ser armazenada no embalagem original para proteger da luz.
O pessoal médico será responsável pelo armazenamento adequado, uso e eliminação do embalagem
após o uso do medicamento Fulvestrant Pharmascience.
Este medicamento pode representar um perigo para o meio ambiente aquático. Os medicamentos não
devem ser jogados na canalização ou lixeiras domésticas. Deve perguntar ao farmacêutico como
eliminar os medicamentos que não são mais utilizados. Este procedimento ajudará a proteger o
meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Fulvestrant Pharmascience
A substância ativa do medicamento é o fulvestrante. Cada seringa pré-cheia (5 ml) contém 250 mg
de fulvestrante.
Além disso, o medicamento contém outros componentes: etanol (96%), álcool benzílico, benzoato
de benzilo e óleo de rícino purificado.
Como é o medicamento Fulvestrant Pharmascience e o que contém a embalagem
O medicamento Fulvestrant Pharmascience é uma solução transparente, incolor a amarela, viscosa
em seringa pré-cheia, contendo 5 ml de solução para injeção. Para administrar a dose mensal
recomendada de 500 mg, deve injetar o conteúdo de duas seringas pré-cheias.
O medicamento Fulvestrant Pharmascience tem três tipos de embalagens: embalagem que contém 1
seringa pré-cheia de vidro, embalagem que contém 2 seringas pré-cheias de vidro, embalagem que
contém 6 seringas pré-cheias de vidro, que são feitas de vidro incolor do tipo I com êmbolos de
poliestireno com tampas de elastômero com pontas de proteção em caixa de cartão.
Apropriadamente, são fornecidas uma, duas ou seis agulhas com sistema de proteção (BD SafetyGlide),
destinadas a serem conectadas a cada seringa pré-cheia.
Nem todos os tipos de embalagens precisam estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização:
Pharmascience International Limited
Lampousas 1
1095 Nicósia
Chipre
Fabricante
Laboratorios Farmalan S.A.
Calle La Vallina, s/n, Edificio 2
Polígono Industrial Navatejera
- 24193- Villaquilambre, León, Espanha
Este medicamento está autorizado para comercialização nos países membros da Área Econômica
Europeia sob as seguintes denominações:
| País | Nome do medicamento |
| NL | Fulvestrant Pharmascience 250 mg oplossing voor injectie in een voorgevulde spuit |
| BG | Фулвестрант Фармасайънс 250 mg инжекционен разтвор в предварително напълнена спринцовка Fulvestrant Pharmascience 250 mg solution for injection in pre-filled syringe |
| HU | Fulvestrant Pharmascience 250 mg oldatos injekció el retöltött fecskendőben Ő Ő |
| PL | Fulvestrant Pharmascience |
Data da última atualização do folheto:
Informações destinadas exclusivamente ao pessoal médico:
Fulvestrant Pharmascience, 500 mg (2 x 250 mg/5 ml, solução para injeção) deve ser
administrado usando duas seringas pré-cheias (ver ponto 3).
Instruções de administração
Atenção – Não deve esterilizar a agulha com sistema de proteção (BD SafetyGlide,
Safety Hypodermic Needle) antes de usá-la. Durante o uso do medicamento e a eliminação de
resíduos, deve evitar o contato das mãos com a agulha.
Aplica-se a ambas as seringas:
- Deve remover a seringa pré-cheia do recipiente e verificar se não está danificada.
- Abrir o pacote externo da agulha com sistema de proteção (BD SafetyGlide).
- Antes da administração de soluções parenterais, deve realizar uma inspeção visual para detectar
a presença de partículas sólidas e alterações de cor. - Segurar a seringa na parte estrangulada (C). Com a outra mão, segurar a tampa (A) e girar a
tampa rígida da ponta da seringa no sentido contrário ao dos ponteiros do relógio (ver Figura 1).
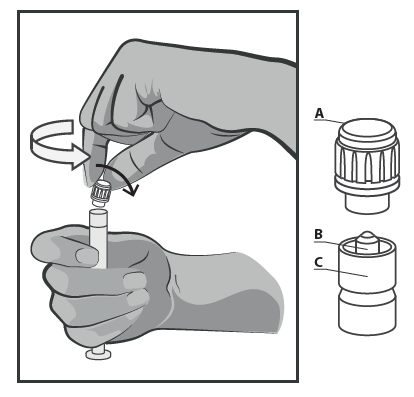
Figura 1
- Remover a tampa rígida da ponta da seringa (A) na posição vertical para cima. Para manter
a esterilidade, não tocar a ponta da seringa (B) (ver Figura 2).
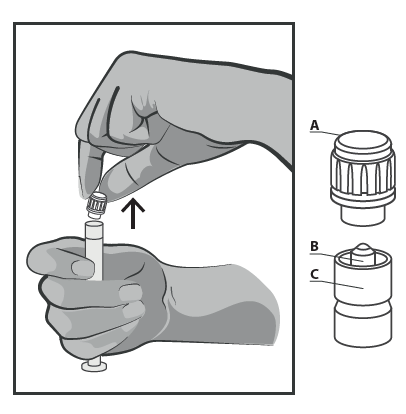
Figura 2
- Conectar a agulha com sistema de proteção à ponta Luer-Lock e apertar para fixar
firmemente (ver Figura 3). - Verificar se a agulha está conectada à ponta Luer antes de passar para a posição vertical.
- Aproximar a agulha carregada do local da injeção.
- Remover a tampa da agulha.
- Remover o excesso de gás da seringa.
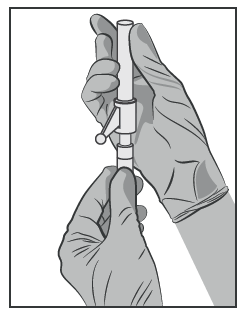
Figura 3
- O medicamento deve ser administrado por via intramuscular, lentamente (1-2 minutos por
injeção), no músculo glúteo (local na nádega). Para a conveniência da pessoa que administra,
a ponta da agulha está no mesmo lado da agulha que o mecanismo de proteção da agulha (ver
Figura 4)
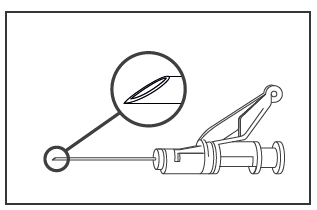
Figura 4
- Imediatamente após a injeção, deve ativar o braço do mecanismo de proteção da agulha com um
movimento de dedo para a frente (ver Figura 5).
Atenção: proceda de forma a garantir a segurança para si e para os outros. Escute o clique e verifique
visualmente se a ponta da agulha está completamente oculta.
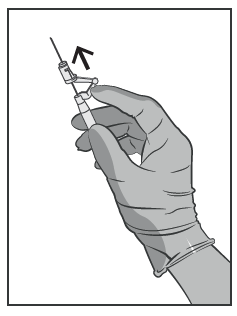
Figura 5
Eliminação de resíduos
A seringa pré-cheia é para uso único .
Este medicamento pode representar um perigo para o meio ambiente aquático. Os resíduos não
utilizados ou os resíduos do medicamento devem ser eliminados de acordo com as regulamentações
locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorLaboratorios Farmalán, S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Fulvestrant PharmascienceForma farmacêutica: Solução, 250 mgSubstância ativa: fulvestrantNão requer receita médicaForma farmacêutica: Solução, 250 mgSubstância ativa: fulvestrantRequer receita médicaForma farmacêutica: Solução, 250 mg/ 5 mlSubstância ativa: fulvestrantRequer receita médica
Alternativas a Fulvestrant Pharmascience noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Fulvestrant Pharmascience em Espanha
Alternativa a Fulvestrant Pharmascience em Ukraine
Médicos online para Fulvestrant Pharmascience
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Fulvestrant Pharmascience – sujeita a avaliação médica e regras locais.












