
FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Pergunte a um médico sobre a prescrição de FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Como usar FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Introdução
Prospecto: informação para o utilizador
Fulvestrant Stada 250 mg solução injetável em seringa precarregada EFG
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Fulvestrant Stada e para que é utilizado
- O que precisa saber antes de começar a usar Fulvestrant Stada
- Como usar Fulvestrant Stada
- Efeitos adversos possíveis
- Conservação de Fulvestrant Stada
- Conteúdo do envase e informação adicional
1. O que é Fulvestrant Stada e para que é utilizado
Fulvestrant Stada contém o princípio ativo fulvestrante, que pertence ao grupo de bloqueantes de estrogénio.
Os estrogénios, um tipo de hormonas sexuais femininas, podem estar em alguns casos implicados no desenvolvimento do cancro da mama.
Fulvestrante é utilizado:
- sozinho, para tratar mulheres pós-menopáusicas com um tipo de cancro da mama chamado cancro da mama com receptor de estrogénio positivo, que está localmente avançado ou que se espalhou para outras partes do corpo (metastásico) ou,
- em combinação com palbociclib para tratar mulheres com um tipo de cancro da mama chamado cancro da mama com receptor hormonal positivo, cancro da mama com receptor 2 do factor de crescimento epidérmico humano negativo, que está localmente avançado ou que se espalhou para outras partes do corpo (metastásico). As mulheres que não tenham atingido a menopausa também serão tratadas com um medicamento chamado agonista da hormona liberadora de hormona luteinizante (LHRH).
Fulvestrante pode ser administrado em combinação com palbociclib. É importante que você leia também o prospecto de palbociclib. Se tiver alguma pergunta sobre palbociclib, consulte o seu médico.
2. O que precisa saber antes de começar a usar Fulvestrant Stada
Não use Fulvestrant Stada
- se é alérgica a fulvestrante ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6)
- se está grávida ou em período de amamentação
- se apresenta problemas hepáticos graves.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar fulvestrante se algo disto lhe aplicar:
- problemas de rim ou fígado
- contagem baixa de plaquetas (que ajudam à coagulação do sangue) ou alterações hemorrágicas
- problemas prévios de coágulos sanguíneos
- osteoporose (perda de densidade óssea)
- alcoolismo.
Crianças e adolescentes
Fulvestrante não é indicado em crianças e adolescentes menores de 18 anos.
Uso de Fulvestrant Stada com outros medicamentos
Informa o seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Em particular, deve dizer ao seu médico se está a utilizar anticoagulantes (medicamentos para prevenir os coágulos sanguíneos).
Gravidez e amamentação
Gravidez
Não deve utilizar fulvestrante se está grávida. Se pode ficar grávida, deve utilizar um método anticonceptivo eficaz enquanto estiver em tratamento com fulvestrante e durante dois anos após a sua última dose.
Amamentação
Não deve amamentar enquanto estiver em tratamento com fulvestrante.
Condução e uso de máquinas
Não se espera que Fulvestrant Stada afete a sua capacidade para conduzir ou utilizar máquinas. No entanto, se se sentir cansada após o tratamento, não conduza nem utilize máquinas.
Uso em desportistas
Deve ser advertido aos pacientes que este medicamento contém fulvestrante, que pode produzir um resultado positivo nos testes de controlo de dopagem.
Fulvestrant Stada contém etanol
Este medicamento contém 1.000 mg de álcool (etanol) em cada dose de 500 mg de fulvestrante. A quantidade de álcool em cada dose de 500 mg deste medicamento equivale a 25 ml de cerveja ou 10 ml de vinho.
Não é provável que a quantidade de álcool deste medicamento tenha um efeito nos adultos.
O álcool presente neste medicamento pode alterar os efeitos de outros medicamentos. Fale com o seu médico ou farmacêutico se está a tomar outros medicamentos.
Se é alcoólatra, consulte o seu médico ou farmacêutico antes de tomar este medicamento.
Fulvestrant Stada contém álcool benzílico
Este medicamento contém 1.000 mg de álcool benzílico em cada dose de 500 mg de fulvestrante. O álcool benzílico pode provocar reações alérgicas.
Consulte o seu médico ou farmacêutico se tem doenças de fígado ou rim. Isto é devido a que se podem acumular no organismo grandes quantidades de álcool benzílico e provocar efeitos adversos (acidose metabólica).
Fulvestrant Stada contém benzoato de benzilo
Este medicamento contém 1.500 mg de benzoato de benzilo em cada dose de 500 mg de fulvestrante.
3. Como usar Fulvestrant Stada
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose recomendada é 500 mg de fulvestrante (duas injeções de 250 mg/5 ml) administrada uma vez por mês com uma dose adicional de 500 mg administrada 2 semanas após a dose inicial.
O seu médico ou enfermeiro administrará fulvestrante mediante uma injeção intramuscular lenta em cada um dos seus glúteos.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Efeitos adversos possíveis
Como todos os medicamentos, fulvestrante pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Pode necessitar de tratamento médico urgente se experimentar algum dos seguintes efeitos adversos:
? Reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta, que podem ser sintomas de reações anafilácticas.
? Tromboembolismo (aumento do risco de coágulos sanguíneos)*
? Inflamação do fígado (hepatite)
? Falha hepática
Informa imediatamente ao seu médico, farmacêutico ou enfermeiro se notar algum dos seguintes efeitos adversos:
Efeitos adversos muito frequentes(pode afetar mais de 1 em cada 10 pessoas)
- reações no local da injeção, como dor e/ou inflamação
- níveis anormais de enzimas hepáticos (em análise de sangue)*
- náuseas (sensação de mal-estar)
- fraqueza, cansaço*
- dor articular e musculoesquelética
- suores
- erupção cutânea.
- reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta
Todos os efeitos adversos restantes:
Efeitos adversos frequentes(pode afetar até 1 em cada 10 pessoas)
- dor de cabeça
- vómitos, diarreia ou perda de apetite*
- infecções do trato urinário
- dor de costas*
- aumento de bilirrubina (um pigmento da bile produzido pelo fígado)
- tromboembolismo (aumento do risco de coágulos sanguíneos)*
- níveis diminuídos de plaquetas (trombocitopenia)
- hemorragia vaginal
- dor lombar que se reflete em um lado da perna (ciática)
- fraqueza súbita, entorpecimento, formigamento ou perda de movimento na sua perna, especialmente em um só lado do corpo, problemas súbitos para caminhar ou de equilíbrio (neuropatia periférica).
Efeitos adversos pouco frequentes(pode afetar até 1 em cada 100 pessoas)
- fluxo vaginal espesso, branco e candidíase (infecção)
- hematoma e hemorragia no local da injeção
- aumento de gamma-GT, uma enzima hepática que se identifica em uma análise de sangue
- inflamação do fígado (hepatite)
- falha hepática
- entorpecimento, formigamento e dor
- reações anafilácticas
- Inclui efeitos adversos para os quais não se pode avaliar o papel exato de fulvestrante devido à doença subjacente.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Fulvestrant Stada
Mantenha este medicamento fora da vista e do alcance das crianças.
Conservar e transportar refrigerado (entre 2°C e 8°C).
Conservar a seringa precarregada no embalagem original para protegê-la da luz.
As desvições de temperatura fora do intervalo de entre 2°C e 8°C devem ser controladas. Isto inclui evitar a conservação a temperaturas superiores a 30°C, e que não exceda um período de 28 dias, durante o qual a temperatura média de conservação do medicamento seja inferior a 25°C (mas acima de entre 2°C e 8°C). Após as desvições de temperatura, o medicamento deve ser retornado de forma imediata às condições de conservação recomendadas (conservar e transportar em frigorífico entre 2°C e 8°C). As desvições de temperatura têm um efeito acumulativo na qualidade do medicamento, não devendo ultrapassar o período de 28 dias por cima da duração da validade de fulvestrante. A exposição a temperaturas inferiores a 2°C não danificará o medicamento, desde que este não seja conservado por debaixo dos -20°C.
Não utilize este medicamento após a data de validade que aparece no envase ou nas etiquetas das seringas após a abreviatura CAD. A data de validade é o último dia do mês que se indica.
O seu profissional de saúde será o responsável pela conservação, uso e eliminação correctos de Fulvestrant Stada.
Este medicamento pode apresentar um risco para o meio aquático. Os medicamentos não devem ser jogados pelas águas residuais nem para o lixo. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Fulvestrant Stada
- O princípio ativo é fulvestrante. Cada seringa precarregada (5 ml) contém 250 mg de fulvestrante. Cada ml de solução contém 50 mg de fulvestrante.
- Os outros componentes (excipientes) são etanol (96%), álcool benzílico, benzoato de benzilo e óleo de rícino refinado.
Aspecto do produto e conteúdo do envase
Fulvestrant Stada é uma solução transparente, de incolora a amarela, praticamente livre de partículas visíveis, oleosa e viscosa, contida em uma seringa precarregada de vidro. Cada seringa contém 5 ml de solução injetável.
Fulvestrant Stada é apresentado em três formatos de envase:
- Caixa de cartão com um blister com uma seringa precarregada, uma agulha estéril hipodérmica (BD SafetyGlide) e um prospecto.
ou
- Caixa de cartão com dois blisters, com uma seringa precarregada cada um, duas agulhas estéreis hipodérmicas (BD SafetyGlide) e um prospecto.
ou
- Caixa de cartão com seis blisters com uma seringa precarregada cada um, seis agulhas estéreis hipodérmicas (BD SafetyGlide) e um prospecto.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização
Laboratório STADA, S.L.
Frederic Mompou, 5
08960 Sant Just Desvern (Barcelona)
Espanha
Responsável pela fabricação
S.C. Rompharm Company S.R.L.
Strada Eroilor nr. 1A,
Otopeni 075100
Romênia
ou
STADA Arzneimittel AG
Stadastr. 2-18, Dortelweil
D-61118 Bad Vilbel
Hessen
Alemanha
ou
STADApharm GmbH
Feodor-Lynen-Str. 35
D-30625 Hannover
Alemanha
ou
STADA Arzneimittel GmbH
Geschäftsanschrift -
Muthgasse 36/2 Doebling
A-1190 Viena
Áustria
Data da última revisão deste prospecto:dezembro 2020
A informação detalhada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/.
-------------------------------------------------------------------------------------------------------------
Esta informaçãoestádestinadaunicamente a profissionais do sector sanitário:
Fulvestrant Stada deve ser administrado utilizando duas seringas precarregadas, ver secção 3.
Instruções de administração
Administre a injeção de acordo com as diretrizes locais para a injeção intramuscular de grandes volumes.
NOTA: Devido à proximidade do nervo ciático, deve ter precaução se inyectar fulvestrante na zona dorsoglútea (ver secção 4.4).
Advertências: Não esterilize em autoclave a agulha com sistema de segurança (Aguja Hipodérmica Protegida “BD SafetyGlide”) antes de seu uso.
As mãos devem permanecer por detrás da agulha em todo momento durante seu uso e eliminação.
Para cada uma das duas seringas:
- Retire o corpo de vidro da seringa da bandeja (blíster) e verifique que não está danificado.
- Abra o envase exterior da agulha com sistema de segurança (“SafetyGlide”).
- Antes de sua administração, as soluções parenterais devem ser inspecionadas visualmente em relação ao conteúdo em partículas e à decoloração.
- Mantenha a seringa em posição vertical.
- Com a outra mão, segure o tapão e gire-o cuidadosamente e retire-o. Para manter a esterilidade, não toque a ponta da seringa (ver Figura 1).
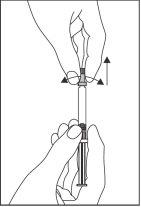
Figura 1
?? Acople a agulha com sistema de segurança ao conector “Luer-Lok” e enrosque-a até que se acople firmemente (ver Figura 2).
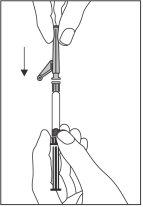
Figura 2
- Verifique que a agulha está acoplada ao conector Luer-Lock antes de deixar de manter em posição vertical.
- Tire do capuchão protetor da agulha em linha reta para não danificar o extremo da mesma.
- Leve a seringa carregada ao ponto de administração.
- Retire o capuchão protetor da agulha.
- Elimine o excesso de gás da seringa.
- Administre lentamente por via intramuscular no glúteo (zona glútea) (1-2 minutos/injeção). Para uma maior comodidade, a posição da agulha com o bisel para cima tem a mesma orientação que o braço da palanca levantado (ver Figura 3).
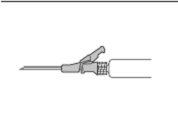
Figura 3
?? Após a injeção, dê imediatamente um único toque com o dedo no braço da palanca para ativar o mecanismo de proteção (ver Figura 4).
NOTA: Ative afastado do seu corpo e dos outros. Escute o clique e confirme visualmente que a ponta da agulha está totalmente protegida.
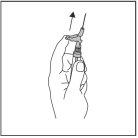
Figura 4
Eliminação
As seringas precarregadas são apenas para um único uso.
Este medicamento pode apresentar um risco para o meio aquático. A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.

Quanto custa o FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Espanha em 2025?
O preço médio do FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em dezembro de 2025 é de cerca de 225.7 EUR. Os valores podem variar consoante a região, a farmácia e a necessidade de receita. Confirme sempre com uma farmácia local ou fonte online para obter informações atualizadas.
- País de registo
- Preço médio em farmácia225.7 EUR
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, 250 mg/5 mlSubstância ativa: fulvestrantFabricante: Bexal Farmaceutica S.A.Requer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Ever Valinject GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Astrazeneca AbRequer receita médica
Alternativas a FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Polónia
Alternativa a FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Ukraine
Médicos online para FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de FULVESTRANT STADA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.












