
FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Pergunte a um médico sobre a prescrição de FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA

Como usar FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Introdução
Prospecto: informação para o paciente
Fulvestrant Hikma 250 mg solução injetável em seringa pré-carregada EFG
Leia todo o prospecto atentamente antes de começar a usar este medicamento,porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Fulvestrant Hikma e para que é utilizado
- O que precisa saber antes de começar a usar Fulvestrant Hikma
- Como usar Fulvestrant Hikma
- Posíveis efeitos adversos
- Conservação de Fulvestrant Hikma
- Conteúdo do envase e informação adicional
1. O que é Fulvestrant Hikma e para que é utilizado
Este medicamento contém o princípio ativo fulvestrant, que pertence ao grupo de bloqueantes de estrógeno. Os estrógenos, um tipo de hormonas sexuais femininas, podem estar em alguns casos implicados no desenvolvimento do cancro da mama.
Fulvestrant é utilizado:
- em monoterapia, para o tratamento de mulheres pós-menopáusicas com um tipo de cancro da mama chamado cancro da mama com receptor estrogénico positivo, que é localmente avançado ou que se espalhou para outras partes do corpo (metastásico), ou
- em combinação com palbociclib para tratar mulheres com um tipo de cancro da mama chamado cancro da mama com receptor hormonal positivo e cancro da mama com receptor 2 do factor de crescimento epidérmico humano negativo, que está localmente avançado ou que se espalhou para outras partes do corpo (metastásico). As mulheres que não tenham chegado à menopausa também serão tratadas com um medicamento chamado agonista da hormona liberadora da hormona luteinizante (LHRH).
Quando Fulvestrant for administrado em combinação com palbociclib, é importante que também leia o prospecto de palbociclib. Se tiver alguma dúvida sobre palbociclib, consulte o seu médico.
2. O que precisa saber antes de começar a usar Fulvestrant Hikma
Não useFulvestrant Hikma:
- se é alérgico a fulvestrant ou a algum dos outros componentes deste medicamento (incluídos na seção 6),
- se está grávida ou em período de amamentação,
- se apresenta problemas graves de fígado.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Fulvestrant Hikma se algo disto lhe aplicar:
- problemas de rim ou fígado,
- contagem baixa de plaquetas (que ajudam à coagulação do sangue) ou alterações hemorrágicas,
- problemas prévios de coágulos sanguíneos,
- osteoporose (perda de densidade óssea),
- alcoolismo.
Crianças e adolescentes
Fulvestrant não é indicado em crianças e adolescentes menores de 18 anos.
Outros medicamentos eFulvestrant Hikma
Informa ao seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Em particular, deve informar ao seu médico se está a utilizar anticoagulantes (medicamentos para prevenir os coágulos sanguíneos).
Gravidez e amamentação
Não deve utilizar este medicamento se está grávida. Se pode engravidar, deve utilizar um método anticonceptivo eficaz enquanto estiver em tratamento com este medicamento e durante dois anos após a última dose.
Não deve amamentar enquanto estiver em tratamento com Fulvestrant Hikma.
Condução e uso de máquinas
Não se espera que este medicamento afete a sua capacidade para conduzir ou utilizar máquinas. No entanto, se se sentir cansada após o tratamento não conduza nem utilize máquinas.
Uso em desportistas
Este medicamento contém fulvestrant que pode produzir um resultado positivo nos testes de controlo de dopagem.
Fulvestrant Hikmacontém etanol
Este medicamento contém 10% w/v etanol (álcool), ou seja até 500 mg em cada seringa que equivale a 10 ml de cerveja ou 4 ml de vinho.
Este medicamento é prejudicial para pessoas que padecem de alcoolismo. A ter em conta em grupos de alto risco, como pacientes com doença hepática ou epilepsia.
Fulvestrant Hikma contém álcool (etanol)
Este medicamento contém 500 mg de álcool (etanol) em cada seringa o que é equivalente a 100 mg/ml (10% w/v). A quantidade em 1 injeção deste medicamento é equivalente a menos de 13 ml de cerveja ou 5 ml de vinho.
Não é provável que a quantidade de álcool neste medicamento tenha um efeito em adultos e adolescentes. O álcool neste medicamento pode alterar os efeitos de outros medicamentos. Consulte o seu médico ou farmacêutico se está a tomar outros medicamentos.
Se é adicto ao álcool, consulte o seu médico ou farmacêutico antes de tomar este medicamento.
Fulvestrant Hikma contém álcool benzílico
Este medicamento contém 500 mg de álcool benzílico em cada seringa precarregada equivalente a 100 mg/ml. O álcool benzílico pode provocar reações alérgicas.
Consulte o seu médico ou farmacêutico se tem doenças de fígado ou rim. Isto é devido a que se podem acumular no organismo grandes quantidades de álcool benzílico e provocar efeitos adversos (acidose metabólica).
Fulvestrant Hikma contém benzoato de benzilo
Este medicamento contém 750 mg de benzoato de benzilo por injeção equivalente a 150 mg/ml.
3. Como usar Fulvestrant Hikma
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose recomendada é de 500 mg de fulvestrant (duas injeções de 250 mg/5ml) administrada uma vez por mês com uma dose adicional de 500 mg administrada 2 semanas após a dose inicial.
O seu médico ou enfermeiro administrará Fulvestrant Hikma mediante uma injeção intramuscular lenta em cada um dos seus glúteos.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone: 91 562 04 20, indicando o medicamento e a quantidade ingerida.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Pode necessitar tratamento médico urgente se experimentar algum dos seguintes efeitos adversos:
- reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta, que podem ser sintomas de reações anafilácticas,
- tromboembolismo (aumento do risco de coágulos sanguíneos)*,
- inflamação do fígado (hepatite),
- falha hepática.
Informa imediatamente ao seu médico, farmacêutico ou enfermeiro se notar algum dos seguintes efeitos adversos:
Efeitos adversos muito frequentes(pode afetar mais de 1 de cada 10 pacientes)
- reações no local da injeção, como dor e/ou inflamação,
- níveis anómalos de enzimas hepáticos (em análise de sangue)*,
- náuseas (sensação de mal-estar),
- debilidade, cansaço*,
- dor articular e musculoesquelética,
- sofocos,
- erupção cutânea,
- reações alérgicas (hipersensibilidade), incluindo inchaço do rosto, lábios, língua e/ou garganta.
Todos os efeitos adversos restantes:
Efeitos adversos frequentes(pode afetar até 1 de cada 10 pacientes)
- dor de cabeça,
- vómitos, diarreia ou perda do apetite*,
- infecções do trato urinário,
- dor de costas*,
- aumento de bilirrubina (um pigmento da bile produzido pelo fígado),
- tromboembolismo (aumento do risco de coágulos sanguíneos)*,
- níveis diminuídos de plaquetas (trombocitopenia),
- hemorragia vaginal,
- dor lombar que se reflete em um lado da perna (ciática),
- debilidade repentina, entorpecimento, formigamento ou perda de movimento na sua perna, especialmente em um só lado do corpo, problemas repentinos para caminhar ou de equilíbrio (neuropatia periférica).
Efeitos adversos pouco frequentes(pode afetar até 1 de cada 100 pacientes)
- fluxo vaginal espesso, branco e candidíase (infecção),
- hematoma e hemorragia no local da injeção,
- aumento de gamma-GT, um enzima hepático que se identifica em uma análise de sangue,
- inflamação do fígado (hepatite),
- falha hepática,
- entorpecimento, formigamento e dor,
- reações anafilácticas.
- Inclui efeitos adversos para os quais não se pode avaliar o papel exacto de fulvestrant devido à doença subjacente.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Fulvestrant Hikma
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase ou na etiqueta da seringa após CAD. A data de validade é o último dia do mês que se indica.
Conservar e transportar refrigerado (entre 2°C e 8°C).
As variações de temperatura fora de 2°C - 8°C devem limitar-se. Isto inclui evitar o armazenamento a temperaturas superiores a 30°C e não ultrapassar um período de 28 dias em que a temperatura média de armazenamento do produto seja inferior a 25°C (mas superior a 2°C - 8°C). Após variações de temperatura, o produto deve ser devolvido imediatamente às condições de armazenamento recomendadas (conservar e transportar em frigorífico entre 2°C e 8 °C). As variações de temperatura têm um efeito acumulativo na qualidade do produto e não se deve exceder o período de 28 dias durante o período de validade de Fulvestrant Hikma. A exposição a temperaturas inferiores a 2°C não danificará o produto desde que não seja armazenado por debaixo de -20°C.
Conservar a seringa pré-carregada no embalagem original para protegê-la da luz.
O seu profissional de saúde será o responsável pela conservação, uso e eliminação correctos de Fulvestrant Hikma.
Este medicamento pode apresentar um risco para o meio aquático. Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Fulvestrant Hikma
- O princípio ativo é fulvestrant. Cada seringa pré-carregada (5 ml) contém 250 mg de fulvestrant.
- Os outros componentes são etanol (96%), álcool benzílico, benzoato de benzilo e óleo de rícino refinado.
Aspecto do produto e conteúdo do envase
Fulvestrant Hikma é uma solução viscosa, transparente, de incolora a amarela em uma seringa pré-carregada que contém 5 ml de solução injetável. Devem ser administradas duas seringas para receber a dose mensal recomendada de 500 mg.
Os envases de Fulvestrant Hikma contêm 1 ou 2 seringas pré-carregadas. Também são fornecidas agulhas de segurança (BD SafetyGlide) para conexão ao corpo de cada seringa.
Além dos packs individuais, Fulvestrant Hikma também está disponível em envases de 4 (2x2) e 6 (3x2) seringas pré-carregadas.
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização:
Hikma Farmacêutica (Portugal), S.A.
Estrada do Rio da Mó n.º 8, 8A e 8B, Fervença
2705-906 Terrugem SNT
Portugal
Email: [email protected]
Responsável pela fabricação
Netpharmalab Consulting Services
Carretera de Fuencarral, 22
28108 – Alcobendas, Madrid
Espanha
Pode solicitar mais informações respeito a este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Hikma Espanha, S.L.U.
Calle Anabel Segura nº11, Edificio A, planta 1ª, oficina 2
28108 - Alcobendas, Madrid
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Alemanha: Fulvestrant Ribosepharm 250 mg/5 ml Injektionslösung in einer Fertigspritze
Áustria: Fulvestrant Ribosepharm 250 mg/5 ml Injektionslösung in einer Fertigspritze
Espanha: Fulvestrant Hikma 250 mg solução injetável em seringa pré-carregada EFG
França: FULVESTRANT HIKMA 250 mg, solution injectable en seringue pré-remplie
Itália: Fulvestrant Hikma
Portugal: Fulvestrant Hikma
Data da última revisão deste prospecto: janeiro 2023
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/)
------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do sector sanitário:
Fulvestrant Hikma 500 mg (2 x 250 mg/5 ml solução injetável) deve ser administrado usando duas seringas pré-carregadas. Ver seção 3.
BD SafetyGlide é uma marca registada de Becton Dickinson and Company e sua CE-marked: CE 0050.
Instruções de administração
Advertência – Não esterilize em autoclave a agulha de segurança (aguja hipodérmica de segurança BD SafetyglideTM) antes de sua utilização. As mãos devem permanecer por detrás da agulha em todo o momento durante sua utilização e eliminação.
Para cada uma das duas seringas:
|
|
|
|
|
|
|
|
? Após a injeção, dê imediatamente um toque com o dedo no braço da alavanca para activar o mecanismo de segurança (ver Figura 5). NOTA: Actívelo afastado do seu corpo e dos outros. Escute o clique e confirme visualmente que a ponta da agulha está totalmente protegida. |
|
Eliminação
As seringas pré-carregadas são para um só uso.
Este medicamento pode supor um risco para o meio aquático. Qualquer medicamento não utilizado ou material de desperdício deve ser eliminado de acordo com os requisitos locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, 250 mg/5 mlSubstância ativa: fulvestrantFabricante: Bexal Farmaceutica S.A.Requer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Ever Valinject GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 250 mgSubstância ativa: fulvestrantFabricante: Astrazeneca AbRequer receita médica
Alternativas a FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Polónia
Alternativa a FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA em Ukraine
Médicos online para FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de FULVESTRANT HIKMA 250 mg SOLUÇÃO INJETÁVEL EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.




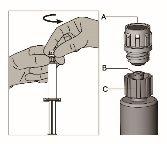 Figura 1
Figura 1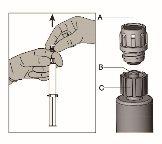 Figura 2
Figura 2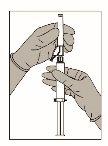 Figura 3
Figura 3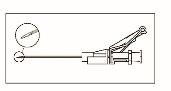 Figura 4
Figura 4 Figura 5
Figura 5







