
Lutrate Depot

Pergunte a um médico sobre a prescrição de Lutrate Depot

Como usar Lutrate Depot
Folheto informativo para o doente
Lutrate Depot, 22,5 mg, pó e solvente para suspensão injectável de libertação prolongada
de libertação prolongada
Leuprorelina
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas adicionais, deve consultar um médico ou farmacêutico .
- O medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outras pessoas, mesmo que tenham os mesmos sintomas de doença.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Lutrate Depot e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Lutrate Depot
- 3. Como tomar o medicamento Lutrate Depot
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Lutrate Depot
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Lutrate Depot e para que é utilizado
O Lutrate Depot é um medicamento disponível sob a forma de pó branco em frasco, que é transformado
em suspensão para injeção intramuscular. O Lutrate Depot contém a substância ativa – leuprorelina
(também conhecida como leuprolida), que pertence a um grupo de medicamentos chamados agonistas do hormônio
liberador do hormônio luteotrópico (LHRH). Estes medicamentos reduzem a concentração do hormônio
sexual – testosterona.
O medicamento Lutrate Depot é prescrito por um médico para o tratamento paliativo do cancro da próstata
avançado.
2. Informações importantes antes de tomar o medicamento Lutrate Depot
Quando não tomar o medicamento Lutrate Depot
- se o doente for alérgico ao LHRH, medicamentos do grupo dos agonistas do LHRH ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6). As reações alérgicas podem causar: erupções cutâneas, coceira da pele, dificuldades respiratórias ou inchaço do rosto, lábios, garganta ou língua.
- se o doente tiver sido submetido a uma orquiectomia (cirurgia de remoção dos testículos)
- em mulheres e crianças
- se o doente tiver compressão da medula espinhal ou metástases na coluna vertebral, não deve tomar o medicamento Lutrate Depot como monoterapia (ou seja, como único medicamento) para o tratamento do cancro da próstata
Precauções e advertências
- Antes de iniciar o tratamento com Lutrate Depot, deve consultar um médico ou farmacêutico.
- O estado do doente pode piorar durante as primeiras semanas de tratamento, mas deve melhorar à medida que o tratamento continue. Os sintomas objetivos e subjetivos incluem: aumento transitório da concentração de testosterona (hormônio sexual masculino), ondas de calor, dor nas costas, distúrbios do sistema nervoso (incluindo depressão) ou dificuldades em urinar.
- Se o doente acredita que teve uma reação alérgica (dificuldade respiratória, asma, rinite, inchaço do rosto, urticária, erupções cutâneas), deve parar de tomar o medicamento e informar o seu médico.
- Deve informar o médico se o doente está em grupo de risco ou se apresenta alguma das seguintes condições, pois o médico pode precisar realizar exames de controle mais frequentes:
- se o doente tiver equimoses ou sangramento de origem desconhecida ou se não se sentir bem em geral. Embora estes sintomas sejam raros, podem indicar uma alteração no número de glóbulos vermelhos ou brancos.
- se o doente tiver uma doença metabólica
- se o doente tiver problemas cardíacos ou palpitações
- se o doente tiver diabetes
- Deve informar o médico se o doente já teve um tumor pituitário (tumor não cancerígeno da glândula pituitária). Foram relatados casos de apoplexia pituitária (necrose parcial do tecido pituitário) após o início do tratamento com este tipo de medicamento em doentes com tumor pituitário. Os sintomas de apoplexia pituitária podem incluir: dor de cabeça súbita, visão dupla, alterações visuais e até perda de visão, bem como alterações da consciência.
- Deve informar o médico se o doente tiver distúrbios de coagulação, trombocitopenia ou se estiver tomando anticoagulantes. Pode ser necessário realizar controles mais frequentes da função hepática, pois foram relatados distúrbios da função hepática e icterícia (amarelamento dos olhos e da pele) durante o tratamento com leuprorelina.
- Durante o tratamento com leuprorelina, foram relatados casos de fraturas da coluna vertebral, paralisia, diminuição da pressão arterial e aumento da pressão arterial.
- Em doentes que tomam Lutrate Depot, foi observado o aparecimento de depressão, que pode ser grave. Em caso de humor depressivo, deve informar o médico.
- Foram relatados casos de diminuição da densidade óssea (fragilidade ou rarefação óssea) após o tratamento com leuprorelina. O médico pode considerar a administração de um medicamento do grupo dos antiandrogénios durante o tratamento com Lutrate Depot. Nesse caso, deve ter especial atenção ao aparecimento de tromboflebite e outros sintomas de distúrbio de coagulação, bem como edemas (das mãos, pés ou articulações), pois o risco destes aumenta com a administração concomitante de antiandrogénio e Lutrate Depot.
- Se o doente apresentar compressão da medula espinhal e (ou) distúrbios da micção e (ou) hematúria (presença de sangue na urina), o médico pode iniciar, se necessário, uma conduta adicional para prevenir complicações neurológicas (por exemplo, formigamento nas mãos e pés, paralisia) ou obstrução da uretra (tubo que transporta a urina da bexiga para o exterior do corpo). O doente deve ter uma supervisão médica contínua durante as primeiras semanas de tratamento.
- Em doentes, podem ocorrer alterações metabólicas (por exemplo, intolerância à glicose ou agravamento de uma diabetes pré-existente), alterações de peso e distúrbios cardiovasculares.
- Durante o tratamento com leuprorelina, deve ser monitorizado o doente com doença metabólica ou cardiovascular, especialmente doentes com insuficiência cardíaca congestiva prévia (doença em que o coração não é capaz de fornecer sangue suficiente para outras partes do corpo).
- Antes de tomar o medicamento Lutrate Depot, deve discutir com o médico, farmacêutico ou enfermeiro se o doente tiver fígado gorduroso.
- Durante o tratamento, pode ser necessário realizar alguns exames de sangue para garantir a eficácia do medicamento Lutrate Depot.
- Pode ocorrer diminuição do interesse sexual, ondas de calor e, por vezes, diminuição do tamanho dos testículos e da sua função. Após o término do tratamento com Lutrate Depot, o doente pode recuperar a fertilidade.
- Como o Lutrate Depot pode interferir com os resultados de alguns exames laboratoriais, o doente deve informar o médico que prescreveu os exames sobre a tomada deste medicamento.
- Em doentes que já tiveram convulsões, com epilepsia, com distúrbios da circulação cerebral, com anomalias ou tumores do sistema nervoso central e em doentes que tomam medicamentos que podem causar convulsões, bem como, embora em menor medida, em doentes que não pertencem a nenhum destes grupos, podem ocorrer convulsões durante o tratamento.
- Deve informar o médico se o doente tiver doenças cardíacas ou vasculares, incluindo distúrbios do ritmo cardíaco (arritmia) ou se estiver tomando medicamentos para estas condições. A administração de Lutrate Depot pode agravar os distúrbios do ritmo cardíaco.
- Se o doente apresentar dores de cabeça fortes ou recorrentes, dificuldades visuais e zumbido ou tinido nos ouvidos, deve procurar imediatamente um médico.
- Foram relatados casos de erupções cutâneas graves, incluindo síndrome de Stevens-Johnson e necrólise epidérmica tóxica (SJS/TEN), associados à administração de leuprorelina. Em caso de aparecimento de qualquer um dos sintomas relacionados com reações cutâneas graves descritas no ponto 4, a administração de leuprorelina deve ser interrompida e o médico deve ser contactado imediatamente.
Lutrate Depot e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar. É possível que estes possam ser tomados com o medicamento Lutrate Depot, mas a decisão será tomada pelo médico.
O Lutrate Depot pode interferir com a ação de alguns medicamentos utilizados para distúrbios do ritmo cardíaco (por exemplo, quinidina, procanamida, amiodarona e sotalol) ou pode aumentar o risco de distúrbios do ritmo cardíaco quando administrado com alguns outros medicamentos, como metadona (utilizada para reduzir a dor ou como um dos medicamentos utilizados no tratamento da dependência de drogas),
com moxifloxacina (antibiótico), medicamentos antipsicóticos utilizados em doenças psiquiátricas graves.
Gravidez e amamentação
O medicamento Lutrate Depot não é destinado a ser utilizado em mulheres.
Este medicamento é contraindicado em mulheres grávidas. A sua administração durante a gravidez pode causar aborto espontâneo.
Condução de veículos e utilização de máquinas
Não foi estudado o efeito do medicamento Lutrate Depot na capacidade de conduzir veículos e utilizar máquinas.
Durante o tratamento, podem ocorrer distúrbios visuais e tonturas. Se ocorrerem no doente, este não deve conduzir veículos ou utilizar máquinas.
Lutrate Depot contém sódio
O medicamento contém menos de 1 mmol (23 mg) de sódio por 1 frasco, ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar o medicamento Lutrate Depot
Dose
O medicamento Lutrate Depot deve ser administrado exclusivamente por um médico ou enfermeiro, que também
se encarregará da preparação da solução.
Adultos, incluindo doentes idosos
A dose recomendada de Lutrate Depot é uma injeção por via intramuscular a cada três meses. Após a reconstituição do pó em suspensão, administra-se uma injeção única por via intramuscular a cada três meses.
O local da injeção deve ser alterado em intervalos regulares.
O Lutrate Depot deve ser administrado exclusivamente por via intramuscular. Não deve ser administrado por outra via.
A intensidade do tratamento é decidida pelo médico.
Uso em crianças
O Lutrate Depot não é indicado para uso em crianças.
Uso de dose maior do que a recomendada de Lutrate Depot
É improvável que um médico ou enfermeiro não saiba a dosagem correta. No entanto, se o doente suspeitar que recebeu uma dose maior do que a recomendada, deve informar imediatamente o médico, para que sejam tomadas as medidas adequadas.
Omissão da administração de Lutrate Depot
É importante não omitir a administração de uma dose de Lutrate Depot. Se o doente esquecer uma injeção, deve contactar o médico o mais rápido possível, para que seja realizada a próxima injeção.
Interrupção do tratamento com Lutrate Depot
Como o tratamento com Lutrate Depot é de longa duração, a interrupção do tratamento pode causar agravamento dos sintomas da doença. Portanto, não deve interromper o tratamento sem o consentimento do médico.
Em caso de dúvidas adicionais sobre a administração deste medicamento, deve consultar um médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Deve informar imediatamente o médico se o doente apresentar: respiração ofegante súbita, dificuldades respiratórias, inchaço dos olhos, face ou lábios, erupções cutâneas ou coceira da pele
(especialmente aquelas que afetam todo o corpo).
Foram relatados os seguintes efeitos não desejados:
Muito frequentes(podem ocorrer em mais de 1 em 10 doentes):
ondas de calor e reações no local da injeção
Frequentes(podem ocorrer em menos de 1 em 10 doentes):
suores frios, sudorese excessiva (suor excessivo), coceira (prurido), fadiga,
insónia (dificuldade em adormecer), diminuição da libido, tonturas, rubor, náuseas (enjoo),
diarreia, diminuição do apetite, distúrbios da ereção, fraqueza (diminuição ou perda de forças),
dor nas costas, dor nas articulações e reações no local da injeção, como: dor, endurecimento, rubor
(vermelhidão da pele), dor no trato urinário, diminuição do fluxo urinário, necessidade frequente de urinar, alterações do humor e depressão após tratamento prolongado com leuprorelina, alterações da atividade das enzimas hepáticas e aumento da concentração de triglicérides no sangue (aumento da concentração de lipídios no sangue), aumento da concentração de glicose no sangue
Pouco frequentes(podem ocorrer em menos de 1 em 100 doentes):
concentração elevada de colesterol no sangue, distúrbios do sono, ansiedade, distúrbios do paladar, formigamento
(distúrbios da sensação cutânea), dor de cabeça, sonolência (sonolência), distúrbios visuais, inflamação do revestimento dos pulmões, zumbido nos ouvidos (tinido), dor na região abdominal, constipação, nódulos, rubor,
coceira generalizada (prurido), suores noturnos, dor nas costas, dor muscular, dor no pescoço, dor nas mamas, dor na região pélvica, atrofia testicular, distúrbios testiculares, sensação de calor, alterações do humor e depressão após tratamento curto com leuprorelina, alterações dos resultados dos exames de sangue e alterações no eletrocardiograma (prolongamento do intervalo QT) e reações no local da injeção, como: urticária, sensação de calor e hemorragia
Frequência desconhecida(frequência não pode ser estimada com base nos dados disponíveis):
pneumonite, doença pulmonar, hipertensão intracraniana idiopática (aumento da pressão intracraniana em torno do cérebro, caracterizada por dor de cabeça, visão dupla e outros sintomas visuais, bem como zumbido ou tinido em um ou ambos os ouvidos), manchas vermelhas, planas ou redondas no tronco, frequentemente com bolhas no centro, descamação da pele, úlceras na boca, garganta, nariz, genitálias e olhos - estas erupções cutâneas graves podem ser precedidas por febre e sintomas semelhantes aos da gripe (síndrome de Stevens-Johnson, necrólise epidérmica tóxica), vermelhidão da pele e erupção cutânea pruriginosa (erupções cutâneas tóxicas), reação cutânea que causa o aparecimento de pontos ou manchas vermelhas na pele, que podem parecer uma mira com um centro vermelho-escuro cercado por anéis vermelhos mais claros (eritema multiforme)
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados no folheto, deve consultar um médico ou farmacêutico. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos do Instituto Nacional de Farmácia e Medicamentos, Rua do Instituto Nacional de Farmácia e Medicamentos, 1400-038 Lisboa, telefone: +351 21 798 7000, fax: +351 21 798 7030, site da internet: https://www.infarmed.pt
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização ou ao seu representante em Portugal.
A notificação de efeitos não desejados pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Lutrate Depot
O médico e o farmacêutico estão informados sobre como conservar este medicamento.
O medicamento deve ser conservado em local não visível e inacessível às crianças.
Não conservar a uma temperatura superior a 25°C. Não congelar.
Não usar este medicamento após o prazo de validade impresso na caixa, frasco e ampola-injetora após "EXP". O prazo de validade na ampola-injetora é o mesmo que no frasco. O prazo de validade indica o último dia do mês indicado.
Os medicamentos não devem ser jogados na canalização ou nos contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Lutrate Depot
A substância ativa do medicamento é o acetato de leuprorelina. Cada frasco contém 22,5 mg de acetato de leuprorelina.
A concentração reconstituída do medicamento é de 11,25 mg/ml.
Os outros componentes são:
pó (frasco): poli(ácido láctico) (PLA), citrato de trietila, manitol, carmelose sódica,
solvente (em ampola-injetora): manitol, ácido clorídrico (para ajustar o pH), hidróxido de sódio
(para ajustar o pH), água para injeção
Como é o medicamento Lutrate Depot e o que contém a embalagem
Cada embalagem contém um frasco com 22,5 mg de acetato de leuprorelina, 1 ampola-injetora com 2 ml de solvente, 1 dispositivo de conexão e 1 agulha estéril de 20 G.
Titular da autorização de comercialização
+pharma arzneimittel gmbh
Hafnerstrasse 211
8054 Graz
Áustria
Fabricante
GP-Pharm S.A.
Poligono Industrial Els Vinyets - Els Fogars, Sector 2
Carretera Comarcal C -244, Km. 22
08777 Sant Quintí de Mediona (Barcelona)
Espanha
Este medicamento está autorizado para comercialização nos países membros da Área Económica Europeia sob as seguintes designações:
Áustria
Lutrate Depot 22,5 mg Pó e solvente para suspensão injectável de libertação prolongada
Bulgária
Лутрат Депо 22,5 mg прах и разтворител за инжекционна суспензия с
удължено освобождаване
República Checa
Lutrate Depot 22,5 mg
Grécia
Lutrate Depot 22,5 mg Σκόνη και διαλύτης για παρασκευή ενεσίμου
εναιωρήματος παρατεταμένης αποδέσμευσης
Espanha
Leuprorelina GP-Pharm Depot Trimestral 22,5 mg pó e solvente para suspensão injectável de libertação prolongada
Alemanha
Lutrate Depot 22,5 mg Pó e solvente para suspensão injectável de libertação prolongada
Polónia
Lutrate Depot
Portugal
Lutrate Depot 22,5 mg / 2 ml pó e veículo para suspensão injectável de libertação prolongada
Hungria
Politrate Depot 22,5 mg
Itália
Politrate
Para obter informações mais detalhadas sobre este medicamento, deve contactar o representante do titular da autorização de comercialização em Portugal:
+pharma Portugal, Lda.
Rua do Instituto Nacional de Farmácia e Medicamentos, 1400-038 Lisboa, Portugal
telefone: +351 21 798 7000
e-mail: [[email protected]](mailto:[email protected])
Data da última revisão do folheto:maio 2025
Informações destinadas apenas a profissionais de saúde
Preparação do medicamento para administração
IMPORTANTE: Leia atentamente antes de administrar o produto (“Instruções de uso” também estão incluídas na embalagem que contém os componentes do kit do produto)
Deve seguir as regras de assepsia durante o procedimento de preparação do medicamento.
Deve usar apenas o solvente fornecido com o kit.
Após a reconstituição, deve administrar imediatamente o medicamento por injeção intramuscular única.
O medicamento é destinado a uma administração única. Qualquer suspensão restante deve ser eliminada.
Deve verificar o conteúdo do kit e garantir que contém todas as partes listadas no folheto.
A embalagem contém:
- 1 (um) frasco do medicamento Lutrate Depot contendo 22,5 mg de acetato de leuprorelina em pó para suspensão injectável
- 1 (uma) ampola-injetora contendo solvente para reconstituir a suspensão (solução de manitol a 0,8% para injeção)
- 1 (um) dispositivo de conexão necessário para reconstituir o medicamento, juntamente com 1 (uma) agulha estéril de uso único.
1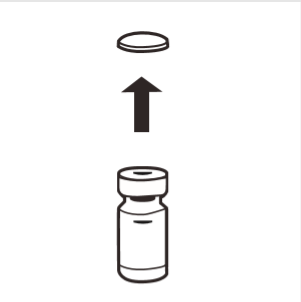 | Remover completamente a tampa de borracha do frasco, expondo o lacre de borracha. Certificar-se de que nenhuma parte da tampa de borracha ficou no frasco. |
2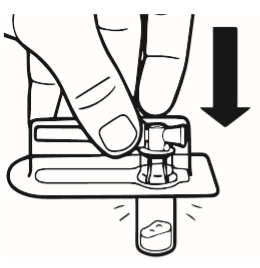 | Colocar o frasco na mesa, na posição vertical. Retirar a cobertura do blister que contém o conector do frasco (MIXJECT). Não retirar o conector do frasco do blister. Colocar o blister com o conector do frasco firmemente na parte superior do frasco, perfurando o frasco que se encontra na posição vertical. Pressionar suavemente até sentir que o conector entrou no lugar. |
3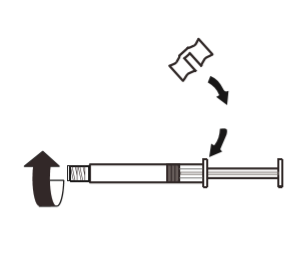 | Fixar o punho branco à seringa de modo a trancá-lo. Desrosquear a tampa de borracha da seringa no sentido contrário ao dos ponteiros do relógio. Em seguida, remover a embalagem do blister do sistema MIXJECT. |
4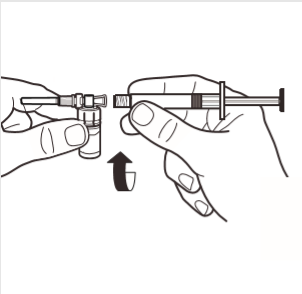 | Ligar a seringa ao adaptador da ampola, rodando no sentido dos ponteiros do relógio, no orifício lateral do adaptador. Rodar suavemente a seringa até que pare de girar, para garantir uma conexão segura. |
5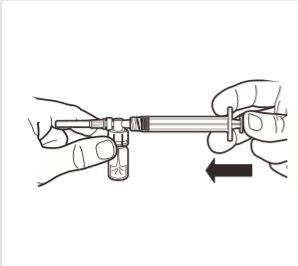 | Mantendo a seringa e a ampola na posição vertical, pressionar lentamente o êmbolo para transferir todo o solvente para a ampola. |
6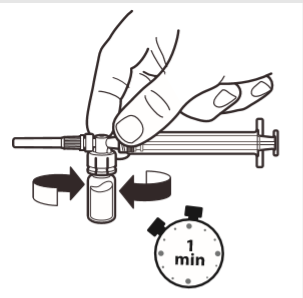 | Com a seringa ainda ligada à ampola, agitar suavemente a ampola durante cerca de um minuto, até obter uma suspensão branca e homogênea. Para evitar a separação da suspensão, deve prosseguir imediatamente para os passos seguintes. |
7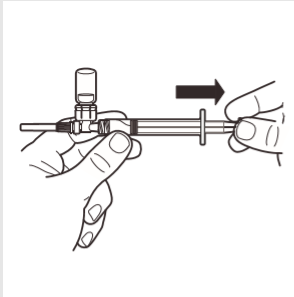 | Virar o sistema MIXJECT de modo a que a ampola fique no topo. Segurar firmemente o sistema MIXJECT pela seringa e puxar lentamente o êmbolo para introduzir o produto preparado na seringa. Parte do produto pode sedimentar ou aderir às paredes da ampola. É um fenômeno normal. |
8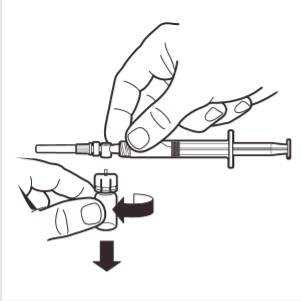 | Desligar o adaptador da ampola do sistema MIXJECT ligado à seringa: segurar firmemente a seringa e rodar a ampola (segurando a cobertura de plástico do adaptador) no sentido dos ponteiros do relógio. |
9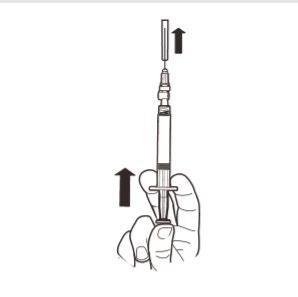 | Segurar a seringa na vertical. Com a outra mão, puxar a tampa da agulha para cima. Pressionar o êmbolo para remover o ar da seringa. A seringa que contém o produto está pronta para administração imediata. |
10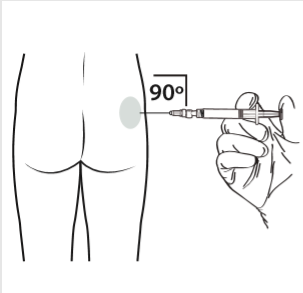 | Realizar a injeção intramuscular, introduzindo a agulha a 90 graus na região da nádega. Certificar-se de que foi injetada a totalidade do produto. Os locais de injeção devem ser alternados. |
1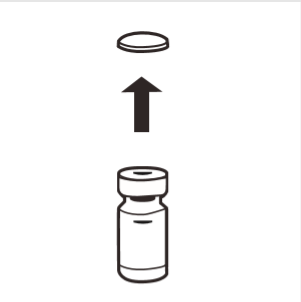 | Remover completamente a tampa de borracha do frasco, expondo o lacre de borracha. Certificar-se de que nenhuma parte da tampa de borracha ficou no frasco. |
2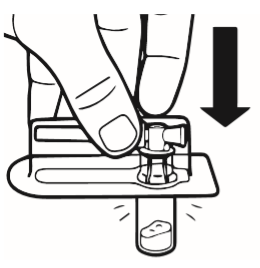 | Colocar o frasco na mesa, na posição vertical. Retirar a cobertura do blister que contém o conector do frasco (MIXJECT). Não retirar o conector do frasco do blister. Colocar o blister com o conector do frasco firmemente na parte superior do frasco, perfurando o frasco que se encontra na posição vertical. Pressionar suavemente até sentir que o conector entrou no lugar. |
3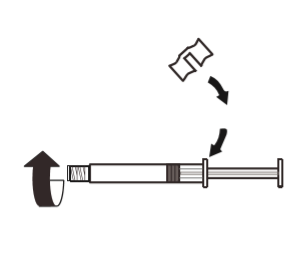 | Fixar o punho branco à seringa de modo a trancá-lo. Desrosquear a tampa de borracha da seringa no sentido contrário ao dos ponteiros do relógio. Em seguida, remover a embalagem do blister do sistema MIXJECT. |
4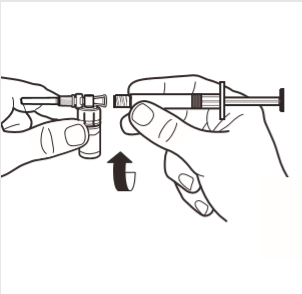 | Ligar a seringa ao adaptador da ampola, rodando no sentido dos ponteiros do relógio, no orifício lateral do adaptador. Rodar suavemente a seringa até que pare de girar, para garantir uma conexão segura. |
5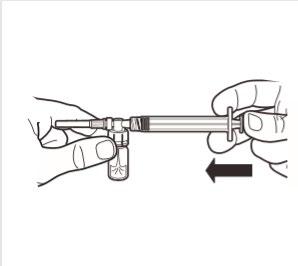 | Mantendo a seringa e a ampola na posição vertical, pressionar lentamente o êmbolo para transferir todo o solvente para a ampola. |
6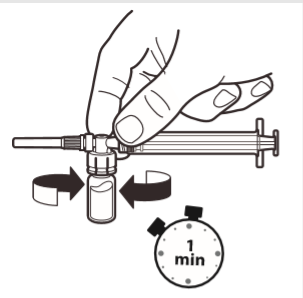 | Com a seringa ainda ligada à ampola, agitar suavemente a ampola durante cerca de um minuto, até obter uma suspensão branca e homogênea. Para evitar a separação da suspensão, deve prosseguir imediatamente para os passos seguintes. |
7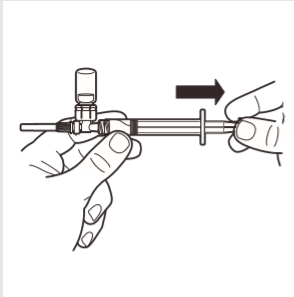 | Virar o sistema MIXJECT de modo a que a ampola fique no topo. Segurar firmemente o sistema MIXJECT pela seringa e puxar lentamente o êmbolo para introduzir o produto preparado na seringa. Parte do produto pode sedimentar ou aderir às paredes da ampola. É um fenômeno normal. |
8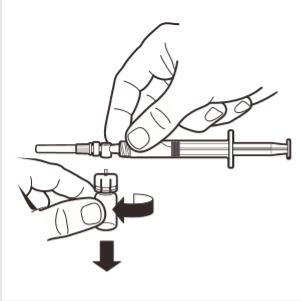 | Desligar o adaptador da ampola do sistema MIXJECT ligado à seringa: segurar firmemente a seringa e rodar a ampola (segurando a cobertura de plástico do adaptador) no sentido dos ponteiros do relógio. |
9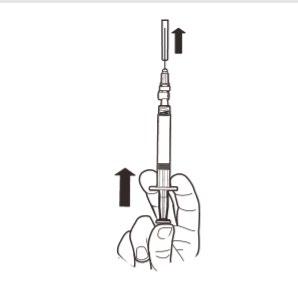 | Segurar a seringa na vertical. Com a outra mão, puxar a tampa da agulha para cima. Pressionar o êmbolo para remover o ar da seringa. A seringa que contém o produto está pronta para administração imediata. |
10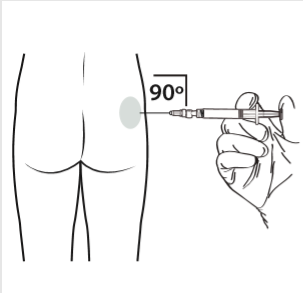 | Realizar a injeção intramuscular, introduzindo a agulha a 90 graus na região da nádega. Certificar-se de que foi injetada a totalidade do produto. Os locais de injeção devem ser alternados. |
Modo de usar
Lutrate Depot - modo de usar
Leia atentamente antes de administrar o produto.
Preparar para uso imediato antes da administração, sob a forma de uma injeção única por via intramuscular.
Deve usar apenas o solvente fornecido com o kit.
O produto é destinado a uma administração única. Qualquer suspensão restante deve ser eliminada.
1 | Remover completamente a tampa de borracha do frasco, expondo o lacre de borracha. Certificar-se de que nenhuma parte da tampa de borracha ficou no frasco. |
2 | Colocar o frasco na mesa, na posição vertical. Retirar a cobertura do blister que contém o conector do frasco (MIXJECT). Não retirar o conector do frasco do blister. Colocar o blister com o conector do frasco firmemente na parte superior do frasco, perfurando o frasco que se encontra na posição vertical. Pressionar suavemente até sentir que o conector entrou no lugar. |
3 | Fixar o punho branco à seringa de modo a trancá-lo. Desrosquear a tampa de borracha da seringa no sentido contrário ao dos ponteiros do relógio. Em seguida, remover a embalagem do blister do sistema MIXJECT. |
4 | Ligar a seringa ao adaptador da ampola, rodando no sentido dos ponteiros do relógio, no orifício lateral do adaptador. Rodar suavemente a seringa até que pare de girar, para garantir uma conexão segura. |
5 | Mantendo a seringa e a ampola na posição vertical, pressionar lentamente o êmbolo para transferir todo o solvente para a ampola. |
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorGP-PHARM S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Lutrate DepotForma farmacêutica: Pó, 22,5 mgSubstância ativa: leuprorelinRequer receita médicaForma farmacêutica: Pó, 45 mgSubstância ativa: leuprorelinRequer receita médicaForma farmacêutica: Pó, 7,5 mgSubstância ativa: leuprorelinRequer receita médica
Alternativas a Lutrate Depot noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Lutrate Depot em Espanha
Alternativa a Lutrate Depot em Ukraine
Médicos online para Lutrate Depot
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Lutrate Depot – sujeita a avaliação médica e regras locais.











