

Eligard 22,5 mg

Pergunte a um médico sobre a prescrição de Eligard 22,5 mg

Como usar Eligard 22,5 mg
Folheto informativo para o utilizador
Eligard 22,5 mg,
pó e solvente para solução injectável
Leuprolida acetato
Antes de tomar o medicamento, deve ler atentamente o conteúdo do folheto, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler mais tarde.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si. Não o deve dar a outros. O medicamento pode ser prejudicial para eles, mesmo que tenham os mesmos sintomas que o senhor.
- Se ocorrerem efeitos secundários, incluindo quaisquer efeitos secundários não mencionados neste folheto, informe o seu médico, farmacêutico ou enfermeiro. Ver secção 4.
Índice do folheto
- 1. O que é o Eligard e para que é utilizado
- 2. Informações importantes antes de tomar o Eligard
- 3. Como tomar o Eligard
- 4. Efeitos secundários possíveis
- 5. Como conservar o Eligard
- 6. Conteúdo da embalagem e outras informações
1. O que é o Eligard e para que é utilizado
A substância ativa do Eligard pertence a um grupo de medicamentos denominados gonadoliberingas. Estes medicamentos são utilizados para inibir a produção de certos hormônios sexuais (testosterona).
O Eligard é utilizado em homens adultos para tratar câncer de próstatacom metástases, sensível à terapêutica hormonal, e em combinação com radioterapia - para tratar câncer de próstata de alto risco sem metástases, sensível à terapêutica hormonal.
2. Informações importantes antes de tomar o Eligard
Quando não tomar o Eligard
- Em mulheres e crianças.
- Se o doente tiver alergiaà substância ativa - leuprolida acetato, a qualquer outro medicamento com ação semelhante ao hormônio natural - gonadotropina ou a qualquer um dos outros componentes do Eligard (listados na secção 6).
- Após orquiectomia, pois o Eligard não causa uma redução adicional da concentração de testosterona no sangue.
- Como único tratamento, se o doente tiver sintomas relacionados com compressão da medula espinhal ou metástases para a coluna vertebral. Neste caso, o Eligard só deve ser utilizado em combinação com outros medicamentos utilizados no tratamento do cancro da próstata.
Precauções e advertências
Antes de iniciar o tratamento com o Eligard, deve discutir com o seu médico, farmacêutico ou enfermeiro:
- Se ocorrer algum dos seguintes casos: doenças cardíacas ou vasculares, incluindo distúrbios do ritmo cardíaco (arritmia) ou se o doente estiver a tomar medicamentos para essas doenças. O risco de distúrbios do ritmo cardíaco pode aumentar durante o tratamento com o Eligard.
O medicamento é geralmente administrado por um médico ou pessoal médico devidamente treinado, pelo que não é provável que seja administrada uma dose maior do que a prescrita.
Se, no entanto, for administrada uma dose maior do que a prescrita, o médico responsável pelo tratamento prescreverá a monitorização do doente e o tratamento apropriado, se necessário.
- Se ocorrerem dificuldades em urinar. Neste caso, deve ser monitorizado o estado do doente durante as primeiras semanas de tratamento.
- Se a compressão da medula espinhal ou as dificuldades em urinar se agravarem. Durante o tratamento com medicamentos com ação semelhante ao Eligard, foram observados casos graves de compressão da medula espinhal e estreitamento dos ureteres, resultando em sintomas como paralisia. Neste caso, é necessário o tratamento padrão.
- Se o doente apresentar dor de cabeça súbita, vómitos, alteração do estado mental ou colapso circulatório nos dois primeiros dias após a administração do Eligard. Neste caso, deve ser informado imediatamente o médico ou o pessoal médico. São sintomas de um estado raro denominado apoplexia pituitária, que foi relatado em associação com a administração de outros medicamentos com ação semelhante ao Eligard.
- Se o doente tiver diabetes(aumento da concentração de açúcar no sangue). Neste caso, deve ser monitorizado o estado do doente durante o tratamento.
- O tratamento com o Eligard pode aumentar o risco de fraturas devidas à osteoporose (redução da densidade óssea).
- Foram relatados casos de depressão em doentes que tomam o Eligard. Se ocorrerem humores depressivos durante o tratamento com o Eligard, deve ser informado o médico.
- Foram relatados casos de doenças cardiovasculares em doentes que tomam medicamentos semelhantes ao Eligard - não se sabe se a ocorrência destes casos está relacionada com a administração destes medicamentos. Se ocorrerem sintomas de doenças cardiovasculares durante o tratamento com o Eligard, deve ser informado o médico.
- Foram relatados casos de convulsões em doentes que receberam o Eligard. Se ocorrerem convulsões durante o tratamento com o Eligard, deve ser informado o médico.
- Se o doente apresentar dores de cabeça fortes ou recorrentes, dificuldades visuais e zumbido ou tinido nos ouvidos, deve procurar imediatamente um médico.
- Se o doente tiver esteatose hepática
Em associação com a leuprolida, foram relatados casos de reações cutâneas graves, incluindo síndrome de Stevens-Johnson e necrólise epidérmica tóxica (SJS/TEN). Se ocorrerem sintomas de reações cutâneas graves, a administração da leuprolida deve ser interrompida e o médico deve ser contactado imediatamente.
Complicações durante o primeiro período de tratamento com o Eligard
Durante a primeira semana de tratamento, é observado um aumento temporário da concentração de testosterona no sangue, o que pode levar a um aumento transitóriodos sintomas da doença ou ao aparecimento de novos sintomas. Estes sintomas incluem, em particular, dor óssea, distúrbios urinários, compressão da medula espinhal e hematuria.
Estes sintomas geralmente desaparecem durante o tratamento contínuo. Se os sintomas não desaparecerem, deve ser contactado o médico responsável pelo tratamento.
Falha do tratamento com o Eligard
Em alguns doentes, são detectados tumores que não são sensíveis à redução da concentração de testosterona no sangue. Se o doente sentir que o Eligard não está a ter o efeito desejado, deve informar o médico responsável pelo tratamento.
Interacções com outros medicamentos
O Eligard pode influenciar a ação de alguns medicamentos utilizados no tratamento de distúrbios do ritmo cardíaco (por exemplo, quinidina, procaína, amiodarona e sotalol) ou aumentar o risco de distúrbios do ritmo cardíaco quando administrado com outros medicamentos (por exemplo, metadona (utilizada para aliviar a dor e desintoxicação em viciados), moxifloxacina (antibiótico), medicamentos antipsicóticos utilizados no tratamento de doenças mentais graves).
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, incluindo os que são vendidos sem receita médica.
Gravidez e amamentação
O Eligard é contraindicado em mulheres.
Condução de veículos e utilização de máquinas
Fadiga, tonturas e distúrbios visuais podem ser efeitos secundários do Eligard ou resultar da doença subjacente. Se ocorrerem efeitos secundários mencionados acima, deve ser exercida cautela ao conduzir veículos e operar máquinas.
3. Como tomar o Eligard
Posologia
Este medicamento deve ser sempre administrado de acordo com as recomendações do médico ou farmacêutico. Em caso de dúvida, consulte o médico ou farmacêutico.
Se o médico não prescrever de outra forma, o Eligard 22,5 mg é administrado uma vez every 3 meses.
A solução injectável forma um reservatório da substância ativa, a partir do qual a substância ativa - leuprolida acetato - é liberada continuamente durante 3 meses.
Exames adicionais
A resposta ao tratamento com o Eligard deve ser monitorizada pelo médico responsável pelo tratamento com base nos sintomas clínicos e na concentração do antígeno específico da próstata (PSA) no sangue.
Método de administração
O Eligard deve ser administrado apenas por um médicoou enfermeiro, que também se encarregará da preparação do produto.
Após a preparação, o Eligard é administrado por injeção subcutânea (injeção na pele). Deve ser evitada a injeção intravenosa (na veia) ou intra-arterial (na artéria). Como no caso de outras substâncias ativas administradas por injeção subcutânea, deve ser alterado periodicamente o local da injeção.
Sobredosagem
O medicamento é geralmente administrado por um médico ou pessoal médico devidamente treinado, pelo que não é provável que seja administrada uma dose maior do que a prescrita.
Se, no entanto, for administrada uma dose maior do que a prescrita, o médico responsável pelo tratamento prescreverá a monitorização do doente e o tratamento apropriado, se necessário.
Omissão de uma dose
Se houver suspeita de que foi omitida uma dose de 3 meses, deve ser informado o médico responsável pelo tratamento.
Interrupção do tratamento
O tratamento de câncer de próstata avançado requer a administração contínua do Eligard.
Por isso, não deve ser interrompido o tratamento, mesmo que o estado do doente melhore ou os sintomas da doença desapareçam.
Se o tratamento for interrompido prematuramente, os sintomas da doença podem agravar-se.
Não interrompa o tratamento sem antes consultar o médico.
Se tiver alguma dúvida adicional sobre a administração deste medicamento, consulte o seu médico, farmacêutico ou enfermeiro.
4. Efeitos secundários possíveis
Como qualquer medicamento, o Eligard pode causar efeitos secundários, embora não todos os doentes os experimentem.
Os efeitos secundários observados durante o tratamento com o Eligard resultam principalmente da ação específica da leuprolida acetato, que aumenta ou diminui as concentrações de certos hormônios. Os efeitos secundários mais frequentemente observados são ondas de calor (em cerca de 58% dos doentes), náuseas, mal-estar e fadiga, bem como reações transitórias no local da injeção.
Efeitos secundários durante o primeiro período de tratamento
Durante as primeiras semanas de tratamento com o Eligard, pode ocorrer um agravamento dos sintomas da doença, devido ao aumento inicial e temporário da concentração de testosterona no sangue. Por isso, o médico pode prescrever a administração de um anti-andrógeno (substância que diminui a ação da testosterona) durante a fase inicial do tratamento, para diminuir o efeito mencionado acima do medicamento (ver também secção 2. Informações importantes antes de tomar o Eligard; Complicações durante o primeiro período de tratamento com o Eligard).
Efeitos secundários locais
Os efeitos secundários locais descritos após a injeção do Eligard são semelhantes aos que ocorrem frequentemente após a injeção subcutânea de medicamentos semelhantes.
Uma sensação de queimadura leve imediatamente após a injeção é muito frequente.
Dor e sensação de picada após a injeção, bem como equimose no local da injeção, são frequentes. Rubor no local da injeção foi relatado frequentemente. Induração e ulceração no local da injeção são pouco frequentes.
Os efeitos secundários locais mencionados acima, que ocorrem após a injeção subcutânea, são leves e descritos como de curta duração. Não reaparecem entre as injeções subsequentes.
Efeitos secundários muito frequentes (podem ocorrer em mais de 1 em cada 10 doentes)
- Ondas de calor
- Hemorragias espontâneas na pele e mucosas, rubor
- Fadiga, efeitos secundários no local da injeção (ver acima:Efeitos secundários locais)
Efeitos secundários frequentes (podem ocorrer em menos de 1 em cada 10 doentes)
- Infecção do trato respiratório superior (sintomas de resfriado)
- Náuseas, mal-estar, diarreia, gastrite (gastrite/enterite)
- Prurido, suores noturnos
- Dor articular
- Urinar frequente (também durante a noite), dificuldades em urinar, dor ao urinar, diminuição da quantidade de urina
- Sensibilidade mamária, aumento mamário, atrofia testicular, dor testicular, infertilidade, distúrbios da ereção, diminuição do tamanho do pênis
- Suores (episódios de tremores com febre alta), fraqueza
- Prolongamento do tempo de sangramento, alterações nos valores dos parâmetros sanguíneos, diminuição do número de glóbulos vermelhos/anemia
Efeitos secundários pouco frequentes (podem ocorrer em menos de 1 em cada 100 doentes)
- Infecções do trato urinário, infecções locais da pele
- Agravamento dos sintomas da diabetes
- Sonhos incomuns, depressão, diminuição da libido
- Tonturas, dor de cabeça, distúrbios da sensação cutânea, insónia, distúrbios do paladar, distúrbios do olfato
- Hipertensão (pressão arterial elevada), hipotensão (pressão arterial baixa)
- Dispneia
- Constipação, secura na boca, dispepsia (distúrbios da digestão com sensação de plenitude gástrica, dor abdominal, arrotos, náuseas, vómitos, sensação de queimadura no estômago), vómitos
- Aumento da humidade da pele, sudorese excessiva
- Dor nas costas, espasmo muscular
- Hematuria (presença de sangue na urina)
- Espasmo da bexiga, urinar frequente, impossibilidade de urinar
- Aumento mamário nos homens, impotência
- Letargia (sonolência), dor, febre
- Aumento de peso
- Perda de equilíbrio, sensação de vazio na cabeça
- Atrofia muscular/perda de tecido muscular após tratamento prolongado
Efeitos secundários raros (podem ocorrer em menos de 1 em cada 1000 doentes)
- Movimentos involuntários
- Perda súbita de consciência, síncope
- Flatulência com evacuação, arrotos
- Alopecia, erupções cutâneas (furónculos na pele)
- Dor mamária
- Ulceração no local da injeção
Efeitos secundários muito raros (podem ocorrer em menos de 1 em cada 10 000 doentes)
- Necrose no local da injeção
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis)
- Alterações no eletrocardiograma (prolongamento do intervalo QT)
- Pneumonite, doença pulmonar
- Hipertensão intracraniana idiopática (aumento da pressão intracraniana em torno do cérebro, caracterizado por dor de cabeça, visão dupla e outros sintomas visuais e zumbido ou tinido nos ouvidos)
Se ocorrerem quaisquer efeitos secundários, incluindo quaisquer efeitos secundários não mencionados neste folheto, informe o seu médico, farmacêutico ou enfermeiro.
Os efeitos secundários podem ser relatados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde
Rua Jerozolimskie 181C, 02-222 Varsóvia
Telefone: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sítio da Internet: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser relatados ao titular da autorização de comercialização.
Ao relatar efeitos secundários, pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar o Eligard
O medicamento deve ser conservado em local não visível e inacessível às crianças.
Não use este medicamento após o prazo de validade impresso na caixa após EXP.
O prazo de validade é o último dia do mês indicado.
Instruções de conservação
Conservar no frigorífico (2°C a 8°C).
Conservar na embalagem original para proteger contra a humidade.
Antes da administração, o medicamento deve ser levado à temperatura ambiente. Deve ser retirado do frigorífico cerca de 30 minutos antes da preparação. Após a retirada do frigorífico, pode ser conservado na embalagem original à temperatura ambiente (abaixo de 25°C) por até 4 semanas.
Após a primeira abertura da bandeja de plástico fechada com película, o medicamento deve ser preparado imediatamente e administrado o mais breve possível ao doente. O produto é para uso único.
Instruções para a eliminação de medicamentos não utilizados ou expirados
Os medicamentos não devem ser eliminados na canalização ou nos contentores de lixo doméstico. Deve ser perguntado ao farmacêutico como eliminar os medicamentos que já não sejam necessários. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o Eligard
A substância ativa do Eligard é a leuprolida acetato.
Cada ampola-injektor (Injektor B) contém 22,5 mg de leuprolida acetato.
Os outros componentes do Eligard são o ácido poli (DL-málico-co-glicólico) (75:25) e a N-metilpirrolidona contidos na ampola-injektor com solvente para solução injectável (Injektor A).
Como é o Eligard e que embalagens estão disponíveis
O Eligard é um pó e solvente para solução injectável.
O Eligard 22,5 mg está disponível nas seguintes embalagens:
- Conjunto composto por uma bandeja termoformada fechada com película e uma agulha estéril de diâmetro 20G, em uma caixa de cartão. A bandeja contém um saco com um agente de absorção de humidade e um sistema de injetores conectados composto por: injetor A com solvente e injetor B com pó, conectador com botão de segurança para os injetores A e B.
- Embalagem coletiva que contém 2 conjuntos, cada um contendo um sistema de injetores conectados.
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali 1
20148 Milão
Itália
Para obter informações mais detalhadas, contacte o representante local do titular da autorização de comercialização:
Recordati Portugal, Lda.
Rua dos Malhões, 2B - 1º
2770-071 Paço de Arcos
Telefone: +351 214 239 500
Este medicamento está autorizado para comercialização nos Estados-Membros do Espaço Económico Europeu sob as seguintes denominações:
Alemanha:
Eligard 22,5 mg
Áustria:
Eligard Depot 22,5 mg
Bélgica:
Depo-Eligard 22,5 mg
Chipre:
Eligard
República Checa:
Eligard
Dinamarca:
Eligard
Estónia:
Eligard
Finlândia:
Eligard
França:
Eligard 22,5 mg
Grécia:
Eligard 22,5 mg
Hungria:
Eligard 22,5 mg
Irlanda:
Eligard 22,5 mg
Itália:
Eligard
Letónia:
Eligard 22,5 mg
Lituânia:
Eligard 22,5 mg
Luxemburgo:
Depo-Eligard 22,5 mg
Paises Baixos:
Eligard 22,5 mg
Noruega:
Eligard
Polónia:
Eligard 22,5 mg
Portugal:
Eligard 22,5 mg
Eslováquia:
Eligard 22,5 mg
Eslovénia:
Eligard 22,5 mg
Espanha:
Eligard Trimestral 22,5 mg
Suécia:
Eligard
Data da última revisão do folheto: 10/2024
Informações destinadas apenas a profissionais de saúde:
Antes de abrir, deve levar o medicamento à temperatura ambiente, retirando-o do frigorífico cerca de 30 minutos antes de usar.
Em primeiro lugar, deve preparar o doente para a administração do medicamento e, em seguida, preparar a solução de acordo com as instruções abaixo. Se a solução não for preparada utilizando a técnica adequada, não deve ser administrada ao doente, pois pode ocorrer falta de eficácia clínica devido à reconstituição inadequada do medicamento.
Deve ser preparado um novo medicamento.
Passo 1
Sobre uma superfície limpa, abrir a bandeja retirando a película, começando pelas extremidades, para remover o conteúdo. Retirar o saco com o agente de absorção de humidade. Retirar o sistema de injetores conectados (Fig. 1.1) da bandeja. Abrir a embalagem que contém a agulha com proteção (Fig. 1.2), rasgando a parte de papel da embalagem.
Aviso: Os injetores A e B não devem ser ainda alinhados.
Fig. 1.1
Conteúdo da bandeja: sistema de injetores conectados
Fig. 1.2
Embaixo da bandeja: Agulha com proteção e adaptador
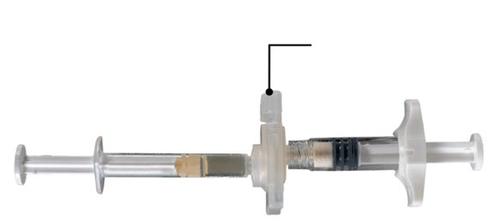

Passo 2
Segurar o botão de segurança no conectador com o polegar e o indicador e pressionar (Fig. 2), até ouvir um clique.
Os dois injetores serão alinhados. A ativação do conectador não requer nenhuma posição especial do sistema de injetores conectados. Não deve dobrar o sistema de injetores conectados (pois pode causar vazamento, pois os injetores podem ser parcialmente desrosqueados).
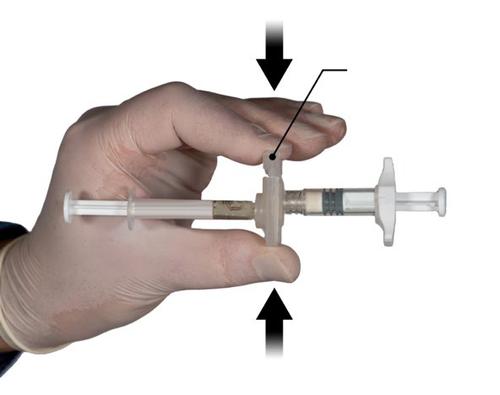
Passo 3
Segurando os injetores na posição horizontal, transferir o conteúdo líquido do Injektor A para o pó de leuprolida acetato no Injektor B. Misturar bem o produto durante 60 ciclos, movendo suavemente o conteúdo de ambos os injetores entre os dois injetores (um ciclo significa uma pressão no êmbolo do Injektor A e uma pressão no êmbolo do Injector B) alinhados na posição horizontal, até obter uma solução homogênea e viscosa (Fig. 3). Não deve dobrar o sistema de injetores conectados (pois pode causar vazamento, pois os injetores podem ser parcialmente desrosqueados).
Repetir 60x
Após a mistura, a solução viscosa tem cor incolor a branca ou amarela clara (tonalidades de branco a amarelo claro).
Importante: Após a mistura, deve prosseguir imediatamente para o próximo passo, pois a viscosidade do produto aumenta com o tempo. Não deve congelar o produto misturado.
Aviso: O produto deve ser misturado de acordo com as instruções; agitação NÃOassegura a mistura adequada do produto.
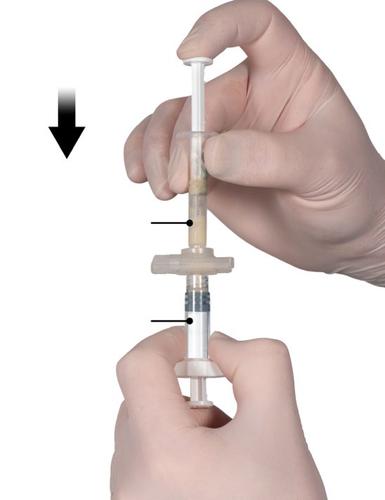
Passo 4
Após a mistura, segurar os injetores na posição vertical, com o Injektor B em baixo.
Os injetores devem permanecer corretamente conectados. Transferir todo o produto misturado para o Injektor B (injektor curto e largo) pressionando o êmbolo do Injektor A e puxando ligeiramente o êmbolo do injetor B (Fig. 4).
Fig. 4
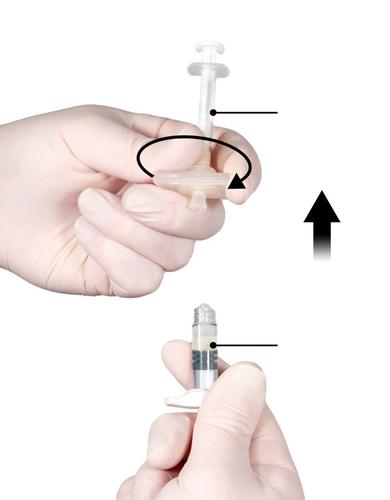
Passo 5
Certificar-se de que o êmbolo do Injektor A está completamente pressionado, segurando o conectador, girar o Injektor A para fora do Injektor B. O Injektor A permanecerá conectado ao conectador (Fig. 5). Certificar-se de que o produto não vaza, pois, caso contrário, a agulha, após a aplicação, não protegerá adequadamente a seringa.
Aviso: Na mistura podem permanecer um grande ou vários pequenos bolhas de ar - é um fenômeno normal.
Não retire as bolhas de ar do Injektor B nesta fase, pois pode causar perda de produto!
Fig. 5
Passo 6
- Segurar o Injektor B na posição vertical e segurar o êmbolo branco para evitar a perda de produto.
- Colocar a agulha com proteção no Injektor B, segurando a seringa, e girar suavemente a agulha cerca de três quartos de uma volta no sentido dos ponteiros do relógio, até que a agulha seja fixada (Fig. 6). Não apertar demasiado, pois pode causar a ruptura do adaptador da agulha e, consequentemente, o vazamento do produto durante a injeção. Se a agulha for apertada com força excessiva, a proteção também pode ser danificada.
Se o adaptador da agulha estiver rachado ou parecer danificado, ou se for observado vazamento, não deve ser administrado o produto. A agulha danificada não deve ser substituída por outra e o produto não deve ser injetado. Todos os componentes do produto não utilizado devem ser eliminados de forma segura.
Se o adaptador da agulha for danificado, deve ser administrado um novo produto.
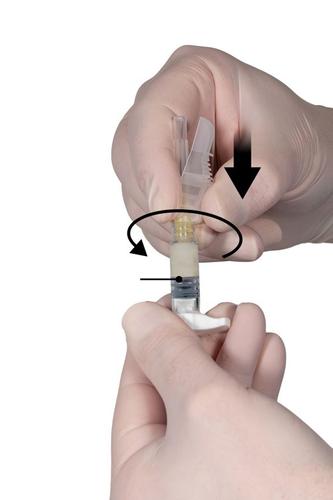
Passo 7
Retirar a proteção da agulha e a cobertura que protege a ponta da agulha imediatamente antes da administração do medicamento (Fig. 7).
Importante: Antes da administração do medicamento, não deve manipular o mecanismo de proteção da agulha. Se o adaptador da agulha parecer danificado ou for observado vazamento, NÃOdeve ser usado o produto. A agulha danificada NÃOdeve ser substituída por outra e o produto NÃOdeve ser injetado. Se o adaptador da agulha for danificado, deve ser usado um novo conjunto do produto Eligard.Fig. 7
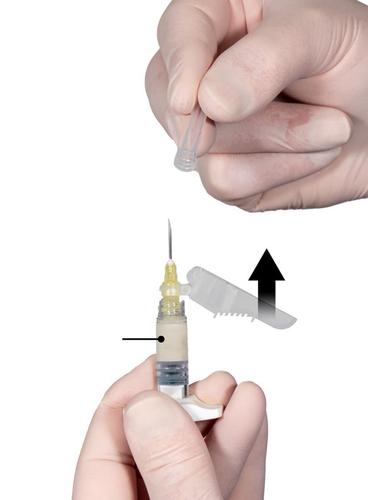
Passo 8
Antes da administração do medicamento, deve retirar todas as grandesbolhas de ar do Injektor B. Administrar o medicamento por injeção subcutânea, de forma que a proteção da agulha permaneça afastada da agulha. Procedimento de administração:
Fig. 8
- Escolher o local da injeção, que não tenha sido recentemente utilizado, na barriga, na parte superior das nádegas ou em outra localização com quantidade suficiente de tecido subcutâneo e sem manchas, nódulos, lesões ou pelos.
- Limpar a área do local da injeção com um cotonete embebido em álcool (não fornecido).
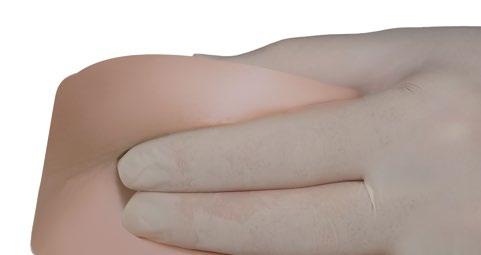
- Segurar a área da pele ao redor do local da injeção com o polegar e o indicador.
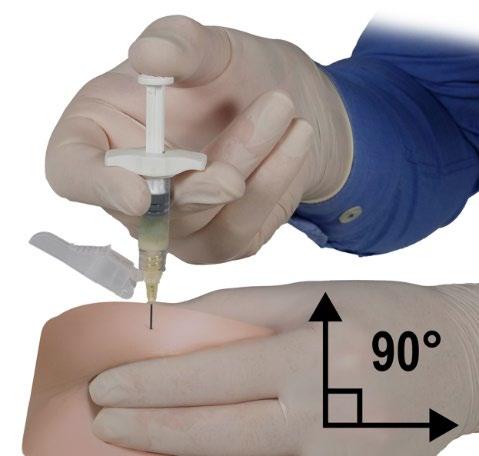
- Com a mão dominante, introduzir rapidamente a agulha a um ângulo de 90° em relação à superfície da pele. A profundidade da penetração dependerá da quantidade e da densidade do tecido subcutâneo e do comprimento da agulha. Após a introdução da agulha, soltar a pele.
- Administrar o produto lentamente e uniformemente, pressionando o êmbolo, até que a seringa esteja vazia. Antes de remover a agulha, certificar-se de que foi injetada a quantidade total do produto do Injektor B.
- Mantendo a pressão no êmbolo, remover rapidamente a agulha ao mesmo ângulo de 90° utilizado para a introdução.
Passo 9
Após a administração do medicamento, fechar a proteção da agulha, utilizando um dos métodos abaixo.
1. Fechamento sobre uma superfície plana
Pressionar a proteção da agulha, com a alavanca virada para baixo, sobre uma superfície plana (Fig. 9a), para cobrir a agulha e fechar a proteção.
A proteção está fechada se ouvir e sentir um clique. Na posição fechada, a ponta da agulha estará completamente coberta.
2. Fechamento com o polegar
Colocar o polegar sobre a proteção da agulha (Fig. 9b), cobrir a ponta da agulha e fechar a proteção.
A proteção está fechada se ouvir e sentir um clique. Na posição fechada, a ponta da agulha estará completamente coberta.
Fig. 9a
Fechamento sobre uma superfície plana
Fig. 9b
Fechamento com o polegar
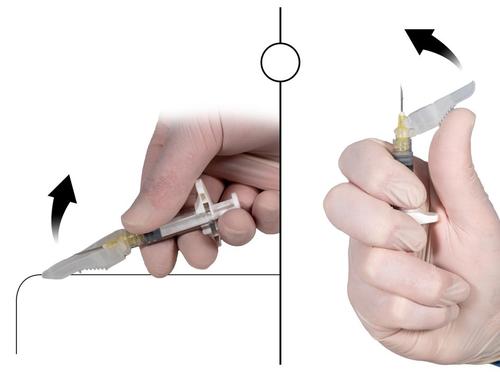
Após fechar a proteção da agulha, eliminar imediatamente a agulha e a seringa no recipiente para objetos pontiagudos.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorRecordati Industria Chimica e Farmaceutica S.p.A
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Eligard 22,5 mgForma farmacêutica: Pó, 45 mgSubstância ativa: leuprorelinRequer receita médicaForma farmacêutica: Pó, 7,5 mgSubstância ativa: leuprorelinRequer receita médicaForma farmacêutica: Implante, 3,6 mgSubstância ativa: leuprorelinRequer receita médica
Alternativas a Eligard 22,5 mg noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Eligard 22,5 mg em Espanha
Alternativa a Eligard 22,5 mg em Ukraine
Médicos online para Eligard 22,5 mg
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Eligard 22,5 mg – sujeita a avaliação médica e regras locais.











