

FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG

Consulta con un médico sobre la receta médica de FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG

Cómo usar FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG
Introducción
Prospecto:información para el paciente
Fulvestrant STADAFARMA 250 mg solución inyectableen jeringa precargada EFG
Lea todo el prospecto detenidamente antes de recibir este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver Sección 4.
Contenido del prospecto
- Qué es Fulvestrant Stadafarma y para qué se utiliza
- Qué necesita saber antes de recibir Fulvestrant Stadafarma
- Cómo se administra Fulvestrant Stadafarma
- Posibles efectos adversos
5 Conservación de Fulvestrant Stadafarma
- Contenido del envase e información adicional
1. Qué es Fulvestrant Stadafarma y para qué se utiliza
Fulvestrant Stadafarma contiene el principio activo fulvestrant, que pertenece al grupo de bloqueantes de estrógeno. Los estrógenos, un tipo de hormonas sexuales femeninas, pueden estar en algunos casos implicados en el desarrollo del cáncer de mama.
Fulvestrant se utiliza:
- solo, para tratar mujeres posmenopáusicas con un tipo de cáncer de mama llamado cáncer de mama con receptor de estrógeno positivo, que está localmente avanzado o que se ha extendido a otras partes del cuerpo (metastásico) o,
- en combinación con palbociclib para tratar a mujeres con un tipo de cáncer de mama llamado cáncer de mama con receptor hormonal positivo, cáncer de mama con receptor 2 del factor de crecimiento epidérmico humano negativo, que está localmente avanzado o que se ha extendido a otras partes del cuerpo (metastásico). Las mujeres que no hayan llegado a la menopausia también serán tratadas con un medicamento llamado agonista de la hormona liberadora de hormona luteinizante (LHRH).
Fulvestrant puede ser administrado en combinación con palbociclib. Es importante que usted lea también el prospecto de palbociclib. Si tiene alguna pregunta sobre palbociclib, consulte a su médico.
2. Qué necesita saber antes de recibir Fulvestrant Stadafarma
No debe recibirFulvestrant Stadafarma:
- si es alérgico a fulvestrant o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si está embarazada o en periodo de lactancia
- si presenta problemas hepáticos graves
Advertencias y precauciones
- Consulte a su médico, farmacéutico o enfermero antes de recibir fulvestrant si tiene alguno de los problemas siguientes:
- problemas de riñón o hígado
- recuento bajo de plaquetas (que ayudan a la coagulación de la sangre) o alteraciones hemorrágicas
- problemas previos de coágulos sanguíneos
- osteoporosis (pérdida de densidad ósea)
- alcoholismo
Niños y adolescentes
Fulvestrant no está indicado en niños y adolescentes menores de 18 años.
Otros medicamentos yFulvestrant Stadafarma
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
En particular, debe decir a su médico si está utilizando anticoagulantes (medicamentos para prevenir los coágulos sanguíneos).
Embarazo y lactancia
No debe utilizar fulvestrant si está usted embarazada. Si puede quedarse embarazada, debe utilizar un método anticonceptivo eficaz mientras esté en tratamiento con fulvestrant y durante dos años después de su última dosis.
No debe dar el pecho mientras esté en tratamiento con fulvestrant.
Conducción y uso de máquinas
No se espera que fulvestrant afecte a su capacidad para conducir o utilizar máquinas. Sin embargo, si se siente cansada después del tratamiento no conduzca ni utilice máquinas.
Uso en deportistas
Este medicamento contiene fulvestrant que puede producir un resultado positivo en las pruebas de control de dopaje.
Este medicamento contiene 1000mg de alcohol (etanol)en cada dosis de 2 x 5 ml de solución inyectable. La cantidad presente en 2 x 5 ml de este medicamento es equivalente a menos de 20 ml de cerveza o 8 ml de vino.
La pequeña cantidad de alcohol presente en este medicamento no tiene ningún efecto apreciable.
Este medicamento es perjudicial para personas que padecen alcoholismo.
El contenido en alcohol debe tenerse en cuenta en el caso de grupos de alto riesgo, como pacientes con enfermedades del hígado, o epilepsia.
Este medicamentocontiene 500mg de alcohol bencílicoen cada inyección de 5 ml, lo que equivale a 100 mg/ml. El alcohol bencílico puede provocar reacciones alérgicas. Consulte a su médico o farmacéutico si tiene algún problema de hígado o riñón. Debe hacerlo porque, si recibe cantidades abundantes de alcohol bencílico, estas podrían acumularse en su cuerpo y provocar efectos adversos (lo que se conoce como «acidosis metabólica»).
Este medicamento contiene 750mg de benzoato de benciloen cada inyección de 5 ml, lo que equivale a 150 mg/ml.
3. Cómo usar Fulvestrant Stadafarma
La dosis recomendada es 500 mg de fulvestrant (dos inyecciones de 250 mg/5 ml) administrados una vez al mes, con una dosis adicional de 500 mg a las 2 semanas de la dosis inicial.
Su médico o enfermero le administrará fulvestrant mediante una inyección intramuscular lenta en cada uno de sus glúteos.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
En caso de sobredosis o ingestión accidental, consulte inmediatamente a su médico o farmacéutico o llame al Servicio de Información Toxicológica, teléfono: 91 562 04 20, indicando el medicamento y la cantidad ingerida.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las
personas los sufran.
Informe inmediatamente a su médico si experimenta cualquiera de los efectos adversos siguientes, ya que podría necesitar tratamiento médico de inmediato:
- Reacciones alérgicas (hipersensibilidad), incluyendo hinchazón de la cara, labios, lengua y/o garganta, que pueden ser síntomas de reacciones anafilácticas
- Tromboembolismo (aumento del riesgo de coágulos sanguíneos)*
- Inflamación del hígado (hepatitis)
- Fallo hepático
Informe inmediatamente a su médico, farmacéutico o enfermero si nota alguno de los siguientes efectos adversos:
- Muy frecuentes(pueden afectar a más de 1 de cada 10 personas)
- Reacciones en el lugar de la inyección, como dolor y/o inflamación
- Niveles anormales de enzimas hepáticas (en análisis de sangre)*
- Náuseas (sensación de malestar)
- Debilidad, cansancio*
- Dolor articular y musculoesquelético
- Sofocos
- Erupción cutánea
Todos los efectos adversos restantes:
- Frecuentes(pueden afectar hasta 1 de cada 10 personas)
- Dolor de cabeza
- Vómitos, diarrea o pérdida del apetito*
- Infecciones del tracto urinario
- Dolor de espalda*
- Aumento de bilirrubina (un pigmento de la bilis producido por el hígado)
- Niveles disminuidos de plaquetas (trombocitopenia)
- Hemorragia vaginal
- Dolor lumbar que se refleja en un lado de la pierna (ciática)
- Debilidad repentina, entumecimiento, hormigueo o pérdida de movimiento en su pierna, especialmente en un solo lado del cuerpo, problemas repentinos para caminar o de equilibrio (neuropatía periférica)
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas)
- Flujo vaginal espeso, blanquecino y candidiasis (infección)
- Hematoma y hemorragia en el lugar de la inyección
- Aumento de gamma-GT, una enzima hepática que se identifica en un análisis de sangre
- Entumecimiento, hormigueo y dolor
- Reacciones anafilácticas
- Incluye efectos adversos para los cuales no se puede evaluar el papel exacto de fulvestrant debido a la enfermedad subyacente.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Fulvestrant Stadafarma
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase o en las etiquetas de las jeringas después de la abreviatura CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar en nevera (entre 2 ºC y 8 ºC).
Las desviaciones de temperatura de entre 2 ºC y 8 °C deben ser limitadas. Esto incluye evitar la conservación a temperaturas superiores a 25 °C, y que no exceda un periodo de 28 días en el cual la temperatura media de conservación del medicamento esté por debajo de 25 °C (pero por encima de entre 2 ºC y 8 °C). Tras producirse alguna desviación de temperatura, se debe devolver inmediatamente el medicamento a las condiciones de conservación recomendadas (conservación y transporte refrigerado entre 2 ºC y 8 °C). Las desviaciones de temperatura tienen un efecto acumulativo en la calidad del medicamento y no se debe superar el periodo de 28 días durante el período de validez de 36 meses de fulvestrant inyectable. La exposición a temperaturas inferiores a 2 °C no dañará el medicamento siempre y cuando este no se conserve por debajo de -20 °C.
Conservar la jeringa precargada en el embalaje original para protegerla de la luz.
Su profesional sanitario será el responsable de la conservación, uso y eliminación correctos de Fulvestrant Stadafarma 250 mg solución inyectable en jeringa precargada EFG.
Este medicamento puede presentar un riesgo para el medio acuático. Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición deFulvestrantStadafarma
- El principio activo es fulvestrant. Cada jeringa precargada (5 ml) contiene 250 mg de fulvestrant. Cada ml de solución contiene 50 mg de fulvestrant.
- Los demás componentes (excipientes) son etanol (96 %), alcohol bencílico, benzoato de bencilo y aceite de ricino refinado.
Aspecto deFulvestrantStadafarmay contenido del envase
Fulvestrant Stadafarma es una solución viscosa, transparente, de incolora a amarilla, en una jeringa precargada con tapón de bromobutilo, émbolo de poliestireno y tope de polipropileno que contiene 5 ml de solución inyectable. Para completar la dosis mensual recomendada de 500 mg se deben administrar dos jeringas.
Fulvestrant Stadafarma presenta 3 formatos, bien un envase que contiene 1 jeringa de vidrio precargada, un envase que contiene 2 jeringas de vidrio precargadas o bien un envase que contiene 6 jeringas de vidrio precargadas. Se proporcionan además agujas con sistema de seguridad (“BD SafetyGlide”) para su conexión al cuerpo de cada jeringa.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Laboratorio STADA, S.L.
Frederic Mompou, 5
08960 Sant Just Desvern (Barcelona)
España
Responsable de la fabricación
STADA Arzneimittel AG
Stadastrasse 2-18
61118 Bad Vilbel
Alemania
o
KeVaRo GROUP Ltd.
9 Tzaritza Elenora Str., office 23
Sofia 1618
Bulgaria
o
Laboratori Fundació Dau
Calle Lletra C de la Zona Franca 12-14,
Polígono Industrial de la Zona Franca de Barcelona,
08040, Barcelona,
España
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Alemania Fulvestrant AL 250 mg Injektionslösung in einer Fertigspritze
Italia Fulvestrant EG STADA
Hungría Fulmerak 250 mg oldatos injekció eloretöltött fecskendoben
Portugal Fulvestrant ELC
España Fulvestrant STADAFARMA 250 mg solución inyectable en jeringa precargada EFG
Fecha de la última revisión de este prospecto:diciembre 2023
La información detallada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)
Esta información está destinada únicamente a profesionales del sector sanitario:
Fulvestrant 500 mg (2 x 250 mg/5 ml solución inyectable) debe administrarse empleando dos jeringas precargadas, ver sección 3.
Instrucciones de administración
Advertencia – No esterilizar en autoclave la aguja con sistema de seguridad (Aguja Hipodérmica Protegida “BD SafetyGlide”) antes de su uso. Las manos deben permanecer por detrás de la aguja en todo momento durante su uso y eliminación.
Para cada una de las dos jeringas:
- Retire el cuerpo de vidrio de la jeringa de la bandeja y compruebe que no está dañado.
- Abra el envase exterior de la aguja con sistema de seguridad (“SafetyGlide”).
- Antes de su administración, se deben inspeccionar visualmente las soluciones parenterales en cuanto al contenido en partículas y a la decoloración.
- Sostenga la jeringa en posición vertical por la parte estriada (C). Con la otra mano, sujete el tapón de rosca (A) y gírelo con cuidado en sentido contrario a las agujas del reloj hasta que se desprenda y pueda retirarlo (ver la Figura 1).
Figura 1
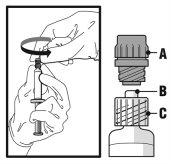
- Retire el tapón de rosca (A) tirando de él recto hacia arriba. Para mantener la esterilidad, no toque la punta de la jeringa (B) (ver la Figura 2).
Figura 2
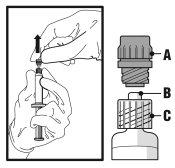
- Acople la aguja con sistema de seguridad al “Luer-Lok” y enrósquela hasta que se acople firmemente (ver Figura 3).
- Compruebe que la aguja está acoplada al conector Luer antes de dejar de mantenerlo en posición vertical.
Figura 3
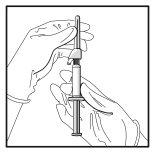
- Tire del capuchón protector de la aguja en línea recta para no dañar el extremo de la misma.
- Lleve la jeringa cargada al punto de administración.
- Retire el capuchón protector de la aguja.
- Elimine el exceso de gas de la jeringa.
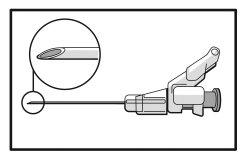
- Proceda a la administración por vía intramuscular lentamente (de 1 a 2 minutos por inyección) en el glúteo (zona glútea). Para mayor comodidad del usuario, la posición de la aguja con el bisel hacia arriba tiene la misma orientación que el brazo de la palanca (ver la Figura 4).
Figura 4
- Tras la inyección, dé inmediatamente un solo toque con el dedo en el brazo de la palanca para activar el mecanismo de protección (ver Figura 5).
NOTA: Active el mecanismo de protección alejado de su cuerpo y de los demás. Escuche el clic y confirme visualmente que la punta de la aguja está totalmente protegida.
Figura 5
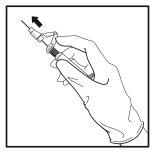
Eliminación
Las jeringas precargadas son solopara un único uso.
Este medicamento puede representar un riesgo para el medio acuático. Cualquier medicamento no utilizado o material de desecho se debe eliminar conforme a las normas locales.

¿Cuánto cuesta FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG en España en 2025?
En diciembre, 2025, el precio medio de FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG en las farmacias de España es de aproximadamente 408.86€. El coste puede variar según la región (por ejemplo, Barcelona o Madrid), la farmacia y si se necesita receta médica. Si buscas dónde comprar FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG en España, consulta precios actualizados en farmacias online o presenciales.
- País de registro
- Precio medio en farmacias408.86 EUR
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFGForma farmacéutica: INYECTABLE, 250 mg/5 mlPrincipio activo: FulvestrantFabricante: Bexal Farmaceutica S.A.Requiere recetaForma farmacéutica: INYECTABLE, 250 mgPrincipio activo: FulvestrantFabricante: Ever Valinject GmbhRequiere recetaForma farmacéutica: INYECTABLE, 250 mgPrincipio activo: FulvestrantFabricante: Astrazeneca AbRequiere receta
Alternativas a FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG en Polonia
Alternativa a FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG en Ucrania
Médicos online para FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de FULVESTRANT STADAFARMA 250 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA EFG – sujeta a valoración médica y normativa local.












