FASLODEX 250 mg/5 ml SOLUCION INYECTABLE

Cómo usar FASLODEX 250 mg/5 ml SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Faslodex250mg solución inyectable
fulvestrant
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver Sección 4.
Contenido del prospecto
- Qué es Faslodex y para qué se utiliza
- Qué necesita saber antes de empezar a usar Faslodex
- Cómo usar Faslodex
- Posibles efectos adversos
- Conservación de Faslodex
- Contenido del envase e información adicional
1. Qué es Faslodex y para qué se utiliza
Faslodex contiene el principio activo fulvestrant, que pertenece al grupo de bloqueantes de estrógeno. Los estrógenos, un tipo de hormonas sexuales femeninas, pueden estar en algunos casos implicados en el desarrollo del cáncer de mama.
Faslodex se utiliza:
- solo, para tratar mujeres posmenopáusicas con un tipo de cáncer de mama llamado cáncer de mama con receptor de estrógeno positivo, que es localmente avanzado o que se ha extendido a otras partes del cuerpo (metastásico) o,
- en combinación con palbociclib para tratar a mujeres con un tipo de cáncer de mama llamado cáncer de mama con receptor hormonal positivo, cáncer de mama con receptor 2 del factor de crecimiento epidérmico humano negativo, que está localmente avanzado o que se ha extendido a otras partes del cuerpo (metastásico). Las mujeres que no hayan llegado a la menopausia también serán tratadas con un medicamento llamado agonista de la hormona liberadora de hormona luteinizante (LHRH).
Faslodex puede ser administrado en combinación con palbociclib. Es importante que usted lea también el prospecto de palbociclib. Si tiene alguna pregunta sobre palbociclib, consulte a su médico
2. Qué necesita saber antes de empezar a usar Faslodex
No use Faslodex:
- si es alérgica a fulvestrant o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6 )
- si está embarazada o en periodo de lactancia
- si presenta problemas hepáticos graves
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Faslodex si algo de esto le aplica:
- problemas de riñón o hígado
- recuento bajo de plaquetas (que ayudan a la coagulación de la sangre) o alteraciones hemorrágicas
- problemas previos de coágulos sanguíneos
- osteoporosis (pérdida de densidad ósea)
- alcoholismo
Niños y adolescentes
Faslodex no está indicado en niños y adolescentes menores de 18 años.
Uso de Faslodex con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
En particular, debe decir a su médico si está utilizando anticoagulantes (medicamentos para prevenir los coágulos sanguíneos).
Embarazo y lactancia
No debe utilizar Faslodex si está usted embarazada. Si puede quedarse embarazada, debe utilizar un método anticonceptivo eficaz mientras esté en tratamiento con Faslodex y durante dos años después de su última dosis.
No debe dar el pecho mientras esté en tratamiento con Faslodex.
Conducción y uso de máquinas
No se espera que Faslodex afecte a su capacidad para conducir o utilizar máquinas. Sin embargo, si se siente cansada después del tratamiento no conduzca ni utilice máquinas.
Faslodex contiene10%p/v de etanol (alcohol),es decir, hasta 500 mg por inyección, lo que equivale a 12 ml de cerveza o 5 ml de vino.
Este medicamento es perjudicial para personas que padecen alcoholismo.
El contenido en alcohol debe tenerse en cuenta en el caso de grupos de alto riesgo, como pacientes con enfermedades del hígado, o epilepsia.
Faslodex contiene 500 mg de alcohol bencílico en cada inyección, equivalente a 100 mg/ml.
El alcohol bencílico puede provocar reacciones alérgicas.
Faslodex contiene 750 mg de benzoato de bencilo en cada inyección, equivalente a 150 mg/ml
3. Cómo usar Faslodex
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es 500 mg de fulvestrant (dos inyecciones de 250 mg/5 ml) administrada una vez al mes con una dosis adicional de 500 mg administrada 2 semanas después de la dosis inicial.
Su médico o enfermero le administrará Faslodex mediante una inyección intramuscular lenta en cada uno de sus glúteos.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Faslodex puede producir efectos adversos, aunque no todas las personas los sufran.
Puede necesitar tratamiento médico urgente si experimenta alguno de los siguientes efectos adversos:
- Reacciones alérgicas (hipersensibilidad), incluyendo hinchazón de la cara, labios, lengua y/o garganta, que pueden ser síntomas de reacciones anafilácticas
- Tromboembolismo (aumento del riesgo de coágulos sanguíneos)*
- Inflamación del hígado (hepatitis)
- Fallo hepático
Informe inmediatamente a su médico, farmacéutico o enfermero si nota alguno de los siguientes efectos adversos:
Efectos adversos muy frecuentes(puede afectar a más de 1 de cada 10 personas)
- Reacciones en el lugar de la inyección, como dolor y/o inflamación
- Niveles anormales de enzimas hepáticos (en análisis de sangre)*
- Náuseas (sensación de malestar)
- Debilidad, cansancio*
- Dolor articular y musculoesquelético
- Sofocos
- Erupción cutánea
- Reacciones alérgicas (hipersensibilidad), incluyendo hinchazón de la cara, labios, lengua y/o garganta
Todos los efectos adversos restantes:
Efectos adversos frecuentes(puede afectar hasta a 1 de cada 10 personas)
- Dolor de cabeza
- Vómitos, diarrea o pérdida del apetito*
- Infecciones del tracto urinario
- Dolor de espalda*
- Aumento de bilirrubina (un pigmento de la bilis producido por el hígado)
- Tromboembolismo (aumento del riesgo de coágulos sanguíneos)*
- Niveles disminuidos de plaquetas (trombocitopenia)
- Hemorragia vaginal
- Dolor lumbar que se refleja en un lado de la pierna (ciática)
- Debilidad repentina, entumecimiento, hormigueo o pérdida de movimiento en su pierna, especialmente en un solo lado del cuerpo, problemas repentinos para caminar o de equilibrio (neuropatía periférica)
Efectos adversos poco frecuentes(puede afectar hasta a 1 de cada 100 personas)
- Flujo vaginal espeso, blanquecino y candidiasis (infección)
- Hematoma y hemorragia en el lugar de la inyección
- Aumento de gamma-GT, un enzima hepático que se identifica en un análisis de sangre
- Inflamación del hígado (hepatitis)
- Fallo hepático
- Entumecimiento, hormigueo y dolor
- Reacciones anafilácticas
- Incluye efectos adversos para los cuales no se puede evaluar el papel exacto de Faslodex debido a la enfermedad subyacente.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V*. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Faslodex
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase o en las etiquetas de las jeringas después de la abreviatura CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar en nevera (entre 2ºC y 8ºC).
Las desviaciones de temperatura fuera del rango de entre 2ºC y 8ºC deben ser controladas. Esto incluye evitar la conservación a temperaturas superiores a 30ºC, y que no exceda un periodo de 28 días, durante el cual la temperatura media de conservación del medicamento sea inferior a 25ºC (pero por encima de entre 2ºC y 8ºC). Tras las desviaciones de temperatura, el medicamento debe ser retornado de forma inmediata a las condiciones de conservación recomendadas (conservar y transportar en nevera entre 2ºC y 8ºC). Las desviaciones de temperatura tienen un efecto acumulativo en la calidad del medicamento, no debiéndose superar el periodo de 28 días por encima de la duración de la caducidad de 4 años de Faslodex. La exposición a temperaturas inferiores a 2ºC no dañará el medicamento, siempre y cuando éste no se conserve por debajo de los -20ºC.
Conservar la jeringa precargada en el embalaje original para protegerla de la luz.
Su profesional sanitario será el responsable de la conservación, uso y eliminación correctos de Faslodex.
Este medicamento puede presentar un riesgo para el medio acuático. Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Faslodex
- El principio activo es fulvestrant. Cada jeringa precargada (5 ml) contiene 250 mg de fulvestrant.
- Los demás componentes (excipientes) son etanol (96 por ciento), alcohol bencílico, benzoato de bencilo y aceite de ricino refinado.
Aspecto del producto y contenido del envase
Faslodex es una solución viscosa, transparente, de incolora a amarilla en una jeringa precargada equipada con un cierre a prueba de manipulación, que contiene 5 ml de solución inyectable. Deben administrarse dos jeringas para recibir la dosis mensual recomendada de 500 mg.
Faslodex presenta 2 formatos, bien un envase que contiene 1 jeringa de vidrio precargada o bien un envase que contiene 2 jeringas de vidrio precargadas. Se proporcionan además agujas con sistema de seguridad (“BD SafetyGlide”) para su conexión al cuerpo de cada jeringa.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
AstraZeneca AB
SE-151 85 Södertälje
Suecia
Responsable de la fabricación
AstraZeneca AB
Karlebyhusentrén
Astraallén
SE‑152 57 Södertälje
Suecia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien AstraZeneca S.A./N.V. Tel: +32 2 370 48 11
| Lietuva UAB AstraZeneca Lietuva Tel: +370 5 2660550 Luxembourg/Luxemburg AstraZeneca S.A./N.V. Tél/Tel: +32 2 370 48 11 |
Ceská republika AstraZeneca Czech Republic s.r.o. Tel: +420 222 807 111 | Magyarország AstraZeneca Kft Tel: +36 1 883 6500 |
Danmark AstraZeneca A/S Tlf: +45 43 66 64 62 | Malta Associated Drug Co. Ltd Tel: +356 2277 8000 |
Deutschland AstraZeneca GmbH Tel: +49 40 809034100 | Nederland AstraZeneca BV Tel: +31 85 808 9900 |
Eesti AstraZeneca Tel: +372 6549 600 | Norge AstraZeneca AS Tlf: +47 21 00 64 00 |
Ελλ?δα AstraZeneca a.e. Τηλ: + 30 2 106871500 | Österreich AstraZeneca Österreich GmbH Tel: +43 1 711 31 0 |
España AstraZeneca Farmacéutica Spain, S.A. Tel: +34 91 301 91 00 | Polska AstraZeneca Pharma Poland Sp. z o.o. Tel.: +48 22 245 73 00 |
France AstraZeneca Tél: +33 1 41 29 40 00 | Portugal AstraZeneca Produtos Farmacêuticos, Lda. Tel: +351 21 434 61 00 |
Hrvatska AstraZeneca d.o.o. Tel: +385 1 4628 000 Ireland AstraZeneca Pharmaceuticals (Ireland) DAC Tel: +353 1609 7100 | România AstraZeneca Pharma SRL Tel: +40 21 317 60 41 Slovenija AstraZeneca UK Limited Tel: +386 1 51 35 600 |
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika AstraZeneca AB o.z. Tel: +421 2 5737 7777 |
Italia AstraZeneca S.p.A. Tel: +39 02 00704500 | Suomi/Finland AstraZeneca Oy Puh/Tel: +358 10 23 010 |
Κ?προς Αλ?κτωρ Φαρµακευτικ? Λτδ Τηλ: +357 22490305 | Sverige AstraZeneca AB Tel: +46 8 553 26 000 |
Latvija SIA AstraZeneca Latvija Tel: +371 67377100 | |
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu.
--------------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario:
Faslodex 500 mg (2 x 250 mg/5 ml solución inyectable) debe administrarse empleando dos jeringas precargadas, ver sección 3.
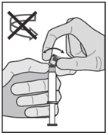
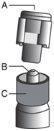
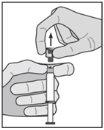
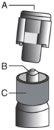
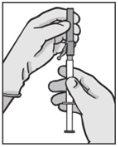
Instrucciones de administración
Advertencia – No esterilizar en autoclave la aguja con sistema de seguridad (Aguja Hipodérmica Protegida “BD SafetyGlide”) antes de su uso. Las manos deben permanecer por detrás de la aguja en todo momento durante su uso y eliminación.
Para cada una de las dos jeringas:
| Figura 1
Figura 2
|
| Figura 3
|
| Figura 4
|
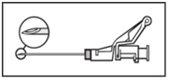
NOTA: Active alejado de su cuerpo y de los demás. Escuche el clic y confirme visualmente que la punta de la aguja está totalmente protegida. | Figura 5
|
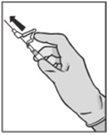
Eliminación
Las jeringas precargadas son sólopara un único uso.
Este medicamento puede presentar un riesgo para el medio acuático. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
- País de registro
- Precio medio en farmacia225.7 EUR
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a FASLODEX 250 mg/5 ml SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 250 mg/5 mlPrincipio activo: FulvestrantFabricante: Bexal Farmaceutica S.A.Requiere recetaForma farmacéutica: INYECTABLE, 250 mgPrincipio activo: FulvestrantFabricante: Ever Valinject GmbhRequiere recetaForma farmacéutica: INYECTABLE, 250 mgPrincipio activo: FulvestrantFabricante: Reddy Pharma Iberia S.A.Requiere receta
Médicos online para FASLODEX 250 mg/5 ml SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de FASLODEX 250 mg/5 ml SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes