
Fulvestrant Piarmascience
Consulta con un médico sobre la receta médica de Fulvestrant Piarmascience

Cómo usar Fulvestrant Piarmascience
Hoja de instrucciones del paquete: información para el usuario
Fulvestrant Pharmascience, 250 mg/5 ml, solución para inyección en jeringa precargada
Fulvestrantum
Es importante leer detenidamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene
informaciones importantes para la paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si la paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Fulvestrant Pharmascience y para qué se utiliza
- 2. Información importante antes de usar Fulvestrant Pharmascience
- 3. Cómo usar Fulvestrant Pharmascience
- 4. Posibles efectos adversos
- 5. Cómo conservar Fulvestrant Pharmascience
- 6. Contenido del paquete y otra información
1. Qué es Fulvestrant Pharmascience y para qué se utiliza
Fulvestrant Pharmascience contiene la sustancia activa fulvestrant, que pertenece a los medicamentos
que bloquean la acción de los receptores de estrógeno. Los estrógenos, hormonas femeninas, pueden
influir en el desarrollo del cáncer de mama.
Fulvestrant Pharmascience se utiliza:
- como medicamento único, en el tratamiento de mujeres posmenopáusicas con un tipo de cáncer de mama llamado cáncer de mama con receptores de estrógeno positivos, que es localmente avanzado o se ha extendido a otras partes del cuerpo (metástasis) o
- en combinación con palbociclib en el tratamiento de mujeres con un tipo de cáncer de mama llamado cáncer de mama con receptores hormonales, sin sobreexpresión del receptor de crecimiento epidérmico humano 2, que es localmente avanzado o se ha extendido a otras partes del cuerpo (metástasis). Las mujeres que no han alcanzado la menopausia también recibirán un medicamento llamado agonista del hormona liberadora de hormona luteinizante (LHRH).
Cuando Fulvestrant Pharmascience se administra junto con palbociclib, es importante leer también
la hoja de instrucciones del paquete de palbociclib. En caso de dudas sobre palbociclib, debe consultar a su médico.
2. Información importante antes de usar Fulvestrant Pharmascience
Cuándo NO usar Fulvestrant Pharmascience
- si la paciente es alérgica a fulvestrant o a alguno de los demás componentes de este medicamento (enumerados en el punto 6)
si la paciente está embarazada o en período de lactancia
- si la paciente tiene trastornos hepáticos graves.
Precauciones y advertencias
Debe informar a su médico, farmacéutico o enfermera antes de usar Fulvestrant Pharmascience, si la paciente ha tenido problemas de salud como:
- enfermedades renales o hepáticas
- recuento bajo de plaquetas (que permiten la coagulación de la sangre), o tendencia a sangrar
- trastornos de coagulación sanguínea en el pasado;
- osteoporosis (pérdida de densidad mineral ósea)
- dependencia del alcohol.
Niños y adolescentes
Fulvestrant Pharmascience no se utiliza en niños y adolescentes menores de 18 años.
Fulvestrant Pharmascience y otros medicamentos
Debe informar a su médico, farmacéutico o enfermera sobre todos los medicamentos que la paciente esté tomando actualmente o recientemente, así como sobre los medicamentos que la paciente planea tomar.
En particular, debe informar a su médico si la paciente está tomando medicamentos anticoagulantes (medicamentos que evitan la formación de coágulos sanguíneos).
Embarazo, lactancia y fertilidad
Fulvestrant Pharmascience no debe usarse durante el embarazo. Si la paciente puede quedar embarazada,
se recomienda usar métodos anticonceptivos efectivos durante el tratamiento con Fulvestrant Pharmascience y durante 2 años después de la última dosis de este medicamento.
Durante el tratamiento con Fulvestrant Pharmascience, no se debe amamantar.
Conducción de vehículos y uso de maquinaria
No se espera que Fulvestrant Pharmascience afecte la capacidad de conducir vehículos o usar maquinaria. Sin embargo, si después de usar Fulvestrant Pharmascience se produce somnolencia, no se debe conducir vehículos o usar maquinaria.
Fulvestrant Pharmascience contiene etanol (alcohol)
Fulvestrant Pharmascience contiene 500 mg de etanol en cada inyección, lo que equivale a 100 mg/ml (10% m/v). Esta cantidad en cada inyección de este medicamento equivale a 13 ml de cerveza o 5 ml de vino.
Es poco probable que la cantidad de alcohol contenida en este medicamento tenga un efecto en adultos y
adolescentes.
El alcohol contenido en este medicamento puede afectar la acción de otros medicamentos. Si la paciente está tomando otros medicamentos, debe hablar con su médico o farmacéutico.
Si la paciente está embarazada o en período de lactancia, antes de usar este medicamento, debe informar a su médico o farmacéutico.
Si la paciente es dependiente del alcohol, antes de usar este medicamento, debe informar a su médico o farmacéutico.
Fulvestrant Pharmascience contiene alcohol bencílico
Fulvestrant Pharmascience contiene 500 mg de alcohol bencílico en cada jeringa precargada, lo que equivale a 100 mg/ml. El alcohol bencílico puede causar reacciones alérgicas.
Fulvestrant Pharmascience contiene benzoato de bencilo
Fulvestrant Pharmascience contiene 750 mg de benzoato de bencilo en cada jeringa precargada, lo que equivale a 150 mg/ml.
3. Cómo usar Fulvestrant Pharmascience
Fulvestrant Pharmascience será administrado por un médico o enfermera. El medicamento se inyectará lentamente
en el músculo, cada inyección se administrará en un glúteo diferente.
La dosis recomendada es de 500 mg de fulvestrant (dos inyecciones de 250 mg/5 ml), administradas una vez al mes y una dosis adicional de 500 mg administrada dos semanas después de la primera dosis.
En caso de dudas sobre cómo usar este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, Fulvestrant Pharmascience puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de experimentar alguno de los siguientes efectos adversos, debe buscar atención médica de inmediato:
- reacciones de hipersensibilidad (alergia), incluyendo hinchazón de la cara, los labios, la lengua y/o la garganta, que pueden ser síntomas de una reacción anafiláctica
- enfermedad tromboembólica (aumento del riesgo de formación de coágulos venosos)*
- hepatitis (inflamación del hígado)
- insuficiencia hepática.
Si experimenta alguno de los siguientes efectos adversos, debe informar a su médico, farmacéutico o enfermera:
Efectos adversos muy frecuentes(pueden ocurrir en más de 1 de cada 10 personas)
- síntomas en el lugar de inyección, como dolor y/o inflamación
- cambios en la actividad de las enzimas hepáticas (en la sangre)*
- náuseas (sensación de mareo)
- sensación de debilidad, fatiga*
- dolor en las articulaciones y dolores musculoesqueléticos
- escalofríos
- erupciones cutáneas
- reacciones de hipersensibilidad (alergia), incluyendo hinchazón de la cara, los labios, la lengua y/o la garganta.
Todos los demás efectos adversos:
Efectos adversos frecuentes(pueden ocurrir en hasta 1 de cada 10 personas)
- dolores de cabeza
- vómitos, diarrea o pérdida de apetito*
- infecciones del tracto urinario
- dolores de espalda*
- aumento de la bilirrubina (pigmento producido por el hígado).
- enfermedad tromboembólica (aumento del riesgo de formación de coágulos venosos)*
- recuento bajo de plaquetas (trombocitopenia)
- sangrado vaginal
- dolor en la parte inferior de la espalda que irradia hacia la pierna en un lado del cuerpo (ciática)
- debilidad repentina, entumecimiento, hormigueo o pérdida de movilidad en la pierna, especialmente en un lado del cuerpo, dificultad para caminar o mantener el equilibrio (neuropatía periférica).
Efectos adversos poco frecuentes(pueden ocurrir en hasta 1 de cada 100 personas)
- flujo vaginal espeso y blanco y candidiasis vaginal (infección)
- hematoma y sangrado en el lugar de inyección
- aumento de la actividad de la gamma-glutamiltransferasa, enzima hepática medida en la sangre
- hepatitis (inflamación del hígado)
- insuficiencia hepática
- entumecimiento, hormigueo y dolor
- reacciones anafilácticas.
* se refiere a efectos adversos para los cuales no se puede evaluar el impacto de Fulvestrant Pharmascience debido a la enfermedad subyacente.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos todos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos de la Agencia de Medicamentos y Productos Sanitarios, Calle de Alcalá, 38, 28071 Madrid, Teléfono: +34 91 822 63 00, Fax: +34 91 822 63 01, sitio web: https://www.aemps.gob.es/.
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Fulvestrant Pharmascience
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No use este medicamento después de la fecha de caducidad que se indica en el paquete o en la etiqueta de la jeringa precargada después de "EXP". La fecha de caducidad es el último día del mes indicado.
Conservar y transportar a una temperatura de 2°C a 8°C.
Debe limitar la conservación del medicamento a una temperatura diferente a 2°C a 8°C. Debe evitar la conservación a una temperatura superior a 30°C y no exceder el plazo de 28 días con una temperatura media de conservación por debajo de 25°C (pero por encima del rango de 2°C a 8°C). Si se supera el rango de temperatura, debe aplicar de inmediato las condiciones de conservación recomendadas (conservar y transportar a una temperatura de 2°C a 8°C). La superación de la temperatura de conservación adecuada puede tener un efecto acumulado en la calidad del medicamento y el plazo de 28 días no puede excederse en un plazo de 2 años de validez de Fulvestrant Pharmascience. La exposición a una temperatura por debajo de 2°C no daña el producto, siempre que no se conserve a una temperatura por debajo de -20°C.
La jeringa precargada debe conservarse en su embalaje original para protegerla de la luz.
El personal médico será responsable de la conservación, uso y eliminación adecuados del embalaje después de usar Fulvestrant Pharmascience.
Este medicamento puede ser perjudicial para el medio ambiente acuático. No debe tirarse por el desagüe ni a los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Fulvestrant Pharmascience?
La sustancia activa de Fulvestrant Pharmascience es fulvestrant. Cada jeringa precargada (5 ml) contiene 250 mg de fulvestrant.
Además, el medicamento contiene otros componentes: etanol (96%), alcohol bencílico, benzoato de bencilo y aceite de ricino purificado.
Cómo se presenta Fulvestrant Pharmascience y qué contiene el paquete?
Fulvestrant Pharmascience es una solución transparente, incolora a amarillenta, viscosa en jeringa precargada que contiene 5 ml de solución para inyección. Para administrar la dosis mensual recomendada de 500 mg, se deben inyectar el contenido de dos jeringas precargadas.
Fulvestrant Pharmascience se presenta en tres tipos de paquetes: un paquete que contiene 1 jeringa precargada de vidrio, un paquete que contiene 2 jeringas precargadas de vidrio, un paquete que contiene 6 jeringas precargadas de vidrio, que están hechas de vidrio incoloro tipo I con émbolos de poliestireno con tapones de elastómero y puntas de seguridad en una caja de cartón. Se suministran, respectivamente, una, dos o seis agujas con sistema de seguridad (BD SafetyGlide), destinadas a conectarse a cada jeringa precargada. No todos los tipos de paquetes deben estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización:
Pharmascience International Limited
Lampousas 1
1095 Nicosia
Chipre
Fabricante
Laboratorios Farmalan S.A.
Calle La Vallina, s/n, Edificio 2
Polígono Industrial Navatejera
- 24193- Villaquilambre, León, España
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
| País | Nombre del medicamento |
| NL | Fulvestrant Pharmascience 250 mg oplossing voor injectie in een voorgevulde spuit |
| BG | Фулвестрант Фармасайънс 250 mg инжекционен разтвор в предварително напълнена спринцовка Fulvestrant Pharmascience 250 mg solution for injection in pre-filled syringe |
| HU | Fulvestrant Pharmascience 250 mg oldatos injekció el retöltött fecskendő ben Ő Ő |
| PL | Fulvestrant Pharmascience |
Fecha de la última revisión de la hoja de instrucciones:
Información destinada exclusivamente al personal médico:
Fulvestrant Pharmascience,500 mg (2 x 250 mg/5 ml, solución para inyección) debe administrarse utilizando dos jeringas precargadas (ver punto 3).
Instrucciones de administración
Advertencia– No debe esterilizar la aguja con sistema de seguridad (BD SafetyGlide, Safety Hypodermic Needle) antes de su uso. Al manipular el medicamento y eliminar los residuos, debe evitar el contacto de las manos con la aguja.
Se aplica a ambas jeringas:
- Debe sacar la jeringa precargada de vidrio del contenedor y verificar que no esté dañada.
- Abrir el paquete exterior de la aguja con sistema de seguridad (BD SafetyGlide).
- Antes de administrar soluciones parenterales, debe evaluar visualmente la presencia de partículas sólidas y cambios de color.
- Sostener la jeringa en posición vertical en la parte estriada (C). Con la otra mano, sujetar el tapón (A) y girar suavemente el tapón de plástico rígido de la punta en sentido contrario a las agujas del reloj (ver Figura 1).
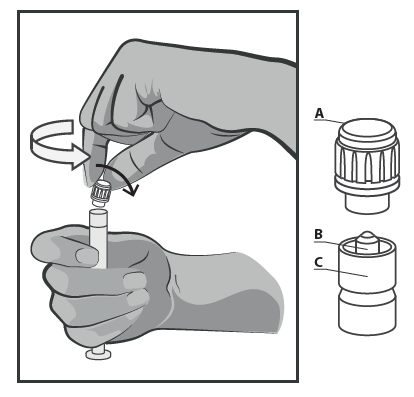
Figura 1
- Retirar el tapón de plástico rígido de la punta (A) en posición vertical hacia arriba. Para mantener la esterilidad, no tocar la punta de la jeringa (B) (ver Figura 2).
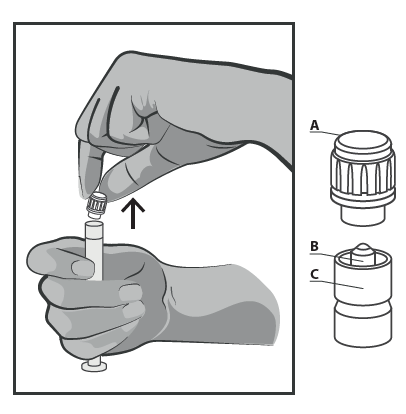
Figura 2
- Conectar la aguja con sistema de seguridad al conector Luer-Lock y girar para asegurar firmemente (ver Figura 3).
- Verificar que la aguja esté conectada al conector Luer antes de pasar a la posición vertical.
- Acerca la aguja llena al lugar de inyección.
- Retirar el tapón de la aguja.
- Eliminar el exceso de gas de la jeringa.
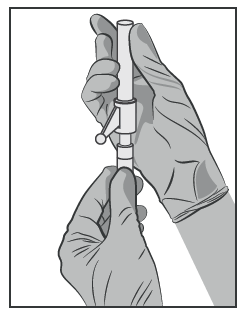
Figura 3
- El medicamento debe administrarse por vía intramuscular, lentamente (1-2 minutos por inyección), en el músculo glúteo (en un lado del glúteo). Para la comodidad de la persona que administra, el corte de la aguja se encuentra en la misma superficie de la aguja que la palanca del sistema de seguridad de la aguja (ver Figura 4)
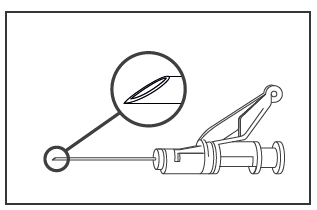
Figura 4
- Inmediatamente después de la inyección, debe activar con un movimiento de dedo hacia adelante el brazo de la palanca del sistema de seguridad de la aguja (ver Figura 5).
Advertencia: proceda de manera que garantice la seguridad para usted y los demás. Escuche el clic y verifique visualmente que la punta de la aguja esté completamente oculta.
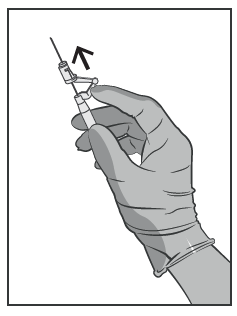
Figura 5
Eliminación de residuos
La jeringa precargada está diseñada para uso único.
Este medicamento puede ser perjudicial para el medio ambiente acuático. Todos los residuos no utilizados o desechos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorLaboratorios Farmalán, S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Fulvestrant PiarmascienceForma farmacéutica: Solución, 250 mgPrincipio activo: FulvestrantNo requiere recetaForma farmacéutica: Solución, 250 mgPrincipio activo: FulvestrantRequiere recetaForma farmacéutica: Solución, 250 mg/ 5 mlPrincipio activo: FulvestrantRequiere receta
Alternativas a Fulvestrant Piarmascience en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Fulvestrant Piarmascience en Испания
Alternativa a Fulvestrant Piarmascience en Украина
Médicos online para Fulvestrant Piarmascience
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Fulvestrant Piarmascience – sujeta a valoración médica y normativa local.












