MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL


Como usar MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Meriofert 75 UIpó e dissolvente para solução injetável
Meriofert 150 UI pó e dissolvente para solução injetável
menotropina
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, embora tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
- Neste prospecto, Meriofert 75 UI pó e dissolvente para solução injetável e Meriofert 150 UI de pó e dissolvente para solução injetável, são denominados Meriofert.
Conteúdo do prospecto
- O que é Meriofert e para que é utilizado
- O que precisa saber antes de começar a usar Meriofert
- Como usar Meriofert
- Posíveis efeitos adversos
- Conservação de Meriofert
- Conteúdo do envase e informação adicional
1. O que é Meriofert e para que é utilizado
- Meriofert é usado para estimular a ovulação em mulheres que não ovulam e que não responderam a outro tratamento (citrato de clomifeno).
- Meriofert é usado para provocar o desenvolvimento de vários folículos (e, portanto, de vários óvulos) em mulheres submetidas a um tratamento de fertilidade.
Meriofert é uma gonadotropina menopáusica humana muito purificada, que pertence a um grupo de medicamentos denominados gonadotropinas.
Cada frasco contém pó liofilizado com 75 UI de atividade de hormona foliculoestimulante (FSH) humana e 75 UI de atividade de hormona luteinizante humana (LH).
A gonadotropina menopáusica humana (HMG) é extraída da urina de mulheres pós-menopáusicas. É adicionada gonadotropina coriónica humana (hCG), hormona natural extraída da urina de mulheres grávidas, para contribuir para a atividade de LH total.
Cada frasco contém pó liofilizado com 150 UI de atividade de hormona foliculoestimulante (FSH) humana e 150 UI de atividade de hormona luteinizante humana (LH).
A gonadotropina menopáusica humana (HMG) é extraída da urina de mulheres pós-menopáusicas. É adicionada gonadotropina coriónica humana (hCG), hormona natural extraída da urina de mulheres grávidas, para contribuir para a atividade de LH total.
Este medicamento deve ser usado sob a supervisão de um médico.
2. O que precisa saber antes de começar a usar Meriofert
Antes de começar o tratamento, será avaliada a sua fertilidade e a da sua parceira.
Não use Meriofert
- Se apresentar um aumento do tamanho dos seus ovários, ou quistes cuja causa não seja um distúrbio hormonal (doença ovárica poliquística).
- Se tiver sangramentos de origem desconhecida.
- Se padece cancro dos ovários, útero ou mama.
- Se apresentar uma inflamação anormal (tumor) da hipófise ou do hipotálamo (cérebro).
- Se é alérgica à menotropina ou a qualquer um dos outros componentes deste medicamento.
Não deve utilizar este medicamento se sofre menopausa precoce, malformação dos órgãos genitais ou determinados tumores do útero que impediriam um gravidez normal.
Advertências e precauções
Embora não sejam descritas reações alérgicas a este medicamento, deverá informar o seu médico se padece alguma reação alérgica a medicamentos semelhantes.
Este tratamento aumenta o risco de padecer uma doença denominada síndrome de hiperestimulação ovárica (SHO)(ver Posíveis efeitos adversos). Se se produzir uma hiperestimulação ovárica, será suspenso o tratamento e deverão ser evitadas as gravidezes. Os primeiros sinais de hiperestimulação ovárica são dor na região inferior do abdômen, náuseas (malestar), vómitos e ganho de peso. Se se produzirem ditos sintomas, deverá examiná-lo um médico o mais breve possível. Em casos graves, mas raros, podem aumentar os ovários e acumular-se líquido no abdômen ou no peito.
O medicamento empregado para provocar o desprendimento definitivo dos óvulos maduros (que contém gonadotropina coriónica humana - hCG) pode aumentar a probabilidade de sofrer um SHO. Por tanto, não é recomendável utilizar hCG nos casos em que se está produzindo um SHO e não deverão manter relações sexuais durante um mínimo de 4 dias, embora se utilize um método anticonceptivo de barreira.
Cabe destacar que as mulheres com problemas de fertilidade têm uma taxa de abortos superior à da população normal.
A frequência de gravidezes e partos múltiplos nas pacientes submetidas a um tratamento para estimular a ovulação é maior do que nas mulheres que concebem de forma natural. No entanto, este risco pode ser reduzido ao mínimo se for usada a dose recomendada.
O risco de gravidez ectópica (gravidez fora do útero) é ligeiramente maior nas mulheres com lesões nas trompas de Falópio.
As gravidezes múltiplas e as características dos progenitores submetidos a tratamentos de fertilidade (por exemplo, a idade da mãe ou as características do sêmen) podem estar associadas a um aumento do risco de defeitos de nascimento.
O tratamento com este medicamento, assim como a própria gravidez, pode aumentar a probabilidade de sofrer uma trombose. A trombose é a formação de um coágulo de sangue num vaso sanguíneo, a maioria das vezes nas veias das pernas ou nos pulmões.
Comente este facto com o seu médico antes de começar o tratamento, em especial:
- Se já sabe que tem uma maior probabilidade de sofrer uma trombose.
- Se si ou algum familiar próximo sofreu alguma vez uma trombose.
- Se padece sobrepeso grave.
Crianças
O medicamento não está indicado para uso em crianças.
Outros medicamentos e Meriofert
Informe o seu médico ou farmacêutico se está a tomar, tomou recentemente ou pudesse ter que tomar qualquer outro medicamento.
Gravidez, lactação e fertilidade
Este medicamento não se deve utilizar se está grávida ou em período de lactação.
Condução e uso de máquinas
A influência deste medicamento sobre a capacidade para conduzir e utilizar máquinas é nula ou insignificante.
Meriofert contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por solução reconstituída; isto é, essencialmente “isento de sódio”.
3. Como usar Meriofert
Dose e duração do tratamento:
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
Mulheres que não ovulam e têm períodos irregulares ou ausência de menstruação:
Por norma geral, a primeira injeção de um frasco de 75 UI de menotropina é administrada durante a primeira semana do ciclo após a menstruação espontânea ou induzida.
Posteriormente, injeta-se todos os dias a dose deste medicamento prescrita pelo médico e continua-se com o tratamento até que sejam formados um ou mais folículos maduros no ovário. O médico ajustará a dose deste medicamento dependendo da resposta ovárica, que é determinada por meio de exames clínicos.
Assim que um folículo atingir a fase de desenvolvimento necessária, interrompe-se o tratamento com este medicamento e provoca-se a ovulação com outra hormona (gonadotropina coriônica, hCG).
A ovulação ocorre, por norma, num prazo de entre 32 e 48 horas.
Nesta fase do tratamento, existe a possibilidade de fertilização. Será recomendado que mantenha relações sexuais todos os dias a partir do dia anterior à administração de hCG. Se, apesar da ovulação, não se consegue um embarazo, pode-se repetir o tratamento.
Mulheres submetidas a uma estimulação ovárica para o desenvolvimento folicular múltiplo antes de uma fertilizaçãoin vitroou outras técnicas de reprodução assistida:
O objetivo deste método é obter um desenvolvimento folicular múltiplo simultâneo. O tratamento começará no segundo ou terceiro dia do ciclo com injeções de entre 150 e 300 UI deste medicamento (1 ou 2 frascos de Meriofert 150 UI). O médico pode optar por administrar doses mais elevadas se necessário. A dose deste medicamento que se injeta é maior do que a do método empregado para a fertilização natural. O médico se encarrega de ajustar a continuação do tratamento de forma individualizada.
Assim que se desenvolveu um número suficiente de folículos, interrompe-se o tratamento com este medicamento e provoca-se a ovulação mediante a injeção de outra hormona (gonadotropina coriônica, hCG).
Como administrar Meriofert:
Este medicamento é administrado em forma de injeção sob a pele (por via subcutânea) ou no músculo (por via intramuscular).
Os frascos só devem ser usados uma vez e a injeção deve ser administrada assim que estiver preparada.
Depois de aconselhá-lo e instruí-lo devidamente, é possível que o médico peça que se administre a injeção de Meriofert você mesmo.
Antes da primeira injeção, o seu médico deve:
- Permitir que pratique a autoadministração de uma injeção subcutânea,
- Indicar os lugares em que pode administrar a injeção,
- Ensinar a preparar a solução injetável,
- Explicar como preparar a dose correta para a injeção.
Antes de administrar a injeção de Meriofert, leia atentamente as seguintes instruções.
Como preparar e injetar 1 frasco de pó de Meriofert:
A solução deve ser preparada justo antes da injeção. Cada frasco é utilizado para um único uso. O medicamento deve ser reconstituído sob condições assépticas.
Este medicamento deve ser reconstituído apenas com o dissolvente fornecido no estojo.
Prepare uma superfície limpa e lave as mãos antes da reconstituição da solução. É importante que as mãos e os artigos que utilize estejam o mais limpos possível.
Coloque sobre a superfície os artigos seguintes:
- dois algodões umedecidos com álcool (não vêm na caixa),
- um frasco de pó de Meriofert,
- uma ampola de dissolvente,
- uma seringa (não vem na caixa),
- uma agulha para preparar a injeção (não vem na caixa),
- uma agulha fina para a injeção subcutânea (não vem na caixa).
Reconstituição da solução para a injeção, utilizando 1 frasco de pó
Prepare a solução para a injeção:
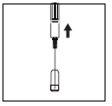
| 1. O pescoço da ampola está especificamente projetado para quebrar mais facilmente abaixo do ponto colorido. Bata suavemente na parte superior da ampola para desalojar qualquer líquido residual na ponta. Segure a ampola com o ponto colorido para fora e retire a parte superior da ampola como mostrado na imagem. O uso de um pano ou um quebra-ampola para segurar a ampola ajudará a proteger seus dedos. Coloque cuidadosamente a ampola aberta em posição vertical sobre a superfície limpa. |
Retire o capuchão protetor da agulha. Acople a agulha para a reconstituição (agulha grande) à seringa. Com a seringa em uma mão, pegue a ampola aberta do dissolvente, insira a agulha e retire todo o conteúdo da ampola na seringa. Acople o tapão protetor da agulha. Ponha cuidadosamente a seringa na superfície. | |
| 2. Retire o tapão de plástico colorido (verde claro na apresentação de 75 UI e verde escuro na de 150 UI) do frasco de pó empurrando suavemente para cima. Desinfete a parte superior do tapão de borracha esfregando com um algodão com álcool e deixe secar. |
| 3. Pegue a seringa, retire o capuchão protetor da agulha e injete lentamente o dissolvente pela parte central superior do tapão de borracha do frasco de pó. Pressione o êmbolo firmemente para baixo para verter toda a solução sobre o pó. NÃO AGITE, mas mova suavemente o frasco entre as mãos até que o pó esteja completamente dissolvido, tendo cuidado para não criar espuma. |
| 4. Uma vez que o pó já se dissolveu (o que, em geral, ocorre imediatamente), retire lentamente a solução para a seringa.
|
Preparação de doses mais altas, utilizando mais de 1 frasco de pó
Se o seu médico recomendou doses mais altas, você pode consegui-las utilizando mais de 1 frasco de pó com uma ampola de dissolvente.
Quando se reconstitui mais de 1 frasco deste medicamento, ao final da fase 4 descrita anteriormente, introduza o conteúdo reconstituído do primeiro frasco novamente na seringa e injete lentamente em um segundo frasco. Repita as fases 2 a 4 para o segundo frasco e subsequentes, até que se dissolva o conteúdo do número de frascos necessário equivalente à dose prescrita (dentro do limite da dose máxima total de 450 UI, correspondente a um máximo de 6 frascos de Meriofert 75 UI ou 3 frascos de Meriofert 150 UI).
O seu médico pode aumentar a dose em 37,5 UI, que representa a metade de um frasco de Meriofert 75 UI.
Para isso, você deve reconstituir o conteúdo do frasco de 75 UI de acordo com as fases 2 a 3 descritas anteriormente e introduzir a metade desta solução reconstituída (0,5 ml) na seringa de acordo com a fase 4.
Nessa situação, você terá duas preparações para injetar: a primeira preparação reconstituída em 1 ml e a segunda contendo 37,5 UI em 0,5 ml.
Ambas as preparações devem ser injetadas com suas próprias seringas de acordo com as seguintes fases.
A solução deve ser transparente e incolor.
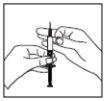
Injeção do medicamento por via subcutânea:
|
|
|
Zona de injeção
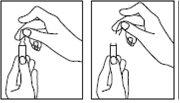
- O médico ou o enfermeiro já terá explicado em que parte do corpo deve administrar o medicamento. Os lugares habituais são a coxa ou a parede inferior do abdômen abaixo do umbigo.
- Limpe a zona de injeção com um algodão umedecido com álcool.
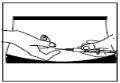
Inserção da agulha:
|
Injeção da solução
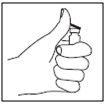
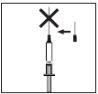
- Injete a seringa sob a pele como indicado. Não a injete diretamente em uma veia. Empurre o êmbolo lentamente e sem interrupções, para que a solução seja injetada corretamente e os tecidos cutâneos não sofram danos.
Leve todo o tempo que precisar para injetar o volume da solução prescrito. Como descrito na preparação da solução, dependendo da dose prescrita pelo seu médico, pode ser que não precise utilizar o volume total da solução.
Retirada da agulha
- Retire rapidamente a seringa e pressione a zona de injeção com um algodão com desinfetante. Os massageamentos suaves na zona (enquanto se mantém a pressão) ajudam a dispersar a solução do medicamento e aliviam as possíveis molestias.
Injeção do medicamento por via intramuscular:
No caso das injeções intramusculares, o profissional de saúde preparará e injetará este medicamento no lateral da coxa ou no glúteo.
Eliminação de todos os utensílios utilizados:
Uma vez finalizada a injeção, todas as agulhas e seringas vazias devem ser descartadas em um contenedor apropriado. Qualquer produto não utilizado ou material de descarte deve ser eliminado de acordo com os requisitos locais.
Se usar mais Meriofertdo que deve:
Desconhecem-se os efeitos da sobredose deste medicamento, no entanto, caberia esperar que se produzisse um síndrome de hiperestimulação ovárica (ver Possíveis efeitos adversos). Se usar mais Meriofert do que deve, consulte o seu médico ou enfermeiro.
Em caso de sobredose ou ingestão acidental, consulte o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone: 91 562 04 20, indicando o medicamento e a quantidade ingerida.
Se esquecer de usar Meriofert:
Use-o no prazo em que lhe tocaria normalmente a próxima injeção. Não tome uma dose dupla para compensar as doses esquecidas.
Se interromper o tratamento com Meriofert:
Não o interrompa por iniciativa própria. Consulte sempre o seu médico antes de deixar de tomar este medicamento.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
O seguinte efeito adverso é importante e exigirá uma intervenção imediata se o padecer. Deverá deixar de tomar este medicamento e acudir ao médico imediatamente se se produzir o seguinte:
Frequentes: pode afetar até 1 de cada 10 pessoas
- Síndrome de hiperestimulação ovárica (os sintomas compreendem a formação de quistes ováricos ou o aumento do tamanho de quistes existentes, dor na parte inferior do estômago, sensação de sede e náuseas com vômitos ocasionais, evacuação de pequenas quantidades de urina concentrada e ganho de peso) (ver seção 2 para obter informações adicionais).
Também se comunicaram os seguintes efeitos adversos:
Muito frequentes:podem afetar a mais de 1 de cada 10 pessoas
- Cefaleia
- Inchaço do estômago ou meteorismo
Frequentes: podem afetar a até 1 de cada 10 pessoas
- Dor ou molestia abdominal
- Dor pélvica
- Dor de costas
- Sensação de peso
- Molestia na mama
- Tontura
- Sofocos
- Sede
- Sensação de doença
- Cansaço
- Malestar geral
- Reações na zona de injeção, tais como dor e inflamação (mais habituais com a injeção IM que com a SC).
Raras: podem afetar a até 1 de cada 1.000 pessoas
- Torsão ovárica (rotação do ovário que causa uma dor de grande intensidade na parte inferior do abdômen)
- Tromboembolia (formação de um coágulo em um vaso sanguíneo que se desprende e é transportado pelo torrente sanguíneo para bloquear outro vaso).
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto.
Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Meriofert
Mantenha este medicamento fora da vista e do alcance das crianças.
Não conserve a temperatura superior a 25°C. Conserve o frasco e a ampola de dissolvente no embalagem exterior para protegê-los da luz.
Não utilize este medicamento após a data de validade que aparece na caixa, o frasco e a ampola do dissolvente após “CAD”. Se a data de validade for indicada como mês/ano, a data de validade é o último dia do mês que se indica.
Utilize imediatamente após a reconstituição.
Não utilize este medicamento se observar que a solução não é transparente. Após a reconstituição, a solução deve ser transparente e incolor.
Os medicamentos não devem ser jogados nos deságues nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Meriofert
O princípio ativo é menotropina.
Cada frasco contém pó liofilizado com 75 UI de atividade de hormona foliculoestimulante (FSH) humana e 75 UI de atividade de hormona luteinizante (LH) humana.
A gonadotropina menopáusica humana (HMG) é extraída da urina de mulheres pós-menopáusicas.
É adicionada gonadotropina coriónica humana (hCG), extraída da urina de mulheres grávidas, para contribuir para a atividade de LH total.
Cada frasco contém pó liofilizado com 150 UI de atividade de hormona foliculoestimulante (FSH) humana e 150 UI de atividade de hormona luteinizante (LH) humana.
A gonadotropina menopáusica humana (HMG) é extraída da urina de mulheres pós-menopáusicas.
É adicionada gonadotropina coriónica humana (hCG), extraída da urina de mulheres grávidas, para contribuir para a atividade de LH total.
Se forem utilizados vários frascos de pó, a quantidade de menotropina em 1 ml de solução reconstituída será a seguinte:
Meriofert 75 UI pó e solvente para solução injetável | Meriofert 150 UI pó e solvente para solução injetável | ||
Número de frascos utilizados | Quantidade total de menotropina em 1 ml de solução | Número de frascos utilizados | Quantidade total de menotropina em 1 ml de solução |
1 | 75 UI | 1 | 150 UI |
2 | 150 UI | 2 | 300 UI |
3 | 225 UI | 3 | 450 UI |
4 | 300 UI | ||
5 | 375 UI | ||
6 | 450 UI |
Os demais componentes (excipientes) são
Pó: lactosa monoidratada.
Solvente: 9 mg/ml de cloreto de sódio e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Pó: torta ou pó liofilizado branco.
Solvente: solução transparente e incolor.
Meriofert é apresentado como pó e solvente para solução injetável.
Um estojo contém:
- 1 frasco com torta ou pó liofilizado branco
- 1 ampola (1 ml) de solução transparente e incolor
É fornecido em caixas de 1, 5 ou 10 estojos.
Pode ser que apenas alguns tamanhos de embalagens sejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
IBSA Farmaceutici Italia srl
Via Martiri di Cefalonia 2
26900 Lodi,
Itália
Responsável pela fabricação
IBSA Farmaceutici Italia srl
Via Martiri di Cefalonia, 2
26900 Lodi
Itália
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Instituto Bioquímico Ibérico IBSA S.L.
Avenida Diagonal 605,
Planta 8, Local 1,
08028 Barcelona
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) com os seguintes nomes (as concentrações e formas farmacêuticas são idênticas em todos os países, apenas mudam os nomes comerciais):
Áustria: Meriofert
Bélgica: Fertinorm
Bulgária: Meriofert
Chipre: Meriofert
República Checa: Meriofert
Dinamarca: Meriofert
Estônia: Meriofert
Finlândia: Meriofert
França: Fertistart
Grécia: Meriofert
Hungria: Meriofert
Itália: Meriofert
Letônia: Meriofert
Lituânia: Meriotert
Luxemburgo: Fertinorm
Noruega: Meriofert
Polônia: Mensinorm
Romênia: Meriofert
Eslováquia: Meriofert
Espanha: Meriofert
Suécia: Meriofert
Países Baixos: Meriofert
Reino Unido: Meriofert
Data da última revisão deste prospecto: novembro 2023
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es )
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, -Substância ativa: human menopausal gonadotrophinFabricante: Angelini Pharma Espana S.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 1200 UISubstância ativa: human menopausal gonadotrophinFabricante: Ferring S.A.Requer receita médicaForma farmacêutica: INJETÁVEL, 1200 UISubstância ativa: human menopausal gonadotrophinFabricante: Ferring S.A.U.Requer receita médica
Alternativas a MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polonia
Alternativa a MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ucrania
Médicos online para MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de MERIOFERT 75 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.