HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: Informação para o utilizador
Humatrope 6 mg/ 12 mg/ 24 mg pó e dissolvente para solução injetável
somatropina
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas a si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Humatrope e para que é utilizado
- O que necessita de saber antes de começar a usar Humatrope
- Como usar Humatrope
- Possíveis efeitos adversos
- Conservação de Humatrope
- Conteúdo do envase e informação adicional
1. O que é Humatrope e para que é utilizado
O seu medicamento ou o medicamento da pessoa ao seu cuidado chama-se Humatrope. Contém hormona de crescimento humana, também chamada somatropina. Humatrope é obtido mediante um processo especial conhecido como tecnologia de ADN recombinante. Tem a mesma estrutura que a hormona de crescimento que o seu corpo produz.
A hormona de crescimento regula o crescimento e desenvolvimento das células do seu corpo. Quando se estimula o crescimento de células na coluna e nos ossos longos das pernas, causa um aumento de altura.
Em casos de deficiência de hormona de crescimento, a hormona de crescimento também aumenta o conteúdo mineral do osso, o número e tamanho das células musculares e reduz os depósitos de gordura corporais.
Humatrope é usado para
- O tratamento de crianças e adolescentes com qualquer das seguintes alterações no crescimento:
- Produção insuficiente de hormona de crescimento (deficiência de hormona de crescimento),
- Ausência de todos ou de alguns cromossomos sexuais-X em mulheres de baixa estatura (Síndrome de Turner),
- Uma doença em que os rins estão danificados (problemas crónicos do modo como funcionam os rins) em crianças com crescimento retardado antes da puberdade,
- Baixa estatura ao nascimento (PEG= pequenos para a idade gestacional) que não tenham recuperado a estatura correspondente aos 4 anos de idade ou mais tarde,
- Uma alteração de um gene chamado SHOX (deficiência SHOX).
- Tratamento de adultos que tenham confirmado deficiência de hormona de crescimento começando bem na infância ou na idade adulta.
2. O que necessita de saber antes de começar a usar Humatrope
Não use Humatrope
- se é alérgico(hipersensível) à somatropina ou a algum dos outros componentes de Humatrope (p. ex. metacresol, glicerol do dissolvente) ver secção 6.
- e informe o seu médico se você padece um tumor ativo (câncer). Os tumores devem estar inativos e você deve ter finalizado o tratamento antitumoral antes de começar o tratamento com Humatrope.
- se parou de crescere quer aumentar o crescimento em altura (placas de crescimento no final dos ossos longos fechadas). O seu médico o examinará e decidirá se ainda necessita de Humatrope após os seus ossos terem parado de crescer.
- se está muito doentee requer cuidados intensivos devido a uma intervenção grave de coração ou abdominal, por ter sido tratado por múltiplos danos após um acidente, ou por requerer tratamento para ajudar a respirar após ter sofrido uma insuficiência respiratória aguda.
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de começar a usar Humatrope.
Se está a receber uma terapia de substituição com glucocorticoides, deve consultar com o seu médico regularmente, pois pode ser necessário um ajuste da sua dose de glucocorticoide.
Se foi tratado por deficiência de hormona de crescimento durante a sua infância, o seu médico o reexaminará para decidir se requer tratamento com Humatrope durante a sua idade adulta.
Se completou tratamento anti-tumoral prévio, pode ser necessário um exame cerebral antes de começar o tratamento com Humatrope. Deve ser examinado regularmente para garantir que o tumor não volte a aparecer ou comece a crescer.
Foi notificado um maior risco de padecer um segundo tumor (benigno ou maligno) em pacientes que sobreviveram ao câncer e foram tratados com somatropina. Destes segundos tumores, em particular, os tumores cerebrais foram os mais comuns.
Se tem sintomas como dores de cabeça frequentes ou fortes, com náuseas e/ou problemas visuais, informe imediatamente o seu médico. O seu médico deve realizar-lhe um exame de olhos para observar se existe evidência de aumento da pressão cerebral. De acordo com os resultados deste exame, o tratamento com Humatrope pode ter que ser interrompido.
Se aparece coxeadura ou dor de anca, por favor consulte com o seu médico. Durante os períodos de crescimento, podem aparecer alterações no osso da anca.
Se começa o tratamento, Humatrope pode afetar a quantidade de hormonas tiroideias no seu sangue. Se o nível de hormona tiroideia é baixo, pode reduzir a sua resposta a Humatrope. Por isso, deve realizar testes regulares da função tiroideia independentemente de que receba tratamento com hormona tiroideia ou não.
Se é uma criança, certifique-se de manter o tratamento até atingir a estatura definitiva.
Se tomar uma dose mais alta do que a prescrita para Humatrope, pode apresentar sobre-crescimento de algumas partes do seu corpo, tais como orelhas, nariz, mandíbula, mãos e pés. A sobredose também pode desencadear aumento dos níveis de açúcar no sangue e açúcar na urina. Use sempre Humatrope como lhe foi indicado pelo seu médico.
Se teve alterações no crescimento devido a um dano renal, deve suspender o tratamento com Humatrope antes do transplante renal.
Se tem doenças críticas agudas, deve notificar o médico que o está a tratar. Foram comunicados casos de morte em pacientes que estavam a receber somatropina durante doenças críticas.
Se tem deficiência de hormona de crescimento e também tem síndrome de Prader-Willi (uma alteração genética), o seu médico deve examinar os seus problemas respiratórios e infecções de vias aéreas antes de começar o tratamento com Humatrope, especialmente se tem excesso de peso, teve previamente problemas respiratórios graves (especialmente durante o sono) ou sofreu infecção pulmonar ou de vias aéreas. Se durante o tratamento tem sinais de problemas respiratórios (roncos), o tratamento deve ser interrompido e a causa avaliada pelo seu médico.
Humatrope pode afetar a forma como o seu corpo age sobre o açúcar da comida e da bebida, interferindo na forma como o seu corpo usa a insulina. Por isso, se tomar Humatrope, o seu médico deve confirmar se o seu corpo está a gerir corretamente o açúcar.
Se tem diabetes mellitus, pode necessitar de um ajuste na sua dose de insulina após começar o tratamento com Humatrope. O seu médico verificará a quantidade de açúcar no seu sangue e pode ajustar o seu tratamento para a diabetes.
Se tem uma alteração no crescimento associada a ter nascido pequeno para a idade gestacional, deve medir o açúcar no sangue e os níveis de insulina antes de começar o tratamento e regularmente durante o tratamento.
Se é um paciente de idade avançada (maior de 65 anos), pode ser mais sensível a Humatrope e pode ser propenso a efeitos adversos.
Humatrope pode causar inflamação do pâncreas, que causa dor intensa no abdômen e nas costas. Contacte com o seu médico se você ou o seu filho desenvolve dor de estômago após tomar Humatrope.
Escoliose (aumento da curvatura lateral da coluna vertebral) pode progredir em qualquer criança durante o crescimento rápido. Os sinais de escoliose devem ser monitorizados durante o tratamento.
Outros medicamentos e Humatrope
Informa ao seu médico ou farmacêutico se está a utilizar, utilizou recentemente, ou pode ter que utilizar qualquer outro medicamento.
Em particular, informe ao seu médico se está a tomar ou recentemente tomou algum dos seguintes medicamentos. Pode ser que o seu médico necessite ajustar a dose de Humatrope ou dos outros medicamentos:
- medicamentos para o tratamento de diabetes mellitusque podem necessitar ser ajustados.
- hormona esteroide adrenal(glucocorticoide), como cortisona ou prednisolona; o seu médico pode necessitar ajustar a dose porque a combinação destes medicamentos com Humatrope pode reduzir o efeito de ambos os tratamentos.
- estrógenos administrados por via oral ou outras hormonas sexuais, dado que podem afetar a resposta ao tratamento com hormona de crescimento. Se houver uma mudança na forma como se tomam os estrógenos (p. ex. de oral para transdérmico: através da pele); pode ser necessário ajustar a dose de Humatrope.
- medicamentos para prevenir convulsões (anticonvulsivantes) ou ciclosporina.
Gravidez e amamentação
Humatrope não deve ser utilizado durante a gravidez, a não ser que o seu médico o indique. Informe imediatamente o seu médico se está grávida.
Desconhece-se se a somatropina passa para o leite materno. Se está a amamentar ou tem intenção de o fazer, consulte com o seu médico antes de usar Humatrope.
Condução e uso de máquinas
Humatrope não tem efeitos conhecidos sobre a capacidade para conduzir ou utilizar máquinas.
Humatrope contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose diária; isto é, essencialmente isento de sódio.
Uso em desportistas
Este medicamento contém somatropina que pode produzir um resultado positivo nos testes de controlo de dopagem.
3. Como usar Humatrope
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
- Certifique-se sempre de usar o cartucho com a concentração que o seu médico lhe prescreveu (concentração de 6 mg, 12 mg ou 24 mg) e o sistema correto de injeção de pluma de Humatrope com marcado CE. Nunca use cartuchos de outros medicamentos na sua pluma de Humatrope.
- Cada cartucho de Humatrope vem com uma seringa que contém um diluente (dissolvente para solução injetável) para a sua reconstituição (mistura e preparação da solução injetável).
- Não misture ou se injete Humatrope até que não tenha recebido o suficiente treinamento do seu médico ou outros profissionais de saúde qualificados.
- Para instruções detalhadas de como preparar e injetar Humatrope, ver secção “Como injetar Humatrope”no final deste prospecto. Só deve misturar Humatrope com o diluente facilitado. Nunca o misture com nada mais, a não ser que o seu médico o indique.
- Após a reconstituição, Humatrope deve ser injetado no tecido gordo justo abaixo da pele, usando uma agulha curta e um sistema de injeção de pluma.
- Devem ser variados os locais de injeção para evitar a redução e endurecimento local do tecido gordo abaixo da pele (lipoatrofia).
- Após misturar Humatrope, não o deixe fora da geladeira por mais de 30 minutos cada dia.
- Mantenha a sua pluma com o resto de Humatrope na geladeira. Não use o Humatrope sobrante após 28 dias após a mistura.
Dose
O seu médico indicará a sua pauta de dose e administração. Não altere a sua dose sem consultar o seu médico.
Normalmente, o tratamento com Humatrope é um tratamento a longo prazo; pode ser necessário que o seu médico ajuste a sua dose com o tempo, dependendo do seu peso corporal e da resposta ao tratamento. Em geral, a dose é calculada de acordo com as seguintes recomendações e é administrada uma vez ao dia:
Crianças e adolescentes com:
- Deficiência de hormona de crescimento:
0,025 - 0,035 mg/ kg de peso e dia,
- Síndrome de Turner:
0,045 - 0,050 mg/ kg de peso e dia,
- Problemas crónicos devido à forma como funcionam os rins:
0, 045 - 0,050 mg/ kg de peso e dia,
- Pequenos para a idade gestacional ao nascimento:
0,035 mg/ kg de peso e dia. A dose deve ser suspensa após o primeiro ano de tratamento se o ritmo de crescimento for insuficiente,
- Deficiência do gene SHOX:
0,045 - 0,050 mg/ kg de peso e dia.
Deficiência de hormona de crescimento em adultos:
Deve começar o tratamento com uma dose baixa de 0,15-0,30 mg diários. Pode ser necessário começar com doses mais baixas em pacientes com excesso de peso ou de idade avançada. A dose inicial pode ser aumentada gradualmente de acordo com as necessidades individuais. A dose total diária normalmente não excede 1 mg.
As necessidades de dose podem diminuir com a idade. As mulheres, especialmente aquelas com tratamentos substitutivos com estrógenos orais, podem necessitar de doses mais altas do que os homens.
Se usar mais Humatrope do que deve
Se se injetou mais Humatrope do que devia, consulte o seu médico.
- Se se injetou demasiado Humatrope, inicialmente o açúcar no sangue pode diminuir e chegar a ser muito baixo (hipoglicemia) e posteriormente aumentar e chegar a ser muito alto (hiperglicemia).
- Se se injeta demasiado Humatrope durante um período longo de tempo (anos), pode experimentar sobre-crescimento de algumas partes do seu corpo, como orelhas, nariz, mandíbula, mãos e pés (acromegalia).
Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone 91 562 04 20, indicando o medicamento e a quantidade ingerida.
Se esqueceu de usar Humatrope
Não se injete uma dose dupla para compensar as doses esquecidas. Continue com a dose prescrita. Se se esqueceu de se injetar Humatrope e tem dúvidas sobre o que fazer, consulte o seu médico.
Se interromper o tratamento com Humatrope
Pergunte ao seu médico antes de suspender o tratamento. Uma interrupção ou suspensão prematura do tratamento com Humatrope pode afetar o sucesso do tratamento com Humatrope.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Você pode ter qualquer um dos seguintes efeitos adversos após se injetar Humatrope:
Foi utilizado o seguinte critério para a classificação dos efeitos adversos:
Muito frequentes: podem afetar mais de 1 de cada 10 pacientes
Frequentes: podem afetar até 1 de cada 10 pacientes
Pouco frequentes: podem afetar até 1 de cada 100 pacientes
Raros: podem afetar até 1 de cada 1.000 pacientes
Muito raros: podem afetar até 1 de cada 10.000 pacientes
Outros possíveis efeitos adversos (a frequência não pode ser estimada a partir dos dados disponíveis)
Crianças | ||||
Frequentes | Pouco Frequentes | Raros | Muito Raros | Outros |
Dor no local de injeção Inchaço (Edema) Aumento do açúcar no sangue (hiperglicemia) Hipersensibilidade ao metacresol ou/ e ao glicerol Níveis baixos de hormona tiroideia Desenvolvimento de anticorpos frente à hormona de crescimento Progressão da escoliose (um aumento da curvatura lateral da coluna vertebral) | Debilidade Diabetes mellitus tipo 2 Aumento do tamanho das mamas (ginecomastia) | Dores de cabeça fortes ou frequentes com náuseas e/ ou problemas de visão que são sinais de uma pressão aumentada no cérebro (hipertensão intracraniana benigna). Comunique imediatamente ao seu médico se isso ocorre. Adormecimento e formigamento (parestesia) Dor muscular localizado (mialgia) | Dificuldade para dormir (insônia) Tensão arterial alta (hipertensão) Açúcar na urina (glicosúria) | Hipersensibilidade ao princípio ativo |
Adultos | ||||
Muito Frequentes | Frequentes | Pouco Frequentes | Raros | Outros |
Dor de cabeça Dor nas articulações (artralgia) | Dor no local de injeção Inchaço (Edema) Níveis altos de açúcar no sangue (hiperglicemia) Hipersensibilidade ao metacresol e/ ou ao glicerol Níveis baixos de hormona tiroideia Dificuldade para dormir (insônia) Adormecimento e formigamento (parestesia) Adormecimento e formigamento nos dedos e na palma da mão devido à opressão do nervo da muñeira (Síndrome do túnel carpiano) Dor muscular localizado (mialgia) Tensão arterial alta (hipertensão) Dificuldade para respirar (Disneia) Interrupção temporária da respiração durante o sono (Apneia do sono) | Debilidade Aumento do tamanho das mamas (ginecomastia) | Dores de cabeça fortes ou frequentes com náuseas e/ ou problemas de visão que são sinais de um aumento da pressão cerebral (hipertensão intracraniana benigna). Informe imediatamente ao seu médico se isso lhe ocorre. Açúcar na urina (glicosúria) | Diabetes mellitus tipo 2 Hipersensibilidade ao princípio ativo |
O efeito da insulina pode estar reduzido.
Foi comunicada leucemia em um número baixo de crianças que foram tratadas com hormona de crescimento. No entanto, não há provas de que a incidência de leucemia esteja elevada em pacientes que estão a receber hormona de crescimento.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Español de Farmacovigilância de Medicamentos de Uso Humano: www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Humatrope
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e no envase. A data de validade (CAD) é o último dia do mês que se indica.
Não utilize este medicamento se observar que a solução não é transparente ou se contém partículas.
Humatrope deve ser conservado sempre na geladeira (entre 2°C e 8°C). Não congelar.
Uma vez reconstituído, não deixe Humatrope fora da geladeira durante mais de 30 minutos por dia.
Uma vez reconstituído, Humatrope pode ser utilizado até um máximo de 28 dias se for conservado na geladeira e estiver fora da geladeira não mais de 30 minutos por dia a temperatura ambiente.
Os medicamentos não devem ser jogados nos deságues ou na lixeira. Deposite os envases e os medicamentos que não precisa no ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Humatrope
Pó do cartucho
O princípio ativoé somatropina. Cada cartucho contém 6 mg, 12 mg ou 24 mg, dependendo da concentração. Uma vez reconstituído:
- Humatrope 6mgcorresponde a 2,08 mg de somatropina por ml de solução
- Humatrope 12mgcorresponde a 4,17 mg de somatropina por ml de solução
- Humatrope 24mgcorresponde a 8,33 mg de somatropina por ml de solução
Os demais componentes são: manitol, glicina, fosfato sódico dibásico.
[Durante o processo de fabricação, pode ter sido utilizado ácido fosfórico ou hidróxido de sódio (ou ambos) para ajustar a acidez].
Disolvente estéril da seringa
O disolvente pré-carregado da seringa contém: glicerol, metacresol, água para preparações injetáveis. [Durante o processo de fabricação, pode ter sido utilizado ácido clorídrico ou hidróxido de sódio (ou ambos) para ajustar a acidez].
Aspecto do produto e conteúdo do envase
Humatrope 6 mg: |
Tamanho de envase de 1, 5 e 10 |
Humatrope 12 mg: |
Tamanho de envase de 1, 5 e 10 |
Humatrope 24 mg: |
Tamanho de envase de 1, 5 e 10 |
Pode ser que nem todos os tamanhos de envases sejam comercializados
Título da autorização de comercialização
LILLY, S.A. Avda. de la Industria, 30. 28108 Alcobendas (Madrid).
Responsável pela fabricação
Lilly France, S.A.S. Rue du Colonel Lilly, 67640 Fegersheim (França).
Para qualquer informação sobre este medicamento, entre em contato com o Titular da autorização de comercialização (ou com o representante local):
Lilly, S.A. Avda. de la Industria, 30. 28108 Alcobendas (Madrid).
Este medicamento está autorizado nos estados membros do Espaço Econômico Europeu com os seguintes nomes:
Nos estados membros do Espaço Econômico Europeu onde este produto está autorizado, está autorizado sob o nome de “Humatrope”, exceto na França, onde está autorizado como “Umatrope”.
Como injetar Humatrope 6 mg/ 12mg/ 24 mg
As seguintes instruções explicam como injetar Humatrope. Leia as instruções detalhadamente e siga-as passo a passo.
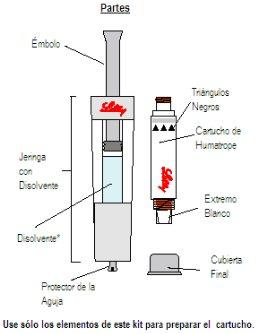
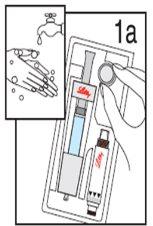
Iniciando: Necessitará cinco peças:
Lave as mãos antes de continuar com os passos seguintes. |
|
*Nota: O líquido é incoloro. É mostrado de cor azul apenas com o propósito de ilustrar. |
Os passos seguintes o guiarão em como preparar seu novo cartucho para uso | ||
Passo 1 Desembalagem
| ||
Retire TODOSos conteúdos da caixa. Nota: este produto está projetado para ser usado por canhotos ou destrinos. Por favor, use a mão que mais confortável lhe resulte. | Segure o protetor da agulha, situado no final da seringa de disolvente. | Retire o protetor da agulha e descarte-o. NÃOpressione ainda o êmbolo. Em ocasiões, se desprende uma gota de líquido. Não é necessário liberar o ar da seringa de disolvente. |
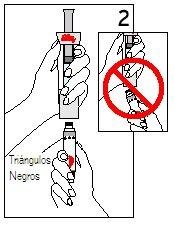
Passos 2 e 3 Colocação do cartucho
| ||
Sujete o cartucho com os triângulos negros para cima. Coloque o cartucho e a seringa do disolvente em linha reta. NÃOintroduza o cartucho inclinado. | EMPURREo cartucho RETOaté o topo Eaté que os triângulos negros FICEM COBERTOS. Pode escutar ou sentir um “clic”. NÃOgire o cartucho. | |
| ||
Mantenha a seringa de disolvente e o cartucho unidos com as DUAS MÃOS. Pressione e solte o êmbolo 2 ou 3 vezes até que o disolvente esteja no cartucho. | Retire o dedo polegar do êmbolo e verifique que a seringa de disolvente esteja vazia (é normal que permaneçam na seringa pequenas gotas de disolvente). | |
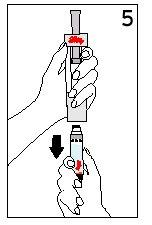
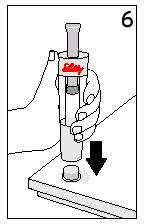
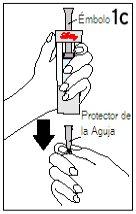
Passos 5 e 6 Retirada do Cartucho e Eliminação do Disolvente
| ||
Com o dedo polegar AFASTADOdo êmbolo, retire o cartucho da seringa de disolvente | Coloque a cobertura final sobre uma superfície dura e lisa. Empurre a seringa de disolvente sobre a cobertura final e elimine imediatamente a seringa de disolvente seguindo as instruções do seu médico. | |
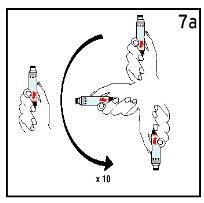
Passo 7 Mistura Suave
| ||
Mova suavemente o cartucho 10 vezes para misturar e deixe-o repousar 3 minutos. NÃO AGITAR. | Observe a solução. A solução de Humatrope deve ser transparente. | |
Passo 8 Injeção de Humatrope utilizando um sistema de injeção de caneta adequado.
|
Humatrope é uma marca registrada de Eli Lilly and Company Limited
Data da última revisão deste prospecto: Julho 2021
A informação detalhada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.es/
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 12 mg de somatropinaSubstância ativa: somatropinFabricante: Pfizer S.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 5,3 mg de somatropinaSubstância ativa: somatropinFabricante: Pfizer S.L.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,2 mg de somatropinaSubstância ativa: somatropinFabricante: Pfizer S.L.Requer receita médica
Alternativas a HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polónia
Alternativa a HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de HUMATROPE 24 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.




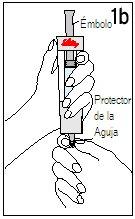
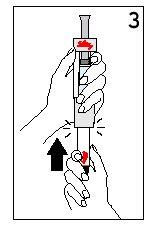
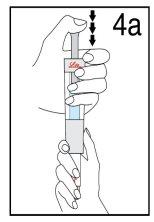
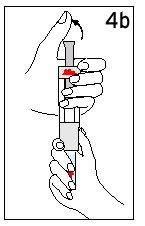 Passo 4 Mistura de Humatrope
Passo 4 Mistura de Humatrope