ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Eligard trimestral 22,5 mg
pó e dissolvente para solução injetável
Leuprorrelina, acetato.
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
|
Conteúdo do prospecto:
- O que é Eligard trimestral e para que é utilizado
- O que precisa saber antes de começar a usar Eligard trimestral
- Como usar Eligard trimestral
- Posíveis efeitos adversos
- Conservação de Eligard trimestral
- Conteúdo do envase e informação adicional
1. O que é Eligard trimestral e para que é utilizado
O princípio ativo de Eligard trimestral pertence ao grupo dos análogos da hormona liberadora de gonadotropina. Estes medicamentos são usados para reduzir a produção de certas hormonas sexuais (testosterona).
Eligard trimestral é usado para tratar o carcinoma de próstatametastásico hormonodependente em varões adultos e no tratamento do carcinoma de próstata de alto risco não metastásico hormonodependente em combinação com radioterapia.
2. O que precisa saber antes de começar a usar Eligard trimestral
Não use Eligard trimestral
- Se é uma muller ou uma criança.
- Se é hipersensível (alérgico)ao princípio ativo acetato de leuprorrelina, a medicamentos com uma atividade comparável à hormona liberadora de gonadotropina natural ou a qualquer um dos outros componentes de Eligard trimestral (incluídos na secção 6).
- Depois da eliminação cirúrgica dos testículos, posto que, nesse caso, Eligard trimestral não conduz a um decréscimo adicional das concentrações de testosterona sérica.
- Como tratamento único se sofre sintomas relacionados com a pressão sobre a medula espinal ou com um tumor na coluna vertebral. Neste caso, Eligard trimestral pode ser usado apenas em combinação com outros medicamentos para o carcinoma de próstata.
Advertências e precauções
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar Eligardtrimestral
- Se padece: qualquer alteração cardíaca ou dos vasos sanguíneos, incluídos os problemas de ritmo cardíaco (arritmias), ou se está sendo tratado com medicamentos para corrigir estas alterações. O risco de problemas de ritmo cardíaco pode ver-se aumentado com a utilização de Eligard trimestral.
- Se tem dificuldade para urinar. Deve ser vigilado estreitamente durante as primeiras semanas de tratamento.
- Se começa a sofrer pressão sobre a medula espinal ou dificuldade para urinar. Já que se comunicaram casos graves (relacionados com outros medicamentos que têm um mecanismo de ação similar ao de Eligard trimestral) de pressão sobre a medula espinal e um estreitamento dos condutos que há entre os rins e a bexiga urinária que pode contribuir para a aparência de sintomas semelhantes à paralisia. Se se produzirem estas complicações, deve iniciar-se o tratamento habitual nestes casos.
- Se experimenta, nas duas semanas seguintes a tomar Eligard trimestral, dor de cabeça repentina, vómitos, alteração do estado mental e algumas vezes colapso do coração, avise o médico ou equipa médica. Raramente, estes casos foram comunicados com OUTROS MEDICAMENTOS que têm um mecanismo similar a Eligard trimestral, e que se conhece como apoplexia hipofisária.
- Se sofre diabetes mellitus(níveis altos de glicose no sangue). Deve ser controlado com frequência durante o tratamento.
- O tratamento com Eligard trimestral pode aumentar o risco de fracturas devido à osteoporose (diminuição da densidade óssea).
- Comunicaram-se casos de depressão em pacientes que usavam Eligard trimestral. Se está usando Eligard trimestral e começa a ter um estado de ânimo depressivo, informe o seu médico.
- Comunicaram-se casos de efeitos cardiovasculares em pacientes que utilizavam medicamentos semelhantes a Eligard trimestral que se desconhece se estão relacionados com estes medicamentos. Se está usando Eligard trimestral e começa a sofrer sinais ou sintomas cardiovasculares, informe o seu médico.
- Comunicaram-se casos de crises epilépticas em pacientes após a administração de Eligard trimestral. Se está usando Eligard trimestral e começa a sofrer crises epilépticas, informe o seu médico.
- Entre em contacto com o seu médico imediatamente se padece cefaleias intensas ou recorrentes, problemas visuais e acúfenos ou zumbidos.
- Tem fígado gordo.
Comunicaram-se erupções cutâneas graves, incluído síndrome de Stevens-Johnson/necrólise epidérmica tóxica (SJS/NET) em associação com leuprorrelina. Suspenda o uso de leuprorrelina e procure atendimento médico imediatamente se nota qualquer um dos sintomas relacionados com estas reações cutâneas graves descritas na secção 4.
Complicações no início do tratamento
Durante a primeira semana de tratamento, geralmente se produz um aumento breve da hormona sexual masculina, testosterona, no sangue. Isto pode levar a umagravamento temporáriodos sintomas relacionados com a doença e também à aparência de novos sintomas que não se haviam experimentado até esse momento. Estes sintomas incluem especialmente dor de ossos, distúrbios para urinar, pressão sobre a medula espinal ou presença de sangue na urina. Estes sintomas remitem normalmente ao continuar o tratamento. Se os sintomas não remitem, deve contactar o seu médico.
Se não melhora com Eligard trimestral
Uma proporção dos pacientes terá tumores que não são sensíveis à diminuição das concentrações de testosterona sérica. Se tem a impressão de que o efeito de Eligard trimestral não é o esperado, comunique-o ao seu médico.
Uso de Eligard trimestralcom outros medicamentos
Este medicamento pode interferir com alguns medicamentos que se utilizam para tratar problemas do ritmo cardíaco (p. ex: quinidina, procainamida, amiodarona e sotalol) ou pode aumentar o risco de problemas do ritmo cardíaco quando se usa com certos medicamentos (p. ex: metadona (usada para o alívio da dor e como parte da desintoxicação da drogadição), moxifloxacino (um antibiótico), antipsicóticos usados para doenças mentais graves).
Informa ao seu médico ou farmacêutico se está utilizando ou utilizou recentemente qualquer outro medicamento, mesmo os adquiridos sem receita.
Gravidez e amamentação
Este medicamento está contraindicado em mulheres.
Condução e uso de máquinas
O cansaço, os mareios e os distúrbios na visão são possíveis efeitos secundários do tratamento com Eligard trimestral ou podem aparecer devido à doença. Se sofre estes efeitos adversos, tenha cuidado quando conduzir ou utilizar máquinas.
3. Como usar Eligard trimestral
Dose
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A menos que o seu médico o prescreva de outra forma, este medicamento é administrado uma vez cada três meses.
A solução injetada forma um depósito de princípio ativo a partir do qual se produz uma liberação contínua do princípio ativo, acetato de leuprorrelina, durante um período de três meses.
Testes adicionais
A resposta ao tratamento com este medicamento deve ser revista pelo seu médico, comprobatando uns valores clínicos específicos e determinando as concentrações no sangue do chamado antígeno prostático específico (PSA).
Forma de administração
Este medicamento só deve ser administrado pelo seu médicoou enfermeiro. Eles serão os responsáveis pela sua preparação.
Depois da preparação, Eligard trimestral é administrado como injeção subcutânea (injeção no tecido que está debaixo da pele). A injeção intra-arterial (numa artéria) ou intravenosa (numa veia) deve ser evitada totalmente. Como ocorre com outros princípios ativos que se injetam por via subcutânea, o local da injeção deve ser alterado periodicamente.
Se receber mais Eligard trimestral do que devia
Como normalmente a injeção a administrará o seu médico ou pessoal qualificado, não é de esperar que se produza sobredosagem.
Se, apesar disso, se administrou uma quantidade maior do que a prevista, contacte o seu médico para que o controle especialmente e lhe administre um tratamento adicional conforme seja preciso ou consulte o Serviço de Informação Toxicológica. Telefone 91 562 04 20.
Se se esquecer da administração de Eligard trimestral
Fale com o seu médico se acredita que se esqueceu da sua administração trimestral do medicamento.
Efeitos quando se interrompe o tratamento com Eligard trimestral
Como regra geral, o tratamento do cancro da próstata com este medicamento é prolongado. Por isso, o tratamento não deve ser interrompido, mesmo que se produza uma melhoria dos sintomas ou estes desapareçam totally.
Se o tratamento com este medicamento for interrompido prematuramente, pode produzir-se um agravamento dos sintomas relacionados com a doença.
Não deve interromper o tratamento prematuramente sem consultar previamente o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Posíveis efeitos adversos
Como todos os medicamentos, Eligard trimestral pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Os efeitos adversos que se têm observado durante o tratamento com Eligard trimestral atribuem-se principalmente ao efeito específico do princípio ativo, leuprorrelina acetato, concretamente o aumento e a diminuição de certas hormonas. Os efeitos adversos descritos com maior frequência são os sofocos (aproximadamente 58 % dos pacientes), náuseas, malestar geral e cansaço, assim como a irritação local temporária no local da injeção.
Efeitos adversos no início do tratamento
Durante as primeiras semanas de tratamento com Eligard trimestral, os sintomas específicos da doença podem agravar-se, porque, no início, há um aumento breve da hormona sexual masculina, testosterona, no sangue. Por isso, o seu médico pode administrar-lhe um antiandrógeno adequado (substância que inibe o efeito da testosterona) na fase inicial do tratamento para reduzir os possíveis efeitos indesejáveis. (Ver também a Secção 2 Antes de usarEligardtrimestral, Complicações no início do tratamento).
Efeitos adversos locais
Os efeitos adversos locais que se têm descrito após a injeção de Eligard trimestral são típicos daqueles que, muitas vezes, se associam a preparados semelhantes que se injetam por via subcutânea (preparados que se injetam no tecido que está debaixo da pele). A queimadura leve imediatamente após a injeção é muito frequente. O ardor e a dor após a injeção, assim como os cardenales no local da injeção, são frequentes. O avermelhamento da pele no local da injeção foi comunicado frequentemente. O endurecimento dos tecidos e a ulceração são pouco frequentes.
Estes efeitos adversos locais após a injeção subcutânea são leves e tem-se descrito que a sua duração é breve. Não se voltam a produzir entre injeções individuais.
Efeitos adversos muito frequentes (podem afetar mais de 1 de cada 10 pessoas)
- Sofocos
- Hemorragias espontâneas na pele ou na membrana mucosa, avermelhamento da pele
- Cansaço, efeitos adversos relacionados com a injeção (Ver também efeitos adversos locais acima)
Efeitos adversos frequentes (podem afetar até 1 de cada 10 pessoas)
- Nasofaringite (sintomas do resfriado comum)
- Náuseas, malestar geral, diarreia, inflamação do estômago e intestinos (gastroenterite/colite)
- Coceira, suores noturnos
- Dor nas articulações
- Ir de forma irregular ao serviço para urinar (também à noite), dificuldade para começar a urinar, dor ao urinar, volume reduzido de urina
- Sensibilidade mamária, inflamação mamária, diminuição do tamanho dos testículos, dor testicular, infertilidade, disfunção eréctil, redução do tamanho do pênis
- Rigidez (episódios de tremores exagerados com febres altas), debilidade
- Prolongamento do tempo de sangramento, alterações nos valores sanguíneos, diminuição de glóbulos vermelhos/baixo recuento de glóbulos vermelhos
Efeitos adversos pouco frequentes (podem afetar até 1 de cada 100 pessoas)
- Infecção do trato urinário, infecção cutânea local
- Agravamento da diabetes mellitus
- Sonhos anormais, depressão, diminuição da libido
- Mareios, dor de cabeça, distúrbios da sensibilidade na pele, insónia, distúrbio do gosto, distúrbio do olfato
- Hipertensão (aumento da pressão sanguínea), hipotensão (descida da pressão sanguínea)
- Falta de ar
- Prisão de ventre, secura da boca, dispepsia (má digestão, sintomas de ter o estômago cheio, dor de estômago, arrotos, náuseas, vómitos, sensação de ardor no estômago), vómitos
- Sensação de abafamento, aumento da sudorese
- Dor lombar, cãibras musculares
- Hamaturia (presença de sangue na urina)
- Espasmos da bexiga, ir ao serviço mais frequentemente do que o habitual, incapacidade para urinar
- Aumento do tecido mamário masculino, impotência
- Letargia (sonolência), dor, febre
- Aumento de peso
- Perda de equilíbrio, mareio
- Perda de massa muscular/perda de tecido muscular após uso prolongado
Efeitos adversos raros (podem afetar até 1 de cada 1.000 pessoas)
- Movimentos involuntários anormais
- Perda súbita da consciência, desmaios
- Flatulência, arrotos
- Perda de cabelo, erupção cutânea (grãos na pele)
- Dor nos seios
- Ulceração no local da injeção
Efeitos adversos muito raros (podem afetar até 1 de cada 10.000 pessoas)
- Necrose no local da injeção
Não conhecido (a frequência não pode ser estimada a partir dos dados disponíveis)
- Alterações no eletrocardiograma (prolongamento do intervalo QT)
- Inflamação dos pulmões, doença pulmonar
- Hipertensão intracraniana idiopática (aumento da pressão intracraniana em torno do cérebro caracterizado por cefaleias, diplopia e outros sintomas visuais, acúfenos ou zumbidos em um ou ambos os ouvidos).
- Se nota que no tronco tem manchas circulares ou em forma de alvo, de cor avermelhada e não elevadas, muitas vezes com bolhas centrais, descamação da pele, úlceras na boca, na garganta, na nariz, nos genitais e nos olhos. Estas erupções cutâneas graves podem estar precedidas de febre e sintomas de tipo gripal (síndrome de Stevens-Johnson/necrólise epidérmica tóxica).
- Avermelhamento da pele e erupção com coceira (Erupção cutânea tóxica).
- Uma reação cutânea que provoca grãos ou manchas vermelhas na pele, que podem parecer um alvo, com um centro vermelho escuro rodeado de anéis de cor vermelha mais clara (eritema multiforme).
Outros efeitos adversos
Outros efeitos adversos publicados em relação ao tratamento com leuprorrelina, o princípio ativo de Eligard trimestral, são edema (acumulação de líquido no tecido, aparecendo como inchaço das mãos e pés), embolia pulmonar (produz sintomas como sensação de falta de ar, dificuldade para respirar e dor no peito), palpitações (percepção dos batimentos do coração), debilidade muscular, arrepios, erupção cutânea, perda da memória e deterioração da visão. Pode esperar-se um aumento na perda de tecido ósseo (osteoporose) após um tratamento prolongado com Eligard trimestral. Devido à osteoporose, o risco de fracturas aumenta.
Raramente se comunicaram reações alérgicas graves que causam dificuldade para respirar ou sensação de mareio após a administração de produtos da mesma classe que Eligard trimestral.
Comunicaram-se crises epilépticas após a administração de produtos da mesma classe que Eligard trimestral.
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Eligard trimestral
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase após CAD. A data de validade é o último dia do mês que se indica.
Instruções de conservação
Conservar em frigorífico (entre 2°C e 8°C).
Conservar no embalagem original para protegê-lo da humidade.
Este produto deve estar à temperatura ambiente antes da injeção. Retire do frigorífico aproximadamente 30 minutos antes de usar. Uma vez fora do frigorífico, este produto pode ser conservado no seu embalagem original à temperatura ambiente (por debaixo de 25ºC) até 4 semanas.
Uma vez que se abriu a bandeja, o produto deve ser preparado imediatamente e deve ser usado imediatamente. Apenas para um único uso.
Instruções para a eliminação dos envases de Eligard trimestral não usados ou caducados
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Eligard trimestral
O princípio ativo é acetato de leuprorelina.
Uma seringa precarregada (seringa B) contém 22,5 mg de acetato de leuprorelina.
Os demais componentes são ácido poli (DL-láctico-co-glicólico) (75:25) e N-metil-2-pirrolidona na seringa precarregada com solução injetável (seringa A).
Aspecto de Eligard trimestral e conteúdo do envase
Pó e dissolvente para solução injetável.
Está disponível nos seguintes envases:
- Um envase tipo bandeja termoformada e uma agulha estéril de calibre 20 inseridas em um suporte de cartão. A bandeja contém uma bolsa com dessecante e um sistema de seringa pré-conectado que consiste em:
- seringa A precarregada com o dissolvente
- seringa B precarregada com o pó
um conector com botão de engate para a seringa A e B.
- Um envase múltiplo que contém 2 estuches de sistema com seringa pré-conectada.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali, 1
20148 Milão
Itália
Responsável pela fabricação
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali, 1
20148 Milão
Itália
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Casen Recordati, S.L.
Auto-estrada de Logroño, km 13,300
50180 Utebo - Zaragoza
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Áustria: Eligard Depot 22,5 mg
Bélgica: Depo-Eligard 22,5 mg
Chipre: Eligard
República Checa: Eligard
Dinamarca: Eligard
Estônia: Eligard
Finlândia: Eligard
França: Eligard 22,5 mg
Alemanha: Eligard 22,5 mg
Hungria: Eligard 22,5 mg
Islândia: Eligard
Irlanda: Eligard 22,5 mg
Itália: Eligard
Letônia: Eligard 22,5 mg
Lituânia: Eligard 22,5 mg
Luxemburgo: Depo-Eligard 22,5 mg
Países Baixos: Eligard 22,5 mg
Noruega: Eligard
Polônia: Eligard 22,5 mg
Portugal: Eligard 22,5 mg
Eslováquia: Eligard 22,5 mg
Eslovênia: Eligard 22,5 mg
Espanha: Eligard trimestral 22,5 mg
Suécia: Eligard
Data da última revisão deste prospecto:10/2024
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.es/
Esta informação está destinada unicamente a profissionais do setor sanitário:
Aguarde até que o medicamento atinja a temperatura ambiente, retirando-o da geladeira aproximadamente 30 minutos antes de seu uso.
Por favor, prepare primeiro o paciente para a injeção, a seguir prepare o medicamento seguindo as instruções indicadas abaixo. Se o medicamento não for preparado utilizando a técnica correta, não deve ser administrado, pois pode produzir falta de eficácia clínica devido à sua reconstituição incorreta.
Passo 1
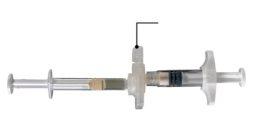
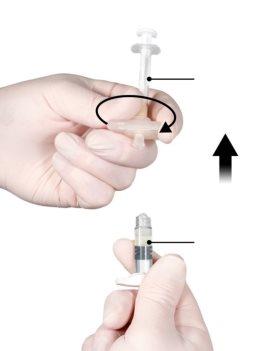
Em uma zona limpa, abra a bandeja retirando o alumínio pela esquina para sacar o conteúdo. Descarte a bolsa de dessecante. Retire o sistema de seringa pré-conectado (Figura 1.1) da bandeja. Abra o pacote da agulha de segurança (Figura 1.2) removendo a pestaña de papel . Nota:a seringa A e a seringa B não devem estar alinhadas ainda.
Figura 1.1 Conteúdo da bandeja: sistema de seringa pré-conectada | Figura 1.2 Abaixo da bandeja: agulha de segurança e capuchão |
|
|
Passo 2
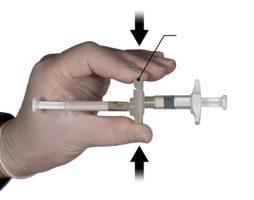
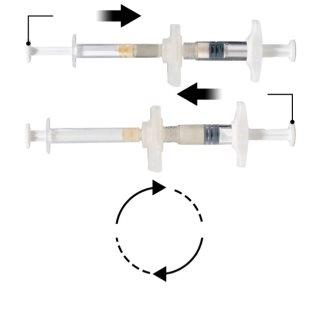
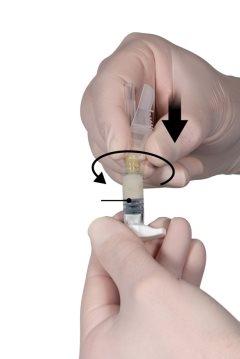
Segure o botão de engate do conector com o índice e o polegar e pressione (Figura 2) até que ouça um estalo. As duas seringas estarão alinhadas. Não se requer nenhuma orientação particular do sistema de seringas para ativar o conector. Não dobre o sistema de seringas (por favor, tenha em conta que poderia sair parte do medicamento se as seringas forem parcialmente desenroscadas).
Figura 2 |
|
Passo 3
Segure as seringas em posição horizontal, transfira o conteúdo líquido da seringa A para o pó de acetato de leuprorelina contido na seringa B. Misture bem o produto durante 60 ciclos pressionando suavemente o conteúdo de ambas as seringas para a frente e para trás entre as seringas (um ciclo é uma pulsação do êmbolo para a seringa A e uma pulsação do êmbolo para a seringa B) em posição horizontal para obter uma solução homogênea e viscosa (Figura 3). Não dobre o sistema de seringas (por favor, tenha em conta que poderia sair parte do medicamento se as seringas forem parcialmente desenroscadas).
Figura 3 |
|
Quando estiver minuciosamente misturada, a solução viscosa terá uma cor dentro da gama do incoloro ao branco-amarelado pálido (que poderia incluir tons desde o branco ao amarelado pálido).
Importante: após misturar, continue com o próximo passo imediatamente, pois a viscosidade do produto aumenta com o tempo. Não refrigere o medicamento uma vez reconstituído.
Por favor, tenha em conta: O medicamento deve ser misturado como se descreve; agitando NÃO obterá uma mistura adequada.
Passo 4
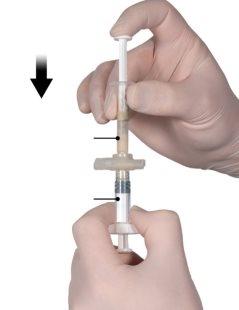
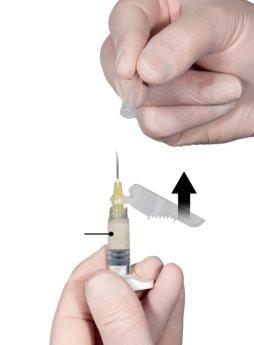
Após ter misturado, segure as seringas verticalmente com a seringa B na parte inferior. As seringas devem permanecer bem acopladas. Transfira todo o conteúdo para a seringa B (seringa larga, curta) apertando o êmbolo da seringa A e retraindo ligeiramente o êmbolo da seringa B (Figura 4).
Figura 4 |
|
Passo 5
Enquanto se assegura de que o êmbolo da seringa A está completamente pressionado para baixo, segure o conector e desenrosque-o da seringa B. A seringa A permanecerá unida ao conector (Figura 5). Assegure-se de que não sai o conteúdo, pois, se não, a agulha não se ajustará adequadamente quando for acoplada.
Por favor, tenha em conta: Na preparação pode restar uma bolha de ar grande ou várias pequenas - isso é aceitável. Por favor, não purgue as bolhas de ar da seringa B neste momento, pois se perderia medicamento!
Figura 5 |
|
Passo 6
- Mantenha a seringa B em posição vertical e mantenha para trás o êmbolo branco para evitar que se perca medicamento.
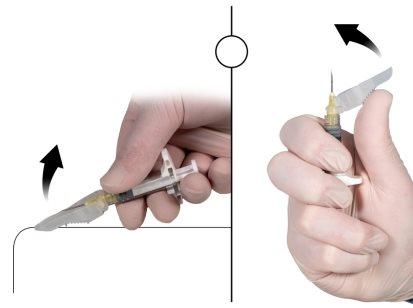
- Fixe a agulha de segurança à seringa B segurando a seringa B e girando suavemente a agulha no sentido dos ponteiros do relógio, aproximadamente três quartos de giro, até que a agulha fique fixada (Figura 6).
Não aperte em excesso, pois se poderia rachar o cone da agulha e sair o medicamento durante a injeção. O capuchão de segurança também pode ser danificado se a agulha for enroscada com demasiada força.
Não se deve utilizar o medicamento se o cone da agulha se rachar, apresentar danos ou sair o conteúdo. A agulha danificada não se deve substituir/repor, e o medicamento não se deve injetar. Todos os elementos do dispositivo de administração se devem descartar de forma segura.
Se o cone da agulha resultar danificado, se deve repor o medicamento por outro novo.
Figura 6 |
|
Passo 7
Imediatamente antes da administração, afaste da agulha a cobertura de segurança e retire o capuchão protetor da agulha (Figura 7).
Importante: Não manipule o mecanismo da agulha de segurança antes da administração. Se a agulha parecer estar danificada ou tiver fugas, o produto NÃO se deve usar. A agulha danificada NÃO se deve repor e o medicamento NÃO deve ser injetado. Em caso de danos na agulha, utilize outro kit de ELIGARD.
Figura 7 |
|
Passo 8
Antes da administração, purgue qualquer bolha grande de ar da seringa B. Administre o medicamento por via subcutânea enquanto mantém a cobertura de segurança afastada da agulha.
Procedimento de administração:
- Selecione um local de injeção no abdômen, na parte superior das nádegas ou em outro local com quantidades adequadas de tecido subcutâneo que não tenha excesso de pigmento, nódulos, lesões ou pelo e que não tenha sido utilizado recentemente.
- Limpe a área do local da injeção com uma toalhita com álcool (não incluída).
- Usando o polegar e o índice, puxe e junte a área de pele ao redor do local da injeção.
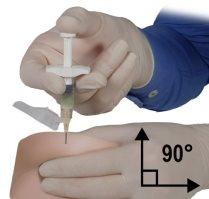
- Usando sua mão dominante, insira a agulha rapidamente em um ângulo de 90° com respeito à superfície da pele. A profundidade de penetração dependerá da quantidade e amplitude do tecido subcutâneo e da longitude da agulha. Após inserir a agulha, solte a pele.
- Injete o medicamento empurrando de maneira lenta e constante e pressione o êmbolo até que a seringa esteja vazia. Assegure-se de injetar a quantidade total do medicamento da seringa B antes de retirar a agulha.
- Retire a agulha rapidamente no mesmo ângulo de 90° utilizado para a inserção enquanto mantém a pressão sobre o êmbolo.
Figura 8

Passo 9
Após a injeção, bloqueie o mecanismo de segurança usando qualquer um dos métodos de ativação mencionados abaixo.
- Fechamento sobre uma superfície plana
Pressione a cobertura de segurança com o deslizador para baixo, contra uma superfície plana (Figura 9a) para cobrir a agulha e bloquear a cobertura.
Verifique a posição de bloqueio mediante um “click” audível e táctil. A posição de bloqueio cobrirá completamente a ponta da agulha.
- Fechamento com o polegar
Colocando seu polegar sobre a cobertura de segurança (Figura 9b), cubra a ponta da agulha e bloqueie a cobertura.
Verifique a posição de bloqueio mediante um “click” audível e táctil. A posição de bloqueio cobrirá completamente a ponta da agulha.
Figura 9a Fechamento sobre uma superfície plana | Figura 9b Fechamento com o polegar |
|
Uma vez bloqueada a cobertura de segurança, descarte imediatamente a agulha e a seringa em um contenedor autorizado para objetos pontiagudos.

Quanto custa o ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Espanha em 2025?
O preço médio do ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em dezembro de 2025 é de cerca de 301.02 EUR. Os valores podem variar consoante a região, a farmácia e a necessidade de receita. Confirme sempre com uma farmácia local ou fonte online para obter informações atualizadas.
- País de registo
- Preço médio em farmácia301.02 EUR
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 42 mgSubstância ativa: leuprorelinFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 45 mgSubstância ativa: leuprorelinRequer receita médicaForma farmacêutica: IMPLANTE, 5 mgSubstância ativa: leuprorelinFabricante: Sandoz Farmaceutica S.A.Requer receita médica
Alternativas a ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Polónia
Alternativa a ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de ELIGARD TRIMESTRAL 22,5 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.