
Reseligo

Pergunte a um médico sobre a prescrição de Reseligo

Como usar Reseligo
Folheto informativo para o doente
Reseligo, 10,8 mg, implante em seringa pré-cheia
Goserelina
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto, para que possa relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é Reseligo e para que é utilizado
- 2. Informações importantes antes de tomar Reseligo
- 3. Como tomar Reseligo
- 4. Efeitos não desejados
- 5. Como conservar Reseligo
- 6. Conteúdo da embalagem e outras informações
1. O que é Reseligo e para que é utilizado
Reseligo contém o princípio ativo goserelina. Pertence a um grupo de medicamentos chamados análogos de LHRH.
Reseligo é utilizado no tratamento do cancro da próstata em homens.
O efeito do medicamento consiste em reduzir a quantidade de testosterona - um hormona produzido pelo organismo do doente.
Reseligo 10,8 mg implante em seringa pré-cheia é uma forma de libertação prolongada, administrada a cada 12 semanas de Reseligo 3,6 mg.
2. Informações importantes antes de tomar Reseligo
Quando não tomar Reseligo:
- se o doente for alérgico à goserelina ou a qualquer outro componente deste medicamento (indicado no ponto 6);
- em mulheres.
Não deve tomar Reseligo se ocorrer alguma das situações acima mencionadas.
Em caso de dúvida antes de tomar Reseligo, deve consultar o médico, farmacêutico ou enfermeiro.
Precauções e advertências
Antes de iniciar o tratamento com Reseligo, deve consultar o médico, farmacêutico ou enfermeiro:
- se o doente tiver dificuldades em urinar ou dores nas costas;
- se o doente for diabético;
- se o doente tiver hipertensão arterial;
- se ocorrerem condições que possam enfraquecer os ossos, especialmente se o doente beber grandes quantidades de álcool, fumar, se houver história familiar de osteoporose (doença que enfraquece os ossos) ou se o doente estiver a tomar medicamentos antiepilépticos (medicamentos utilizados no tratamento de epilepsia ou convulsões), ou corticosteroides (esteroides);
- se o doente tiver doenças cardíacas ou vasculares, incluindo distúrbios do ritmo cardíaco (arritmia), ou se o doente estiver a tomar medicamentos para essas doenças. Durante o tratamento com Reseligo, pode aumentar o risco de distúrbios do ritmo cardíaco.
Foram relatados casos de depressão durante o tratamento com Reseligo, incluindo depressão grave. Se durante o tratamento com Reseligo o doente apresentar um estado de espírito deprimido, deve informar o médico.
Medicamentos deste tipo podem causar uma redução da quantidade de cálcio nos ossos (enfraquecimento dos ossos).
Em caso de hospitalização, deve informar o pessoal médico sobre o tratamento com Reseligo.
Crianças
Reseligo não deve ser utilizado em crianças.
Reseligo e outros medicamentos
Deve informar o médico, farmacêutico ou enfermeiro sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar, incluindo medicamentos disponíveis sem receita médica ou medicamentos à base de plantas.
Reseligo pode afetar a ação de alguns medicamentos utilizados no tratamento de distúrbios do ritmo cardíaco (como quinidina, procaína, amiodarona ou sotalol) ou aumentar o risco de distúrbios do ritmo cardíaco, no caso de administração concomitante de alguns outros medicamentos (por exemplo, metadona (medicamento utilizado no tratamento da dor ou no programa de desintoxicação para pessoas viciadas em narcóticos), moxifloxacina (antibiótico) ou medicamentos antipsicóticos, utilizados no tratamento de distúrbios psiquiátricos graves).
Condução de veículos e utilização de máquinas
É pouco provável que Reseligo afete a capacidade de conduzir veículos e operar máquinas.
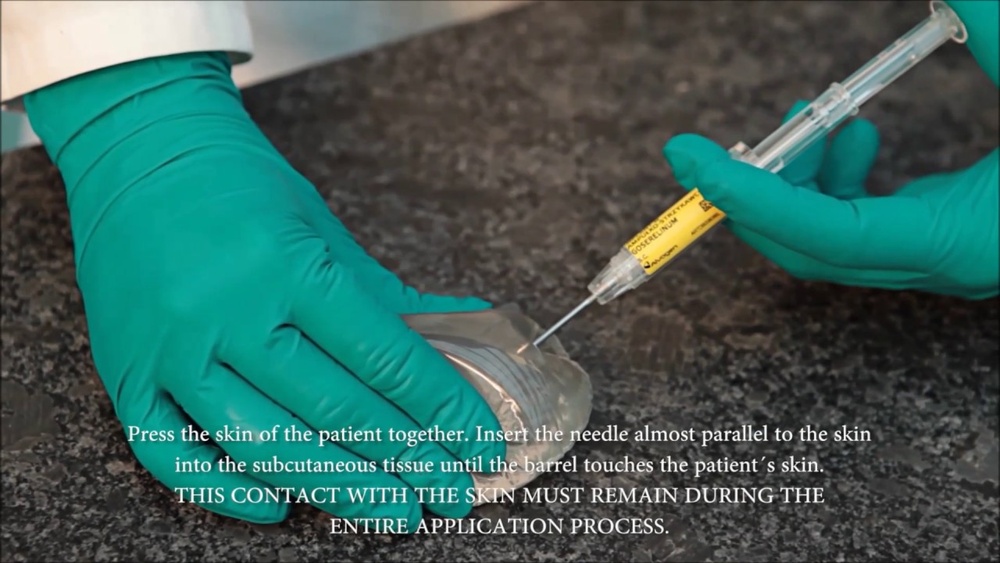
3. Como tomar Reseligo
Reseligo 10,8 mg implante será injetado sob a pele do abdômen, a cada doze semanas.
A injeção será realizada por um médico ou enfermeiro.
É importante continuar o tratamento com Reseligo, mesmo que o doente sinta uma melhoria no seu estado de saúde.
- Deve continuar o tratamento até que o médico decida que pode ser interrompido.
Próxima consulta:
- Reseligo deve ser administrado por injeção a cada 12 semanas.
- Deve sempre lembrar ao médico ou enfermeiro para marcar uma consulta para receber a próxima injeção.
- Se a data da consulta agendada for anterior ou posterior a 12 semanas após a última injeção, deve informar o médico ou enfermeiro.
- Se mais de 12 semanas se passarem após a última injeção, deve contactar o médico ou enfermeiro para receber a próxima injeção o mais breve possível.
4. Efeitos não desejados
Como qualquer medicamento, Reseligo pode causar efeitos não desejados, embora não ocorram em todos os doentes.
Reações alérgicas
Esses efeitos ocorrem raramente. Os seguintes sintomas podem ocorrer subitamente:
- erupções cutâneas, coceira ou urticária
- inchaço do rosto, lábios ou língua ou outras partes do corpo
- dificuldade respiratória, respiração sibilante ou dificuldade em respirar. Se ocorrer algum desses sintomas, deve procurar imediatamente um médico.
Lesões no local da injeção (incluindo lesões vasculares na cavidade abdominal) após a injeção de goserelina, em casos muito raros, podem levar a hemorragias graves.
Deve contactar imediatamente um médicose ocorrer algum dos seguintes sintomas:
- dor abdominal
- inchaço abdominal
- dificuldade respiratória
- tontura
- diminuição da pressão arterial e (ou) alterações da consciência
Outros efeitos não desejados possíveis:
Muito frequentes (podem afetar mais de 1 em 10 doentes)
- ondas de calor e suor. Raramente, esse efeito não desejado pode ocorrer por um período prolongado (até vários meses) após a interrupção do tratamento com goserelina).
- diminuição da libido e impotência
Frequentes (podem afetar 1 em 10 doentes)
- dor na parte inferior das costas ou dificuldade em urinar. Se ocorrerem esses sintomas, deve consultar um médico.
- dor óssea no início do tratamento. Se ocorrerem esses sintomas, deve consultar um médico.
- perda de massa óssea
- aumento do nível de açúcar no sangue
- formigamento nos dedos das mãos e dos pés
- erupções cutâneas
- aumento de peso
- dor, hematoma, sangramento, vermelhidão ou inchaço no local da injeção de goserelina
- diminuição da função cardíaca ou ataque cardíaco
- alterações da pressão arterial
- inchaço e dor nas mamas
- alterações do humor (incluindo depressão)
Pouco frequentes (podem afetar 1 em 100 doentes)
- dor nas articulações
Muito raros (podem afetar mais de 1 em 10.000 doentes)
- distúrbios psiquiátricos, incluindo alucinações (ver, ouvir ou sentir coisas que não existem), distúrbios do pensamento e alterações da personalidade. Esses sintomas ocorrem muito raramente.
- aparecimento de um tumor da hipófise ou, se o doente já tiver um tumor da hipófise: a goserelina pode causar sangramento no tumor ou colapso. Esses efeitos ocorrem muito raramente. Tumores da hipófise podem causar dores de cabeça fortes, náuseas ou vômitos, perda de visão e perda de consciência
Frequência desconhecida (não pode ser estimada a partir dos dados disponíveis)
- perda de cabelo
- alterações nos exames de sangue
- distúrbios do fígado
- embolia pulmonar, causando dor no peito ou dificuldade respiratória
- pneumonia. Os sintomas podem ser típicos de pneumonia (como dificuldade respiratória e tosse).
- alterações no eletrocardiograma (prolongamento do intervalo QT)
A lista de efeitos não desejados apresentada não deve ser motivo de preocupação excessiva.
É possível que nenhum deles ocorra.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos do Instituto Nacional de Farmácia e Medicamentos
Rua: Alameda, n.º 181C, 1022-222 Lisboa
Telefone: +351 21 798 73 00
Fax: +351 21 798 73 01
Sítio da Internet: https://www.infarmed.pt/
Os efeitos não desejados também podem ser notificados ao titular da autorização de introdução no mercado.
A notificação de efeitos não desejados pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar Reseligo
- O medicamento pode ser prescrito ao doente por um médico. Deve retirar o medicamento na farmácia e levá-lo para a próxima consulta.
- Deve conservar o medicamento em local seguro e inacessível às crianças.
- Não deve tomar o medicamento após o prazo de validade impresso na caixa e no sachê após "VALIDO ATÉ". O prazo de validade é o último dia do mês indicado.
- Não deve conservar o medicamento a uma temperatura superior a 30°C.
- Deve conservar o medicamento na embalagem original para protegê-lo da humidade. Não deve abrir a embalagem de folha de alumínio.
- Não deve deitar os medicamentos no esgoto ou nos contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa. Essa ação ajudará a proteger o ambiente
6. Conteúdo da embalagem e outras informações
O que contém Reseligo
- O princípio ativo de Reseligo é a goserelina. Um implante contém 10,8 mg de goserelina (na forma de octanoato de goserelina).
- Os outros componentes são polímero de DL-lactida e copolímero de DL-lactida e glicolida (75:25).
Como é Reseligo e que conteúdo tem a embalagem
Paletas cilíndricas brancas ou quase brancas (dimensões aproximadas: diâmetro 1,5 mm, comprimento 13 mm, massa 44 mg) incorporadas em uma matriz polimérica biodegradável.
A seringa aplicadora de dose única é composta por três partes principais: corpo com câmara do implante, mandril e agulha. A aplicadora, juntamente com o sachê de absorção de humidade, é colocada em um sachê que consiste em três camadas laminadas (da parte externa): folha de PETP, camada de alumínio, folha de PE. Os sachês são colocados em uma caixa de cartão.
Reseligo está disponível em caixas de cartão que contêm 1 ou 3 sachês com o implante em seringa pré-cheia.
Nem todos os tamanhos de embalagem podem estar disponíveis no mercado.
Titular da autorização de introdução no mercado e fabricante
Titular da autorização de introdução no mercado:
Zentiva, k.s.
U kabelovny 130
Dolní Měcholupy
102 37 Praga 10
República Checa
Fabricante:
AMW GmbH Arzneimittelwerk Warngau
Birkerfeld 11, Warngau
83627
Alemanha
Para obter informações mais detalhadas sobre o medicamento e seus nomes nos países membros da Área Económica Europeia, deve contactar o representante do titular da autorização de introdução no mercado em Portugal:
Zentiva - Farmacêuticos, S.A.
Rua da Cidade de Córdova, n.º 2
1200-781 Lisboa
Telefone: +351 21 412 62 00
Data da última revisão do folheto:
(logótipo do titular da autorização de introdução no mercado)
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorAMW GmbH Arzneimittelwerk Warngau
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ReseligoForma farmacêutica: Implante, 10.8 mgSubstância ativa: goserelinFabricante: AMW GmbH Arzneimittelwerk Warngau Merckle GmbHRequer receita médica
Alternativas a Reseligo noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Reseligo em Ukraine
Alternativa a Reseligo em Espanha
Médicos online para Reseligo
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Reseligo – sujeita a avaliação médica e regras locais.











