
SUPREFACT DEPOT 9,45 mg IMPLANTE

Pergunte a um médico sobre a prescrição de SUPREFACT DEPOT 9,45 mg IMPLANTE

Como usar SUPREFACT DEPOT 9,45 mg IMPLANTE
Introdução
Prospecto: informação para o utilizador
Suprefact Depot 9,45 mg implante
Buserelina
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo. Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Suprefact Depot e para que é utilizado
- O que precisa saber antes de começar a usar Suprefact Depot
- Como usar Suprefact Depot
- Possíveis efeitos adversos
- Conservação de Suprefact Depot
- Conteúdo do envase e informação adicional
1. O que é Suprefact Depot e para que é utilizado
O que é Suprefact Depot
Suprefact Depot contém um princípio ativo denominado buserelina. A buserelina é semelhante a uma hormona que se produz de forma natural no cérebro. Pertence a um grupo de medicamentos denominado “análogos de hormonas liberadoras de gonadotropinas” (análogos LHRH).
Como actua Suprefact Depot
Actua diminuindo a quantidade de hormonas que estimulam o crescimento do tumor de próstata. A próstata é uma glândula que se encontra debaixo da bexiga em homens.
Para que é utilizado Suprefact Depot
Suprefact Depot é utilizado para o tratamento do cancro de próstata avançado.
2. O que precisa saber antes de começar a usar Suprefact Depot
Não use Suprefact Depot:
- se é alérgico à buserelina, a outros análogos LHRH (por exemplo leuprolida, goserelina, triptorelina) ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Os sintomas de uma reação alérgica poderiam ser: erupção na pele, problemas para engolir ou respirar, inchação nos lábios, cara, garganta ou língua.
Não tome este medicamento se lhe ocorrer algo do anteriormente mencionado. Se não tiver certeza, antes de começar o tratamento com Suprefact Depot, pergunte ao seu médico ou farmacêutico.
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de começar a usar Suprefact Depot se:
- lhe foram extirpados os testículos
- padece cancro e este está espalhado (cancro metastático). No início, é importante para si usar outro medicamento para diminuir os níveis de certas hormonas. No entanto, isto pode causar dor tumoral; se isto acontecer, pergunte ao seu médico ou farmacêutico
- tem dificuldades para urinar
- tem factores de risco para doença cardiovascular ou diabetes
- padece alguma afecção do coração ou dos vasos sanguíneos ou está sendo tratado para isso, incluindo medicamentos para controlar o ritmo cardíaco (arritmias). O risco de problemas do ritmo cardíaco pode aumentar quando se utiliza Suprefact Depot
- padece diabetes. Controle de forma habitual os seus níveis de açúcar no sangue. Isto deve-se a que Suprefact Depot afeta o metabolismo e, por conseguinte, os seus níveis de açúcar no sangue
- tem a tensão arterial alta. O seu médico ou enfermeira deve controlar de forma habitual a tensão arterial. Isto deve-se a que Suprefact Depot afeta a tensão arterial
- ja sofreu alguma vez uma depressão. Deve controlar detidamente o seu estado mental porque existe risco de que a depressão pudesse aparecer de novo ou piorar
- ja diminuiu o número de glóbulos vermelhos ou sente um aumento do cansaço (anemia).
Se não tiver certeza se algo do anteriormente mencionado o afeta, consulte o seu médico ou farmacêutico antes de usar Suprefact Depot.
O seu médico controlará a densidade dos seus ossos e poderá prescrever-lhe o tratamento apropriado. Isto deve-se a que o uso dos análogos LHRH pode causar uma diminuição na densidade dos ossos, osteoporose (debilitamento dos ossos) e um aumento do risco de fracturas de osso, especialmente se tiver factores de risco tais como alcoolismo crónico, tabagismo, ou se na sua família houve mais pessoas com osteoporose, ou se leva muito tempo em tratamento com medicamentos anticonvulsivantes ou corticosteroides.
Foram notificadas depressões em pacientes que usam Suprefact Depot, que poderiam ser graves. Se estiver a usar Suprefact Depot e desenvolver um estado de ânimo depressivo, informe o seu médico.
Outros medicamentos Suprefact Depot
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou poderá ter que utilizar qualquer outro medicamento. Isto inclui os comprados sem receita médica e as ervas medicinais. Isto deve-se a que Suprefact Depot pode afetar a forma como estes medicamentos actuem. Outros medicamentos também podem afetar a forma como Suprefact Depot actua.
Em particular, consulte o seu médico:
- se está a tomar medicamentos para a diabetes. Isto deve-se a que Suprefact Depot pode afetar a forma como estes medicamentos actuem, o que pode levar a um agravamento da diabetes.
- se está a utilizar medicamentos usados para tratar problemas do ritmo do coração (por exemplo: quinidina, procainamida, amiodarona e sotalol). Isto é porque Suprefact Depot pode interferir com estes medicamentos.
- se está a utilizar outros medicamentos (por exemplo: metadona (utilizada para o alívio da dor e para a desintoxicação de outros medicamentos), moxifloxacino (um antibiótico), antipsicóticos (usados para doenças mentais graves). Isto é porque Suprefact Depot pode aumentar o risco de problemas do ritmo cardíaco quando se utiliza com estes medicamentos.
Gravidez, lactação e fertilidade
Suprefact Depot é um medicamento que apenas deve ser utilizado por homens. Não deve ser utilizado por mulheres.
Condução e uso de máquinas
Depois de tomar este medicamento, poderá sofrer algum efeito adverso. Alguns destes efeitos adversos (como por exemplo tontura) podem afetar a capacidade para concentrar-se e o seu tempo de reação. Se isto acontecer, tenha cuidado durante a condução, utilização de ferramentas ou máquinas, ou durante qualquer trabalho que requeira um nível alto de atenção.
3. Como usar Suprefact Depot
O conteúdo de uma seringa pré-carregada (que contém 3 implantes cilíndricos com uma dose final de 9,45 mg de buserelina) é injetado sob a pele (subcutâneo) na área do estômago, cada 3 meses. Este tempo pode ser aumentado até 3 semanas mais.
Deve desinfectar a zona da injeção. Normalmente, a injeção deve ser administrada por um médico ou enfermeira. Antes do uso, o implante deve estar à temperatura ambiente. Poderá aplicar-se um anestésico para aliviar a dor da injeção do implante. Siga as instruções do seu médico sobre quando deve usar Suprefact Depot e o tempo que tem que transcorrer entre cada injeção.
Análise de sangue
- O seu médico far-lhe-á análises de sangue para comprovar se este medicamento está a funcionar bem.
Se usar mais Suprefact Depot do que deve
É pouco provável que o seu médico ou enfermeira lhe administre mais medicamento do que devia. Se usar mais quantidade do que devia, poderá sentir fraqueza, nervosismo, tontura ou náuseas. Também poderá sentir dor de cabeça, sofocos, dor de estômago, inchação (edema) nos tornozelos e nas pernas, aumento das mamas, ou reações no local onde lhe foi injetado este medicamento.
O seu médico dar-lhe-á o tratamento adequado para estes efeitos adversos.
Em caso de sobredosagem, consulte o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone: 91 562 04 20, indicando o medicamento e a quantidade utilizada.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeira.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Se sofrer algum dos efeitos adversos, é importante que informe o seu médico antes do próximo tratamento com Suprefact Depot.
Se experimentar alguma reação alérgica grave, como falta de ar ou choque, por favor contacte imediatamente o seu médico, pois poderá ser necessário remover o implante.
Efeitos adversos que poderiam ocorrer no início do seu tratamento
No início do seu tratamento, poderá aumentar a quantidade de hormonas sexuais que o seu corpo produz e poderá notar um agravamento temporário dos sintomas. Por exemplo, poderá sofrer dor nos ossos, fraqueza muscular nas pernas, problemas para urinar, retenção de líquidos ou problemas de coagulação nos pulmões. Para prevenir isto, geralmente são administrados outros medicamentos, como por exemplo acetato de ciproterona. O tratamento com ciproterona deve continuar durante 3-4 semanas após receber Suprefact Depot. Depois deste tempo, os níveis de testosterona geralmente diminuem até os valores desejados em resposta a Suprefact Depot.
Informa o seu médico ou farmacêutico se algum dos seguintes efeitos adversos for grave ou durar mais de alguns dias:
Frequentes (podem afetar até 1 de cada 10 pacientes)
- Perda do apetite sexual (libido)
- Dificuldade na ereção
- Dor de cabeça
- Sofocos
- Diminuição do tamanho dos testículos (denominado atrofia testicular)
- Dor ou outras reações no local de injeção (tais como vermelhidão ou inchação)
- Mudanças de humor, depressão (tratamento a longo prazo).
Pouco frequentes (podem afetar até 1 de cada 100 pacientes)
- Reações alérgicas como erupções na pele que poderiam ser de cor vermelha e picar (incluindo urticária)
- Sensação de sono e cansaço
- Sensação de tontura
- Prisão de ventre
- Aumento das mamas
- Acúmulo de líquido (edema) ao redor dos tornozelos e pernas
- Aumento das enzimas produzidas no fígado que se manifesta nos resultados de alguns exames de sangue
- Mudanças no peso
- Mudanças de humor, depressão (tratamento a curto prazo).
Raros (podem afetar até 1 de cada 1000 pacientes)
- Reações alérgicas graves como por exemplo falta de ar
- Sensação de nervosismo, estresse, e instabilidade emocional. Além disso, dificuldade para dormir e problemas de memória ou concentração
- Latidos cardíacos rápidos ou irregulares (palpitaciones), aumento da tensão arterial em pessoas que a têm de por si alta (hipertensão)
- Sensação de tontura (náuseas e vómitos) ou diarreia
- Aumento ou diminuição do cabelo e do pelo corporal
- Mudanças nos lípidos do sangue e aumento da bilirrubina que se manifesta nos resultados de alguns exames de sangue.
Muito raros (podem afetar até 1 de cada 10.000 pacientes)
- Reações alérgicas graves com choque
- Aumento da sede, mudanças no apetite, diminuição dos níveis de tolerância à glicose (em pacientes diabéticos poderá produzir-se uma perda do controlo diabético)
- Zumbidos nos ouvidos (tinnitus) e distúrbios auditivos
- Alterações da visão como visão borrosa e sensação de pressão no olho
- Molestias ou dor em músculos e ossos
- Declínio do bem-estar geral
- Diminuição do número de células do sangue que poderia provocar anomalias nos resultados dos exames de sangue e/ou hematomas (marcas negras)
- Aumento do tamanho de tumores “benignos” na glândula pituitária ou aumento temporário da dor tumoral.
Frequência não conhecida (não pode ser estimada a partir dos dados disponíveis)
- Mudanças no electrocardiograma ECG (prolongamento do intervalo QT).
Com outras apresentações que contêm buserelina também se observou sensações anómalas na pele como por exemplo formigação.
Este grupo de medicamentos (denominados análogos LHRH) pode provocar uma diminuição da densidade do osso, osteoporose e um aumento do risco de fracturas de osso. A possibilidade de fractura de osso aumenta ao longo do tratamento. Os análogos LHRH podem aumentar o risco de doença cardiovascular (como ataque ao coração e acidente vascular cerebral), diabetes ou anemia (diminuição no número de glóbulos vermelhos que provoca que se sinta cansado).
Comunicação de efeitos adversos:
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Suprefact Depot
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no envase após CAD. A data de validade é o último dia do mês que se indica.
Conservar na geladeira (entre 2°C e 8°C). Pode conservar-se a uma temperatura máxima de 25 °C durante um máximo de 7 dias.
Os medicamentos não devem ser jogados fora pelas águas residuais ou pelo lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Suprefact Depot
O princípio ativo de Suprefact Depot é buserelina. Cada seringa está pré-carregada com 1 implante composto por 3 cilindros, com uma dose final de 9,9 de acetato de buserelina. Isto equivale a 9,45 mg de buserelina.
O outro componente é Poli (D, L-láctico-co-glicólido) com uma proporção de 75:25 de láctico-glicólido.
Aspecto do produto e conteúdo do envase
Um envase contém 1 ou 2 seringas estéreis pré-carregadas.
Cada seringa contém 3 implantes cilíndricos de cor creme.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização
CHEPLAPHARM Arzneimittel GmbH
Ziegelhof 24
17489 Greifswald
Alemanha
Responsável pela fabricação
Sanofi Aventis Deutschland GmbH
Brüningstraße 50 – Frankfurt am Main
65926 Alemanha
Representante Local
Laboratorios Rubió, S.A.
Indústria, 29
Pol. Ind. Comte de Sert
08755 Castellbisbal (Barcelona)
Espanha
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Alemanha : Suprefact Depot - Implantat Für 3 Monate
Bélgica: Suprefact Depot 9.45 mg Implant
Dinamarca: Suprefact Depot
Finlândia: Suprefact Depot 9.45 mg implantaatti
França: Trigonist 9.45 mg implant pour voie sous-cutanée
Alemanha: Profact Depot 9,45 mg 3-Monatsimplantat
Itália: Suprefact depot 3 Mesi
Luxemburgo: Suprefact Depot 9.45 mg Implant
Países Baixos: Suprefact Depot 3 Maanden, implantatiestift 9.45 mg
Portugal: Suprefact Depot 3 Meses
Suécia: Suprefact Depot 9.45 mg implantat
Reino Unido: Suprefact Depot 9.45 mg implant, for subcutaneous route
Data da última revisão deste prospecto:Junho 2015
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
Esta informação está destinada apenas a profissionais do sector sanitário.
1Nome do Medicamento
Suprefact Depot 9,45 mg implante, por via subcutânea
2POSOLOGIA E FORMA DE ADMINISTRAÇÃO
Uma seringa pré-carregada com 1 implante contém 3 cilindros, que são injetados sob a pele do abdômen a cada três meses. É importante manter o ritmo de administração a cada três meses de forma regular, no entanto, o intervalo de injeção poderia ocasionalmente prolongar-se até 3 semanas. Antes da injeção, pode ser administrado um anestésico local.
Antes do seu uso, o implante deve estar à temperatura ambiente.
Aviso. Para evitar a queda dos 3 cilindros do implante da agulha de injeção (A), manter o aplicador em posição vertical até imediatamente antes da punção, com a agulha apontando para cima.
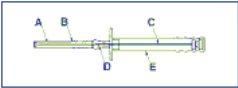
A: Agulha
B: Capuchão protetor da agulha
C: Embolo
D: Implante
E: Funda protetora do êmbolo
- Depois de abrir o estojo e retirar o aplicador do seu envase, verificar se os 3 cilindros do implante estão situados na janela do aplicador. Se necessário, bater levemente com o dedo no capuchão protetor da seringa para recolocá-los na janela. Uma vez aberto o envase, o aplicador deve ser utilizado imediatamente.
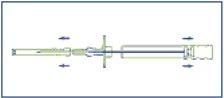
- Desinfetar a zona da injeção situada em um lado da parede abdominal. Primeiro, retirar a funda protetora do êmbolo (E) e, em seguida, retirar o capuchão protetor da agulha de injeção (B).

- Pegar um dobra da pele e inserir a agulha aproximadamente 3 cm (algo mais de uma polegada) no tecido subcutâneo. Manter o aplicador em posição horizontal no momento antes da punção ou com a ponta da agulha ligeiramente orientada para cima. Retirar o aplicador 1-2 cm aproximadamente antes da injeção dos cilindros.
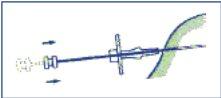
- Injetar os três cilindros do implante no tecido subcutâneo empurrando completamente o êmbolo. Comprimir o canal de punção enquanto se retira a agulha de forma que os 3 cilindros do implante fiquem retidos no tecido.

- Para garantir que os três cilindros do implante tenham sido injetados, verificar se o extremo do êmbolo é visível no extremo da agulha.
Recomenda-se a administração de um antiandrógeno 5 dias antes do início do tratamento com Suprefact Depot.
3DADOS FARMACÊUTICOS
3.1Lista de excipientes
Poli (D, L-lactídeo-co-glicólido)
3.2Incompatibilidades
Não se aplica, pois o produto é apresentado em um aplicador especial.
3.3Período de validade
3 anos.
3.4Precauções especiais de conservação
Conservar em geladeira (entre 2°C e 8°C). Pode ser conservado a uma temperatura máxima de 25°C durante um máximo de 7 dias.
3.5Natureza e conteúdo do envase
Seringa pré-carregada com um implante cilíndrico composto por três cilindros, acomodados em um aplicador descartável de propionato de celulosa e aço inoxidável precintado em uma bolsa de lâmina composta de polietileno tereftalato, alumínio e polietileno de baixa densidade.
Apresentações: 1 ou 2 seringas pré-carregadas por envase.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/

Quanto custa o SUPREFACT DEPOT 9,45 mg IMPLANTE em Espanha em 2025?
O preço médio do SUPREFACT DEPOT 9,45 mg IMPLANTE em dezembro de 2025 é de cerca de 341.13 EUR. Os valores podem variar consoante a região, a farmácia e a necessidade de receita. Confirme sempre com uma farmácia local ou fonte online para obter informações atualizadas.
- País de registo
- Preço médio em farmácia341.13 EUR
- Disponibilidade em farmáciasProblema de disponibilidade reportado
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a SUPREFACT DEPOT 9,45 mg IMPLANTEForma farmacêutica: INJETÁVEL, 1 mg/mlSubstância ativa: buserelinFabricante: Cheplapharm Arzneimittel GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 42 mgSubstância ativa: leuprorelinFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: INJETÁVEL, 0,1 mgSubstância ativa: triptorelinFabricante: Ipsen Pharma S.A.Requer receita médica
Médicos online para SUPREFACT DEPOT 9,45 mg IMPLANTE
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de SUPREFACT DEPOT 9,45 mg IMPLANTE – sujeita a avaliação médica e regras locais.











