Como usar Paclitaxel Kabi
Folheto informativo: informação para o utilizador
Paclitaxel Kabi, 6 mg/ml, concentração para solução para infusão
Paclitaxel
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
Deve guardar este folheto, para que possa lê-lo novamente se necessário.
Se tiver alguma dúvida, deve consultar o seu médico ou enfermeiro.
Se o paciente apresentar algum efeito indesejado, incluindo quaisquer efeitos indesejados não mencionados neste folheto, deve informar o seu médico ou enfermeiro.
Ver ponto 4.
Índice do folheto
- 1. O que é Paclitaxel Kabi e para que é utilizado
- 2. Informações importantes antes de tomar Paclitaxel Kabi
- 3. Como tomar Paclitaxel Kabi
- 4. Efeitos indesejados
- 5. Como armazenar Paclitaxel Kabi
- 6. Conteúdo da embalagem e outras informações
1. O que é Paclitaxel Kabi e para que é utilizado
Paclitaxel Kabi pertence a um grupo de medicamentos antineoplásicos conhecidos como "táxanos". Estes medicamentos impedem o crescimento das células cancerígenas.
Paclitaxel Kabi é utilizado no tratamento de vários tipos de cancro:
Cancro do ovário:
como medicamento de primeira linha (após uma operação, em combinação com um medicamento que contenha platina, cisplatina);
quando outros métodos de tratamento com medicamentos tradicionais que contenham platina falharam.
Cancro da mama:
como medicamento de primeira linha no tratamento de doença avançada ou metastática (que se espalhou para outras partes do corpo). Paclitaxel Kabi é utilizado em combinação com antraciclina (por exemplo, doxorrubicina) ou trastuzumabe (em pacientes que não podem receber tratamento com antraciclina e que têm proteínas de receptor HER-2 na superfície das células cancerígenas, ver folheto do paciente para trastuzumabe);
como terapia adjuvante após tratamento com antraciclina e ciclofosfamida (AC);
como medicamento de segunda linha no tratamento de pacientes que não responderam ao tratamento padrão com antraciclina ou em pacientes que não podem receber tratamento com antraciclina.
Cancro pulmonar de não-pequenas células avançado:
no tratamento combinado com cisplatina em pacientes que não são candidatos a cirurgia e/ou radioterapia.
Sarcoma de Kaposi em pacientes com AIDS:
em pacientes que não responderam a outros tratamentos (por exemplo, antraciclina lipossomal).
2. Informações importantes antes de tomar Paclitaxel Kabi
Quando não tomar Paclitaxel Kabi:
se o paciente tiver alergia ao paclitaxel ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6), especialmente ao macrogol glicerol ricinoleato (óleo de rícino polioxietilado);
durante a amamentação;
em pacientes com contagem de glóbulos brancos reduzida (contagem de granulócitos neutrofílicos <1,5 x 10^9/l ou <1,0 x 10^9/l em pacientes com sarcoma de Kaposi – o médico deve realizar um exame de sangue para verificar se o paciente tem glóbulos brancos suficientes). O medicamento não deve ser utilizado em pacientes com infecção grave e não controlada, exclusivamente em pacientes que recebem Paclitaxel Kabi para tratar sarcoma de Kaposi.
Se o paciente tiver alguma das condições acima, deve informar o seu médico antes de iniciar o tratamento com Paclitaxel Kabi.
Não se recomenda a utilização de Paclitaxel Kabi em crianças (menores de 18 anos).
Precauções e advertências
Antes de iniciar o tratamento com Paclitaxel Kabi, o paciente deve discutir com o seu médico.
Para minimizar reações alérgicas, antes de receber Paclitaxel Kabi, o paciente receberá outros medicamentos.
Se o paciente apresentar reações alérgicas (como dificuldade em respirar, sensação de sufocamento, pressão no peito, queda da pressão arterial, tontura, sensação de vazio na cabeça, reações cutâneas com erupções ou inchaço).
Se o paciente apresentar febre, calafrios fortes, dor de garganta ou úlceras na boca (sintomas de supressão da medula óssea).
Se o paciente apresentar formigamento, fraqueza ou dor nas mãos e pés (sintomas de neuropatia periférica), pode ser necessário reduzir a dose de Paclitaxel Kabi.
Se o paciente tiver doença hepática grave, não se recomenda a utilização de Paclitaxel Kabi.
Se o paciente tiver distúrbios do ritmo cardíaco.
Se o paciente apresentar diarreia grave ou persistente, com febre e dor abdominal; a causa pode ser colite pseudomembranosa.
Se o paciente foi submetido a radioterapia no peito (pois isso pode aumentar o risco de pneumonite).
Se o paciente apresentar dor ou vermelhidão na boca (sintomas de estomatite) e estiver sendo tratado para sarcoma de Kaposi, pode ser necessário reduzir a dose.
Devido ao risco de extravasação, é recomendável uma vigilância rigorosa do local da infusão para detectar possíveis vazamentos durante a administração do medicamento.
Se qualquer um dos eventos acima ocorrer com o paciente, ele deve informar imediatamente o seu médico.
Paclitaxel Kabi deve ser administrado exclusivamente por via intravenosa. A administração do medicamento por via arterial pode causar inflamação das artérias, levando a dor, inchaço, vermelhidão e queimadura.
Paclitaxel Kabi e outros medicamentos
Se o paciente estiver tomando paclitaxel juntamente com qualquer um dos medicamentos abaixo, deve discutir com o seu médico:
medicamentos antibióticos (por exemplo, eritromicina, rifampicina; se o paciente não tiver certeza se o medicamento que está tomando é um antibiótico, deve perguntar ao seu médico, enfermeiro ou farmacêutico), incluindo medicamentos utilizados para tratar infecções fúngicas (por exemplo, cetoconazol);
medicamentos utilizados para estabilizar o humor, também conhecidos como medicamentos antidepressivos (por exemplo, fluoxetina);
medicamentos utilizados para tratar convulsões (por exemplo, carbamazepina, fenitoína);
medicamentos utilizados para reduzir a quantidade de gordura no sangue (por exemplo, gemfibrozil);
medicamentos utilizados para tratar azia ou úlceras estomacais (por exemplo, cimetidina);
medicamentos utilizados para tratar HIV e AIDS (por exemplo, ritonavir, saquinavir, indinavir, nelfinavir, efavirenz, nevirapina);
medicamento chamado clopidogrel, utilizado para prevenir a formação de coágulos sanguíneos.
A quantidade de álcool neste medicamento pode alterar a ação de outros medicamentos. Se o paciente estiver tomando outros medicamentos, deve consultar o seu médico ou farmacêutico.
Gravidez, amamentação e fertilidade Se a paciente estiver grávida ou suspeitar que possa estar grávida, deve informar o seu médico
antes de iniciar o tratamento com Paclitaxel Kabi. Se houver possibilidade de gravidez durante o tratamento, deve utilizar métodos anticoncepcionais eficazes e seguros. Não se recomenda a utilização de Paclitaxel Kabi durante a gravidez, a menos que seja absolutamente necessário.
Pacientes do sexo masculino e feminino em idade reprodutiva, bem como seus parceiros, devem utilizar métodos anticoncepcionais durante pelo menos 6 meses após o término do tratamento com paclitaxel. Os homens devem consultar um médico antes do tratamento sobre a possibilidade de armazenar esperma, devido ao risco de infertilidade irreversível.
Se a paciente estiver amamentando, deve informar o seu médico.Não se sabe se o paclitaxel passa para o leite materno. Devido ao potencial de efeitos prejudiciais no bebê, a amamentação deve ser interrompida durante o tratamento com Paclitaxel Kabi. A amamentação não deve ser retomada até que o médico o recomende.
Condução de veículos e operação de máquinas
Não há razão para que o paciente não possa conduzir veículos entre os ciclos de tratamento. No entanto, é importante lembrar que Paclitaxel Kabi contém uma quantidade de álcool e a condução de veículos logo após a administração do medicamento não é recomendada devido ao possível efeito no sistema nervoso central. Como em qualquer caso, não se deve conduzir veículos ou operar máquinas se ocorrer tontura ou sensação de vazio na cabeça.
A quantidade de álcool neste medicamento pode afetar a capacidade de conduzir veículos e operar máquinas, pois pode afetar a avaliação da situação e a velocidade de reação.
Paclitaxel Kabi contém macrogol glicerol ricinoleato e álcool
O medicamento contém macrogol glicerol ricinoleato, que pode causar reações alérgicas graves.
Deve informar o seu médico se tiver alergia a este componente do medicamento Paclitaxel Kabi.
Este medicamento contém 393 mg de álcool (etanol) por 1 ml, o que é equivalente a 39,3% v/v. A quantidade de álcool em uma dose de 52,5 ml deste medicamento é equivalente a 515,8 ml de cerveja ou 206,3 ml de vinho.
Se o paciente tiver epilepsia ou problemas hepáticos, deve consultar o seu médico ou farmacêutico antes de tomar o medicamento.
Se o paciente for dependente de álcool, deve consultar o seu médico ou farmacêutico antes de tomar este medicamento.
3. Como tomar Paclitaxel Kabi
Para minimizar reações alérgicas, antes de iniciar o tratamento com Paclitaxel Kabi, o paciente receberá outros medicamentos. Estes medicamentos podem ser administrados por via oral ou intravenosa, ou por ambas.
Paclitaxel Kabi é administrado por infusão intravenosa (em uma veia), através de um filtro fornecido no kit. Paclitaxel Kabi é administrado por pessoal médico qualificado.
O pessoal médico qualificado preparará a solução para infusão antes da administração. A dose do medicamento dependerá também dos resultados dos exames de sangue do paciente. Dependendo do tipo e gravidade do cancro, Paclitaxel Kabi é utilizado como monoterapia ou em combinação com outro medicamento antineoplásico.
Paclitaxel Kabi deve ser sempre administrado em uma veia durante 3 ou 24 horas. Geralmente, o medicamento é administrado a cada 2 ou 3 semanas, a menos que o médico prescreva de outra forma. O médico informará o paciente sobre o número de ciclos de tratamento com Paclitaxel Kabi que o paciente deve receber.
Se tiver alguma dúvida adicional sobre a utilização deste medicamento, deve consultar o seu médico ou farmacêutico.
4. Efeitos indesejados
Como qualquer medicamento, Paclitaxel Kabi pode causar efeitos indesejados, embora não ocorram em todos os pacientes.
Deve informar imediatamente o seu médico se ocorrerem quaisquer sintomas de reação
alérgica,incluindo um ou mais dos seguintes sintomas:
ondas de calor;
reações cutâneas;
coceira;
pressão no peito;
dificuldade em respirar ou falta de ar;
inchaço.
Todos estes sintomas podem ser indicativos de reações graves.
Deve informar imediatamente o seu médico se ocorrer:
febre, calafrios fortes, dor de garganta ou úlceras na boca(sintomas de supressão da medula óssea);
formigamento ou fraqueza nas mãos e pés(sintomas de neuropatia periférica);
diarreia grave ou persistente, com febre e dor abdominal.
Muito comum (pode ocorrer em mais de 1 em cada 10 pacientes):
reações alérgicas leves, como ondas de calor, erupções, coceira;
infecções: principalmente do trato respiratório superior e do trato urinário;
dor de garganta ou úlceras na boca, dor ou vermelhidão na boca, diarreia, mal-estar (náuseas, vômitos);
perda de cabelo (em maioria dos casos, a perda de cabelo começou antes de um mês após o início do tratamento com paclitaxel. Em maioria dos pacientes, houve perda significativa de cabelo (mais de 50%)).
dor muscular, cãibra, dor articular;
- formigamento, fraqueza ou dor nas mãos e pés (sintomas de neuropatia periférica); podem persistir por mais de 6 meses após o término do tratamento com paclitaxel;
- exames podem indicar: redução da contagem de plaquetas, o que pode levar a sangramentos e aumento do risco de hematomas, redução da contagem de glóbulos brancos ou vermelhos e pressão arterial baixa.
Comum (pode ocorrer em menos de 1 em cada 10 pacientes):
mudanças transitórias e leves nas unhas e distúrbios da pele, reações no local da injeção (inchaço, dor, vermelhidão da pele);
exames podem indicar: redução da frequência cardíaca, aumento significativo da atividade de enzimas hepáticos (fosfatase alcalina e aminotransferase aspartato).
Não muito comum (pode ocorrer em menos de 1 em cada 100 pacientes):
choque causado por infecção (conhecido como "choque séptico");
batimento cardíaco irregular, distúrbio da função cardíaca (bloqueio atrioventricular, cardiomiopatia), taquicardia, infarto do miocárdio, insuficiência respiratória;
fadiga, suor, desmaio, reações alérgicas graves, inflamação das veias, inchaço do rosto, lábios, boca, língua ou garganta;
dor nas costas, dor no peito, dor nas mãos e pés, calafrios, dor abdominal;
exames podem indicar: aumento significativo da bilirrubina (icterícia), pressão arterial alta, coágulo sanguíneo.
Raro (pode ocorrer em menos de 1 em cada 1.000 pacientes):
redução da contagem de glóbulos brancos com febre e aumento do risco de infecção (febre neutropênica);
doenças dos nervos, incluindo fraqueza muscular nos braços e pernas (neuropatia motora);
insuficiência cardíaca;
dificuldade em respirar, embolia pulmonar, fibrose pulmonar, doença pulmonar intersticial, falta de ar, derrame pleural;
obstrução intestinal, perfuração intestinal, colite isquêmica, pancreatite;
coceira, erupções, vermelhidão da pele (eritema);
infecção sanguínea (septicemia), peritonite, pneumonia;
febre, desidratação, fraqueza, inchaço e mal-estar;
reações alérgicas graves que podem ser fatais (reações anafiláticas);
exames podem indicar: aumento da creatinina no sangue, o que pode indicar distúrbios da função renal.
Muito raro (pode ocorrer em menos de 1 em cada 10.000 pacientes):
batimento cardíaco irregular e rápido (fibrilação atrial, taquicardia supraventricular);
distúrbios sanguíneos graves (leucemia aguda, síndrome mielodisplásica);
distúrbios do nervo óptico e/ou visão (escotomas cintilantes);
perda de audição ou distúrbios da audição (ototoxicidade), zumbido, tontura de origem vestibular;
tosse;
coágulo sanguíneo nos vasos sanguíneos do abdômen e intestinos (trombose da mesentéria), colite, sometimes com diarreia grave e persistente (colite pseudomembranosa, colite neutropênica), ascite, esofagite, constipação;
reações alérgicas graves, incluindo febre, vermelhidão da pele, dor articular e/ou inflamação ocular (síndrome de Stevens-Johnson), descamação da pele (exfoliação cutânea tóxica), vermelhidão com manchas vermelhas irregulares (eritema multiforme), inflamação da pele com bolhas e descamação (dermatite esfoliativa), urticária, separação da unha da sua base (pacientes em tratamento devem usar protetor solar nas mãos e pés);
perda de apetite (anorexia);
reações alérgicas graves que podem ser fatais (choque anafilático);
distúrbios da função hepática (insuficiência hepática, encefalopatia hepática);
confusão mental;
convulsões do tipo grand mal, lesões nos nervos do cérebro (neuropatia autonômica afetando funções involuntárias do organismo, o que pode causar obstrução intestinal e queda da pressão arterial), convulsões, distúrbios da função cerebral (encefalopatia), tontura, dor de cabeça, dificuldade de coordenação motora (ataxia).
Frequência desconhecida (não pode ser estimada a partir dos dados disponíveis):
síndrome de lise tumoral (síndrome de decomposição tumoral);
acúmulo de líquido na mácula amarela (edema da mácula), percepção de fenômenos luminosos, como flashes (fotopsia), depósitos no corpo vítreo (opacidade do vítreo);
inflamação das veias;
espessamento e endurecimento da pele, vasos sanguíneos e órgãos internos (esclerodermia);
lúpus eritematoso sistêmico (eritema em forma de asa de borboleta);
distúrbios da coagulação, incluindo casos de coagulação intravascular disseminada (CID); é uma doença grave que pode causar sangramento ou formação de coágulos excessivos, ou ambos;
vermelhidão e inchaço na palma das mãos e nas plantas dos pés, que podem causar descamação da pele.
Notificação de efeitos indesejados
Se ocorrerem quaisquer efeitos indesejados, incluindo quaisquer efeitos indesejados não mencionados neste folheto, deve informar o seu médico, farmacêutico ou enfermeiro. Efeitos indesejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Indesejados de Medicamentos do Ministério da Saúde
Rua Jerozolimskie, 181C
02-222 Varsóvia
telefone: +48 22 49 21 301
fax: +48 22 49 21 309
site: https://smz.ezdrowie.gov.pl
Efeitos indesejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos indesejados pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como armazenar Paclitaxel Kabi
Manter o medicamento em um local seguro e fora do alcance das crianças.
Não armazenar acima de 25°C.
Manter as ampolas no embalagem exterior para proteger da luz.
Não utilizar este medicamento após a data de validade impressa na etiqueta e na caixa: Válido até: DATA DE VALIDADE.
A data de validade é o último dia do mês indicado.
Não utilizar este medicamento se notar sinais de turvação ou resíduos insolúveis.
Medicamentos não devem ser jogados na rede de esgotos ou lixeiras domésticas. Deve perguntar ao farmacêutico como descartar medicamentos que não são mais necessários. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Paclitaxel Kabi
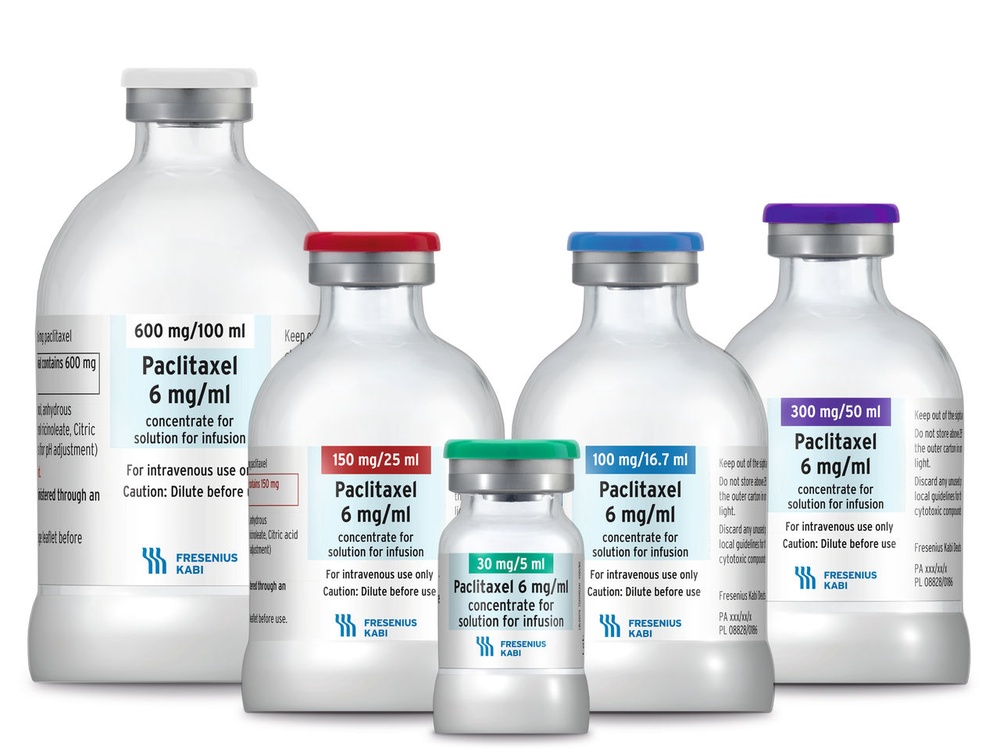
O princípio ativo do medicamento é o paclitaxel. Cada ml contém 6 mg de paclitaxel.
Cada ampola de 5 ml contém 30 mg de paclitaxel.
Cada ampola de 16,7 ml contém 100 mg de paclitaxel.
Cada ampola de 25 ml contém 150 mg de paclitaxel.
Cada ampola de 50 ml contém 300 mg de paclitaxel.
Cada ampola de 100 ml contém 600 mg de paclitaxel.
Os outros componentes são: etanol anidro, macrogol glicerol ricinoleato e ácido cítrico anidro (para ajustar o pH).
Como é Paclitaxel Kabi e que embalagens estão disponíveis
Concentração para solução para infusão.
Paclitaxel Kabi é uma solução clara, ligeiramente amarelada.
O medicamento está disponível em ampolas de vidro com tampa de borracha clorobutilada revestida com teflon.
Tamanhos da embalagem:
As embalagens contêm 1 ou 5 ampolas de vidro.
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização:
Fresenius Kabi Polska Sp. z o.o.
Rua Jerozolimskie, 134
02-305 Varsóvia
Fabricante:
Fresenius Kabi Deutschland GmbH
Pfingstweide, 53
61169 Friedberg
Alemanha
Corden Pharma Latina S.p.A.
Via Murillo, 7
04013 Sermoneta (LT)
Itália
Para obter informações mais detalhadas, deve contatar o titular da autorização de comercialização:
Fresenius Kabi Polska Sp. z o.o.
Rua Jerozolimskie, 134
02-305 Varsóvia
telefone: +48 22 345 67 89
Este medicamento está autorizado para comercialização nos países membros da Área Econômica Europeia sob os seguintes nomes:
| Áustria | Paclitaxel Kabi 6 mg/ml Konzentrat zur Herstellung einer Infusionslösung |
| Bélgica | Paclitaxel Fresenius Kabi |
| Bulgária | Paclitaxel Kabi 6 mg/ml Концентрат за инфузионен разтвор |
| República Tcheca | Paclitaxel Kabi |
| Dinamarca | Paclitaxel Fresenius Kabi 6 mg/ koncentrat til infusionsvaeske, opløsning |
| Estônia | Paclitaxel Kabi 6 mg/ml infusioonilahuse kontsentraat |
| Finlândia | Paclitaxel Fresenius Kabi 6 mg/ml infuusiokonsentraatti, liuosta varten |
| França | Paclitaxel Kabi 6 mg/ml solution à diluer pour perfusion |
| Espanha | Paclitaxel Fresenius Kabi 6 mg/ml concentrado para solución para perfusión |
| Países Baixos | Paclitaxel Fresenius Kabi |
| Irlanda | Paclitaxel 6 mg/ml concentrate for solution for infusion |
| Letônia | Paclitaxel Kabi 6 mg/ml koncentrāts infūziju šķīduma pagatavošanai |
| Lituânia | Paclitaxel Kabi 6 mg/ml koncentratas infuziniam tirpalui |
| Luxemburgo | Paclitaxel Kabi 6 mg/ml Konzentrat zur Herstellung einer Infusionslösung |
| Alemanha | Paclitaxel Kabi 6 mg/ml Konzentrat zur Herstellung einer Infusionslösung |
| Noruega | Paclitaxel Fresenius Kabi 6 mg/ml konsentrat til infusjonsvæske |
| Polônia | Paclitaxel Kabi |
| Portugal | Paclitaxel Kabi 6 mg/ml concentrado para solução para perfusão |
| Romênia | Paclitaxel Kabi 6 mg/ml concentrat pentru soluţie perfuza |
| Eslováquia | Paclitaxel Kabi 6 mg/ml |
| Eslovênia | Paklitaksel Kabi 6 mg/ml koncentrat za raztopino za infundiranje |
| Suécia | Paclitaxel Fresenius Kabi 6 mg/ml koncentrat till infusionsvätska, lösning |
| Hungria | Paclitaxel Kabi 6 mg/ml koncentrátum oldatos infúzióhoz |
| Reino Unido | Paclitaxel 6 mg/ml concentrate for solution for infusion |
| Itália | Paclitaxel Kabi 6 mg/ml concentrato per soluzione per infusione |
Data da última atualização do folheto:28.06.2021
-----------------------------------------------------------------------------------------------------------------
Informações destinadas exclusivamente ao pessoal médico qualificado:
Preparação:
Assim como com outros medicamentos antineoplásicos, é necessário ter cuidado ao preparar o paclitaxel para administração. A diluição deve ser realizada por pessoal qualificado em um local especialmente designado e em condições assépticas. Devem ser utilizadas luvas de proteção adequadas. Devem ser seguidas as precauções para evitar o contato do medicamento com a pele e as mucosas. Em caso de contato com a pele, o local deve ser lavado com água e sabão. Em caso de contato com as mucosas, deve-se lavar imediatamente com água. Em caso de ocorrer qualquer desconforto, deve-se consultar um médico.
Em caso de inalação do paclitaxel, podem ocorrer dificuldade em respirar, dor no peito, sensação de queimadura na garganta e náuseas.
Como resultado do armazenamento de ampolas fechadas na geladeira, pode ocorrer a formação de um resíduo que se dissolve novamente após um ligeiro agitamento ou sem agitamento após atingir a temperatura ambiente. Isso não afeta a qualidade do medicamento. Se a solução permanecer turva ou o resíduo não se dissolver, a ampola deve ser descartada.
Em caso de múltiplas penetrações na ampola e retirada do medicamento, as ampolas mantêm a estabilidade microbiológica, química e física por 28 dias a 25°C. O usuário é responsável por outras condições e tempo de armazenamento do medicamento.
Não se deve utilizar dispositivos do tipo Chemo-Dispensing Pin ou aplicadores semelhantes com agulhas para retirar doses da ampola, pois podem danificar a tampa e causar perda de esterilidade.
Preparação da solução para infusão:
Antes da administração de paclitaxel por infusão intravenosa, o medicamento deve ser diluído em condições assépticas em solução de glicose a 5%, solução de cloreto de sódio a 0,9%, solução de glicose a 5% em solução de Ringer ou solução de glicose a 5% com solução de cloreto de sódio a 0,9%, para obter uma concentração entre 0,3 e 1,2 mg/ml.
A solução preparada para infusão mantém a estabilidade química e física a 25°C por 24 horas, quando diluída em solução de glicose a 5%, solução de cloreto de sódio a 0,9%, solução de glicose a 5% em solução de Ringer e solução de glicose a 5% com solução de cloreto de sódio a 0,9%.
Do ponto de vista microbiológico, o medicamento deve ser utilizado imediatamente. Se a solução não for administrada imediatamente, a pessoa que administra o medicamento é responsável pelo tempo e condições de armazenamento antes da administração. Nesse caso, a solução não deve ser armazenada por mais de 24 horas a uma temperatura entre 2°C e 8°C, a menos que a reconstituição e diluição tenham sido realizadas em condições assépticas controladas e validadas.
Após a diluição, a solução é destinada a uso único.
Após a preparação, as soluções podem ser turvas, o que é devido às propriedades dos excipientes e não pode ser removido por filtração. O paclitaxel deve ser administrado por infusão intravenosa através de um conjunto de infusão com filtro interno com membrana porosa de diâmetro de poro ≤0,22 μm. Em estudos de teste, não foi detectada perda significativa da atividade do medicamento após a administração da solução através de um conjunto de infusão intravenosa com filtro interno.
Raramente, foram relatados casos de formação de resíduo durante a infusão de paclitaxel, geralmente no final da infusão de 24 horas. Embora a causa da formação do resíduo não tenha sido esclarecida, provavelmente está relacionada à supersaturação da solução diluída. Para minimizar o risco de formação de resíduo, o paclitaxel deve ser administrado o mais rápido possível após a diluição e deve-se evitar o agitamento brusco e as vibrações da solução. Os conjuntos de infusão devem ser completamente lavados antes do uso.
A aparência da solução deve ser verificada regularmente durante a infusão intravenosa e, em caso de formação de resíduo, a infusão deve ser interrompida.
Para minimizar o risco de exposição do paciente ao DEHP (ftalato de di(2-etilhexila)), que pode ser liberado de bolsas de PVC, conjuntos de infusão e outros equipamentos médicos, a solução diluída de paclitaxel deve ser armazenada em frascos feitos de materiais diferentes de PVC (vidro, polipropileno) ou em bolsas de plástico (polipropileno, poliolefina) e administrada através de conjuntos de infusão revestidos com polietileno. O uso de conjuntos de infusão com filtro (por exemplo, IVEX-2) com entrada curta ou tubo de saída feito de PVC não causa liberação significativa de DEHP.
Precauções de segurança ao preparar a solução para infusão
- 1. Todas as operações devem ser realizadas em um local separado/ câmara de segurança. É necessário o uso de luvas e avental de proteção. Se não houver um local separado/ câmara de segurança, deve-se usar máscara e óculos de proteção.
- 2. Mulheres grávidas ou que possam estar grávidas não devem preparar este medicamento.
- 3. Recipientes abertos, como ampolas e frascos, e agulhas e seringas usadas, e resíduos de medicamentos citotóxicos devem ser considerados resíduos perigosos e eliminados de acordo com as regulamentações locais para resíduos perigosos.
- 4. Em caso de derramamento da solução, deve-se seguir as seguintes instruções: - deve-se usar roupa de proteção - vidro quebrado deve ser recolhido e colocado em um recipiente para resíduos perigosos - superfícies contaminadas devem ser lavadas com água em abundância - superfícies lavadas devem ser secas, e os materiais usados para limpar devem ser eliminados de acordo com as regulamentações para resíduos perigosos.
- 5. Em caso de contato do paclitaxel com a pele, o local afetado deve ser lavado com água em abundância, seguido de sabão e água. Em caso de contato com as mucosas, deve-se lavar imediatamente com água. Em caso de ocorrer qualquer desconforto, deve-se consultar um médico.
- 6. Em caso de contato do paclitaxel com os olhos, deve-se lavar imediatamente com água em abundância. Deve-se consultar um oftalmologista imediatamente.
Eliminação de resíduos
Todos os resíduos de medicamento não utilizados e seus embalagens devem ser eliminados de acordo com as regulamentações locais para medicamentos citotóxicos.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorCorden Pharma Latina S.p.A Fresenius Kabi Deutschland GmbH Pharmavalid Limited Microbiological Laboratory Wessling GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Paclitaxel KabiForma farmacêutica: Concentrado, 6 mg/mlSubstância ativa: paclitaxelFabricante: Ebewe Arzneimittel Ges.m.b.H.Requer receita médicaForma farmacêutica: Concentrado, 6 mg/mlSubstância ativa: paclitaxelNão requer receita médicaForma farmacêutica: Concentrado, 10 mg/mlSubstância ativa: cabazitaxelRequer receita médica
Alternativas a Paclitaxel Kabi noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Paclitaxel Kabi em Espanha
Alternativa a Paclitaxel Kabi em Ukraine
Médicos online para Paclitaxel Kabi
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Paclitaxel Kabi – sujeita a avaliação médica e regras locais.