Como usar Fastum
FOLHETO INCLUÍDO NA EMBALAGEM: INFORMAÇÃO PARA O PACIENTE
Atenção! Guarde o folheto, informação na embalagem direta em língua estrangeira!
Fastum(Gel Fastum)
25 mg/g, gel
Ketoprofeno
Fastum e Fastum Gel são nomes comerciais diferentes do mesmo medicamento.
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o paciente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente desenvolver algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeira. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Fastum e para que é usado.
- 2. Informações importantes antes de usar o medicamento Fastum.
- 3. Como usar o medicamento Fastum.
- 4. Efeitos secundários possíveis.
- 5. Como armazenar o medicamento Fastum.
- 6. Conteúdo da embalagem e outras informações.
1. O que é o medicamento Fastum e para que é usado
O medicamento Fastum é um medicamento do grupo de medicamentos anti-inflamatórios não esteroides (AINEs) para uso tópico.
O ketoprofeno - substância ativa do medicamento Fastum - administrado topicamente, é absorvido pela pele para as áreas inflamadas das articulações, tendões, ligamentos e músculos. Não se acumula no organismo. O gel, graças à base aquosa-alcoólica, também tem um efeito refrescante e calmante. A base apropriada assegura a libertação adequada do ketoprofeno e um pequeno risco de efeitos secundários sistémicos. O medicamento é bem tolerado, mesmo em caso de pele sensível.
Indicações
- Tratamento tópico de dores musculares e articulares, por exemplo, causadas por lesões (lesões desportivas, lesões articulares com distensão dos ligamentos sem luxação, lesões dos tendões e músculos devido a esforço excessivo),
- Tratamento tópico de dores na região lombar no decurso de discopatia.
2. Informações importantes antes de usar o medicamento Fastum
Quando não usar o medicamento Fastum
Não use o medicamento se ocorreu hipersensibilidade no histórico ao ketoprofeno ou a qualquer um dos outros componentes do medicamento Fastum, ácido tiaprofenico, ácido acetilsalicílico ou outros medicamentos anti-inflamatórios não esteroides, fenofibrato, filtros UV ou perfumes.
O ketoprofeno não deve ser usado em pacientes que apresentam ataques de "asma aspirínica", erupções ou rinite após a administração de ácido acetilsalicílico e seus derivados.
O medicamento é contraindicado em pessoas com asma aspirínica no histórico ou que apresentaram outras reações de hipersensibilidade.
O medicamento Fastum não deve ser usado em feridas abertas e em pessoas com erupções, eczemas ou lesões cutâneas de origem desconhecida.
Deve parar imediatamente de usar o medicamento se ocorrerem reações cutâneas, incluindo reações cutâneas após a aplicação concomitante de produtos que contenham octocrileno (octocrileno é um dos componentes auxiliares usados em vários cosméticos e produtos de higiene, como xampu, produtos para após a barba, géis de banho e chuveiro, cremes para a pele, pomadas, cremes anti-envelhecimento, produtos para remover maquiagem, lacas para cabelo, para retardar a decomposição sob a influência da luz).
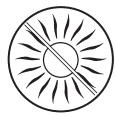
Não exponha a pele tratada à radiação solar (mesmo com o céu nublado) ou radiação UV em solário, durante o tratamento e 2 semanas após a interrupção do uso do medicamento.
Não se recomenda o uso de ketoprofeno em crianças abaixo de 15 anos, devido à falta de estudos clínicos controlados sobre a eficácia e segurança do uso. Não use em mulheres a partir do sexto mês de gravidez.
Precauções e advertências
A exposição à radiação solar (mesmo com o céu nublado) ou radiação UVA nas áreas da pele onde o medicamento Fastum foi aplicado pode causar reações cutâneas graves (hipersensibilidade à radiação solar). Portanto, é necessário:
- proteger as áreas da pele tratadas usando roupas durante o tratamento e duas semanas após a interrupção do uso do medicamento, para evitar o risco de hipersensibilidade à radiação solar
- lavar as mãos cuidadosamente após cada aplicação do medicamento Fastum. O uso prolongado de medicamentos tópicos pode causar reações alérgicas ou irritações locais em alguns pacientes. Se ocorrer vermelhidão, erupção, coceira ou náusea, deve interromper imediatamente o uso do medicamento e consultar um médico. O medicamento não deve ser usado em feridas abertas ou cortes, e se ocorrerem lesões na pele no local da aplicação do gel, deve-se interromper o uso do medicamento. Deve proteger os olhos e mucosas do contato com o medicamento, não usar sob bandagens oclusivas. O medicamento não deve ser usado por via oral ou em grandes áreas do corpo. A administração tópica de grandes quantidades do medicamento pode causar efeitos sistémicos, incluindo reações de hipersensibilidade e asma. O medicamento deve ser usado com cautela em pacientes com insuficiência cardíaca, distúrbios graves da função renal ou hepática, pois foram relatados casos isolados de efeitos secundários sistémicos. Em pacientes com história de epilepsia, deve-se ter cautela ao usar o produto medicamentoso, devido ao conteúdo do componente auxiliar no produto - derivado de terpeno (aroma de lavanda). Após a aplicação do gel, deve-se lavar as mãos, a menos que sejam as mãos o local tratado. Durante o uso prolongado, recomenda-se o uso de luvas de proteção. O tratamento deve ser interrompido imediatamente se ocorrerem reações cutâneas após a aplicação do medicamento Fastum. O medicamento contém álcool, não use perto do fogo. Em pacientes com asma e rinite crônica, rinite crônica, sinusite crônica e (ou) pólipos nasais, o risco de reação alérgica à aspirina e (ou) medicamentos AINE é maior do que no restante da população.
Medicamento Fastum e outros medicamentos
Não foram descritas interações do medicamento Fastum com outros medicamentos. No entanto, deve-se ter cautela em pacientes que tomam medicamentos anticoagulantes orais concomitantemente.
Gravidez
Antes de usar qualquer medicamento, deve consultar um médico.
O uso de medicamentos anti-inflamatórios não esteroides (AINEs) durante o terceiro trimestre da gravidez pode causar efeitos prejudiciais no coração e pulmões do feto. Os medicamentos AINE podem causar atraso no parto. Deve-se evitar o uso do medicamento durante o primeiro e segundo trimestres da gravidez. Não use em mulheres a partir do terceiro trimestre da gravidez.
Amamentação
Antes de usar qualquer medicamento, deve consultar um médico.
O ketoprofeno passa em pequenas quantidades para o leite materno. Não se recomenda a administração do medicamento a mulheres durante a amamentação.
Condução de veículos e uso de máquinas
Não foi descrito o efeito do medicamento na capacidade de conduzir veículos ou operar máquinas.
O medicamento Fastum contém aroma de laranja e aroma de lavanda.
Este medicamento contém aromas com a seguinte composição: citral, citronelol, cumarina, farnesol, geraniol, d-limoneno e linalol, que podem causar reações alérgicas.
3. Como usar o medicamento Fastum
O medicamento Fastum deve ser usado 1 a 2 vezes ao dia, aplicando uma camada fina do gel (uma faixa de gel com comprimento de 3 cm a 5 cm) na pele na área dolorosa e massageando suavemente para facilitar a absorção. Se após 7 dias de uso do medicamento os sintomas não desaparecerem, piorarem ou ocorrerem novos sintomas, deve consultar um médico.
Não use o medicamento Fastum em crianças abaixo de 15 anos.
Uso de dose maior do que a recomendada do medicamento Fastum
Não foram registrados casos de superdose ou envenenamento com o medicamento Fastum.
Em caso de ingestão acidental do gel, podem ocorrer: sonolência, náusea, vômito. A ingestão de grandes doses pode causar depressão da respiração, coma, convulsões, sangramento gastrointestinal, aumento ou diminuição da pressão arterial, insuficiência renal aguda. O médico aplicará as medidas e tratamento apropriados, geralmente usados no tratamento de envenenamento por medicamentos AINE. Se a superdose ocorreu há menos de 1 hora, deve-se realizar lavagem gástrica e tratamento sintomático.
4. Efeitos secundários possíveis
Como qualquer medicamento, o medicamento Fastum pode causar efeitos secundários, embora não em todos os pacientes.
As seguintes frequências de ocorrência são geralmente a base para a avaliação dos efeitos secundários:
Muito frequentes: mais de 1 em 10 pacientes tratados;
Frequentes: menos de 1 em 10, mas mais de 1 em 100 pacientes tratados;
Pouco frequentes: menos de 1 em 100, mas mais de 1 em 1.000 pacientes tratados;
Raros: menos de 1 em 1.000, mas mais de 1 em 10.000 pacientes tratados;
Muito raros: menos de 1 em 10.000 pacientes tratados, desconhecidos (não podem ser estimados com base nos dados disponíveis).
Foram observados casos de reações cutâneas locais que podem se espalhar além do local de aplicação do medicamento. Raramente, ocorreram casos de reações graves, como erupção bolhosa ou papulosa, que podem se espalhar ou ser generalizadas.
Outros efeitos secundários sistémicos (por exemplo, relacionados ao trato gastrointestinal ou renal) causados por medicamentos AINE resultam da absorção da substância ativa do medicamento através da pele, portanto, dependem da quantidade de gel aplicada, da área da pele tratada, do grau de absorção pelo tecido, do tempo de duração da terapia e do uso eventual de bandagem oclusiva (hipersensibilidade, distúrbios gastrintestinais e distúrbios da função renal).
Desde a introdução do medicamento no mercado, foram observados os seguintes efeitos secundários, que são apresentados abaixo, agrupados por sistemas de órgãos e frequência de ocorrência como: muito frequentes (maiores ou iguais a 10%), frequentes (entre 1% e 10%), pouco frequentes (entre 0,1% e 1%), raros (entre 0,01% e 0,1%) ou muito raros (menos de 0,01%) incluindo casos isolados.
Distúrbios do sistema imunológico
Muito raros:
Distúrbios gastrintestinais
Reação anafilática, reações de hipersensibilidade
Muito raros:
Doença ulcerosa gástrica e (ou) duodenal, sangramento gastrointestinal, diarreia
Distúrbios da pele e tecido subcutâneo
Pouco frequentes:
Vermelhidão, coceira, erupção, ardor
Raros:
Hipersensibilidade à radiação, erupção bolhosa, urticária
Muito raros:
Dermites de contato, angioedema
Distúrbios renais e urinários
Muito raros:
Insuficiência renal ou agravamento dos distúrbios da função renal
Pacientes idosos são particularmente propensos a efeitos secundários após a administração de medicamentos AINE.
Se algum dos efeitos secundários se agravar ou ocorrerem efeitos secundários não mencionados neste folheto, deve informar o médico ou farmacêutico.
Notificação de efeitos secundários
Se ocorrerem algum efeito secundário, incluindo qualquer efeito secundário não mencionado no folheto, deve informar o médico ou farmacêutico, ou enfermeira.
Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Medicamentos da Agência de Regulação de Medicamentos, Produtos para a Saúde e Produtos Biocidas.
Rua Jerozolimskie 181C
02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Site: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização ou ao importador paralelo.
A notificação de efeitos secundários pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como armazenar o medicamento Fastum
Não há requisitos especiais para armazenamento.
O medicamento deve ser armazenado em local não visível e inacessível a crianças.
Não use este medicamento após a data de validade impressa na embalagem. A data de validade é o último dia do mês dado. Período de validade após a primeira abertura
da embalagem: 6 meses.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que não são mais usados. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Fastum
- A substância ativa do medicamento é: Ketoprofeno(ketoprofeno).
- Os outros componentes do medicamento são: carbômer, etanol 96%, trietanolamina, aroma de laranja (contém citral, citronelol, farnesol, geraniol, d-limoneno e linalol), aroma de lavanda (contém cumarina, geraniol, d-limoneno e linalol), água purificada.
Como é o medicamento Fastum e o que a embalagem contém
Tubo contendo 20 g, 30 g, 50 g ou 100 g de gel.
Para obter informações mais detalhadas, deve contactar o titular da autorização de comercialização ou o importador paralelo.
Titular da autorização de comercialização na Romênia, país de exportação:
- A. Menarini Industrie Farmaceutiche Riunite S.r.l. Via Sette Santi 3 50131 Florença Itália
Fabricante
- A. Menarini Manufacturing Logistics and Services S.r.l. Via Sette Santi 3 50131 Florença Itália
Importador paralelo:
Medezin Sp. z o.o.
Rua Zbąszyńska 3
91-342 Łódź
Reembalado por:
Medezin Sp. z o.o.
Rua Zbąszyńska 3
91-342 Łódź
CEFEA Sp. z o.o. Sp. komandytowa
Rua Działkowa 56
02-234 Varsóvia
Pharma Innovations Sp. z o.o.
Rua Jagiellońska 76
03-301 Varsóvia
SHIRAZ PRODUCTIONS Sp. z o.o.
Rua Tymiankowa 24/28
95-054 Ksawerów
CANPOLAND SPÓŁKA AKCYJNA
Rua Beskidzka 190
91-610 Łódź
Número da autorização de comercialização na Romênia, país de exportação:
8884/2016/01
8884/2016/02
8884/2016/04
8884/2016/03
Número da autorização de importação paralela: 320/22 Data de aprovação do folheto: 25.08.2022
[Informação sobre marca registrada]
- País de registo
- Substância ativa
- Requer receita médicaSim
- Titular da Autorização de Introdução no Mercado (AIM, MAH)A. Menarini Industrie Farmaceutiche Riunite S.r.l.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FastumForma farmacêutica: Gel, 25 mg/gSubstância ativa: ketoprofenRequer receita médicaForma farmacêutica: Gel, 25 mg/gSubstância ativa: ketoprofenRequer receita médicaForma farmacêutica: Gel, 25 mg/gSubstância ativa: ketoprofenRequer receita médica
Alternativas a Fastum noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Fastum em Ukraine
Alternativa a Fastum em Espanha
Médicos online para Fastum
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Fastum – sujeita a avaliação médica e regras locais.