
Dimol
Pergunte a um médico sobre a prescrição de Dimol

Como usar Dimol
Folheto informativo para o doente
Dymol, (137 microgramas + 50 microgramas)/dose nasal, spray nasal, suspensão
Cloridrato de azelastina + propionato de fluticasona
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outros, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Dymol e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Dymol
- 3. Como tomar o medicamento Dymol
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Dymol
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Dymol e para que é utilizado
O medicamento Dymol contém duas substâncias ativas: cloridrato de azelastina e propionato de fluticasona.
- O cloridrato de azelastina pertence a um grupo de medicamentos conhecidos como medicamentos antihistamínicos. Os medicamentos antihistamínicos actuam impedindo a acção de substâncias como a histamina, que o organismo produz como parte de uma reacção alérgica e, assim, reduzem os sintomas de rinite alérgica.
- O propionato de fluticasona pertence a um grupo de medicamentos conhecidos como corticosteroides, que reduzem a inflamação.
O medicamento Dymol é utilizado para aliviar os sintomas de rinite alérgica sazonal e perene, de intensidade moderada a grave, quando o tratamento com outros produtos nasais que contenham apenas um medicamento antihistamínico ou um corticoide é considerado insuficiente.
2. Informações importantes antes de tomar o medicamento Dymol
Quando não tomar o medicamento Dymol
- Se o doente for alérgico ao cloridrato de azelastina ou ao propionato de fluticasona, ou a qualquer outro componente deste medicamento (listado no ponto 6).
Precauções e advertências
Antes de começar a tomar o medicamento Dymol, deve discutir com o médico ou farmacêutico:
- Se o doente teve recentemente uma operação nasal.
- Se o doente tiver uma infeção nasal. A infeção nasal deve ser tratada com antibióticos ou antifúngicos. Os doentes que tenham sido tratados para uma infeção nasal podem continuar a tratar a alergia com o medicamento Dymol.
- Se o doente tiver tuberculose ou uma infeção não tratada.
- Se o doente notar uma alteração da visão ou se foi diagnosticado um aumento da pressão intra-ocular, glaucoma e (ou) catarata. Os doentes que tenham estas condições serão cuidadosamente monitorizados durante o tratamento com o medicamento Dymol.
- Se o doente tiver problemas de suprarrenal. Deve ter cuidado ao mudar de um tratamento com esteroides por via oral para a terapia com o medicamento Dymol.
- Se o doente tiver uma doença hepática grave. Neste caso, aumenta o risco de efeitos não desejados sistémicos.
Nestes casos, o médico decidirá se o medicamento Dymol pode ser utilizado.
Crianças e adolescentes
Não se recomenda a utilização deste medicamento em crianças com menos de 12 anos.
Interações com outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar, incluindo os medicamentos disponíveis sem receita médica.
Gravidez e amamentação
Se a paciente estiver grávida ou a amamentar, suspeitar que pode estar grávida ou planeiar ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
Condução de veículos e utilização de máquinas
O medicamento Dymol tem um efeito mínimo na capacidade de conduzir veículos e utilizar máquinas.
O medicamento Dymol contém cloridrato de benzalcônio
Este medicamento contém 14 microgramas de cloridrato de benzalcônio em cada dose, o que corresponde a 0,014 mg/0,14 g. O cloridrato de benzalcônio pode causar irritação ou inchaço no interior do nariz, especialmente se for utilizado durante um longo período.
3. Como tomar o medicamento Dymol
Este medicamento deve ser sempre utilizado de acordo com as instruções do médico ou farmacêutico. Em caso de dúvida, deve consultar o médico ou farmacêutico.
Adultos e adolescentes (a partir de 12 anos)
- Recomenda-se a utilização de uma dose em cada narina, de manhã e à noite.
Utilização em crianças com menos de 12 anos
- Não se recomenda a utilização deste medicamento em crianças com menos de 12 anos.
Utilização em doentes com problemas renais ou hepáticos
- Não há dados disponíveis sobre a utilização em doentes com problemas renais ou hepáticos.
Modo de administração
Administração nasal.
INSTRUÇÕES DE UTILIZAÇÃO
Preparação do spray nasal
- 1. Agite suavemente a garrafa durante 5 segundos, fazendo um movimento de cima para baixo, e retire a tampa de protecção (ver figura 1).
Figura 1
- 2. Se o spray nasal for utilizado pela primeira vez, deve encher a bomba libertando uma dose do medicamento no ar.
- 3. Encher a bomba segurando dois dedos de cada lado da bomba e o polegar na base da garrafa.
- 4. Pressionar e libertar a bomba 6 vezes, até obter uma fina névoa (ver figura 2).
- 5. Agora a bomba está cheia e pronta para uso.
Figura 2
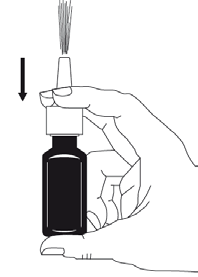
- 6. Se o spray nasal não for utilizado durante mais de 7 dias, deve reencher a bomba, pressionando-a e libertando-a uma vez.
Utilização do spray nasal
- 1. Agite suavemente a garrafa durante 5 segundos, fazendo um movimento de cima para baixo, e retire a tampa de protecção (ver figura 1).
- 2. Assoe o nariz para limpar as narinas.
- 3. Incline a cabeça para baixo, na direcção dos pés. Não incline a cabeça para trás.
- 4. Segure a garrafa na vertical e coloque suavemente a ponta da bomba na narina.
- 5. Feche a outra narina com o dedo, pressione a bomba rapidamente uma vez e, ao mesmo tempo, faça uma inspiração suave (ver figura 3).
- 6. Expire pela boca.
Figura 3

- 7. Repita o processo com a outra narina.
- 8. Após a administração do medicamento, faça inspirações suaves e não incline a cabeça para trás. Isso ajudará a evitar que o medicamento entre na garganta e cause um sabor desagradável (ver figura 4).
Figura 4

- 9. Após cada utilização, limpe a ponta da bomba com um lenço limpo ou um pano e volte a colocar a tampa de protecção.
- 10. Se o spray nasal não for libertado, não perfure a ponta da bomba. Lave a ponta da bomba com água.
É importante utilizar a dose prescrita pelo médico. Deve utilizar apenas a dose que o médico prescreveu.
Duração do tratamento
O medicamento Dymol pode ser utilizado por um longo período. A duração do tratamento deve corresponder ao período durante o qual os sintomas da alergia estão presentes.
Utilização de uma dose maior do que a recomendada do medicamento Dymol
Se uma dose excessiva do medicamento for utilizada, existe um pequeno risco de complicações. Deve consultar o médico se algo o preocupar ou se uma dose maior do que a recomendada for utilizada durante um longo período. Se alguém, especialmente uma criança, ingerir acidentalmente o medicamento Dymol, deve contactar imediatamente o médico ou o serviço de emergência mais próximo.
Omissão da utilização do medicamento Dymol
Deve utilizar o spray nasal assim que se lembrar, e depois utilizar a próxima dose no horário habitual. Não deve utilizar uma dose dupla para compensar a dose omitida.
Interrupção da utilização do medicamento Dymol
Não deve interromper a utilização do medicamento Dymol sem o consentimento do médico, devido ao risco de perda de eficácia do tratamento.
4. Efeitos não desejados
Como todos os medicamentos, o medicamento Dymol pode causar efeitos não desejados, embora não todos os doentes os experimentem.
Deve procurar imediatamente ajuda médica se ocorrer algum dos seguintes sintomas:
- Inchaço do rosto, lábios, língua ou garganta, que pode causar dificuldade em engolir e (ou) respirar, bem como uma erupção cutânea súbita. Estes podem ser sintomas de uma reacção alérgica grave.
Outros efeitos não desejados incluem:
Efeitos não desejados muito frequentes(podem ocorrer em mais de 1 em 10 doentes):
- Sangramento nasal
Efeitos não desejados frequentes(podem ocorrer em menos de 1 em 10 doentes):
- Dor de cabeça
- Sabor amargo na boca, especialmente se o doente inclinar a cabeça para trás durante a administração do spray nasal. Este sabor deve desaparecer se o doente beber uma bebida não alcoólica alguns minutos após a administração do medicamento.
- Cheiro desagradável
Efeitos não desejados não muito frequentes(podem ocorrer em menos de 1 em 100 doentes):
- Ligeira irritação no interior do nariz. Pode causar uma sensação de picada, coceira ou espirros.
- Secura no nariz, tosse, secura na garganta ou irritação da garganta
Efeitos não desejados raros(podem ocorrer em menos de 1 em 1000 doentes):
- Secura na boca
Efeitos não desejados muito raros(podem ocorrer em menos de 1 em 10 000 doentes):
- Tontura ou sonolência
- Catarata, glaucoma ou aumento da pressão intra-ocular, o que pode causar perda de visão e (ou) vermelhidão e dor nos olhos. Estes efeitos não desejados foram relatados após a utilização prolongada do spray nasal que contém propionato de fluticasona.
- Dano à pele e à mucosa nasal
- Mal-estar, sensação de fadiga, fraqueza ou exaustão
- Erupção cutânea, coceira ou vermelhidão da pele, bolhas pruriginosas na pele
- Espasmo brônquico (constricção das vias respiratórias inferiores)
Efeitos não desejados de frequência desconhecida(não é possível determinar a frequência com base nos dados disponíveis):
- Visão turva
- Úlcera da mucosa nasal
Se o medicamento for utilizado em doses elevadas durante um longo período, podem ocorrer efeitos não desejados sistémicos (efeitos não desejados que afetam todo o organismo). A probabilidade de ocorrência destes efeitos é muito menor quando os corticosteroides são utilizados como spray nasal do que durante o tratamento com corticosteroides por via oral. Estes efeitos podem variar de doente para doente e após a utilização de diferentes medicamentos corticosteroides (ver ponto 2).
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou farmacêutico. Os efeitos não desejados podem ser notificados directamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde, IP, Rua de Caselas, 1718-011 Lisboa, tel.: +351 21 798 73 00, fax: +351 21 798 73 99, website: https://www.infarmed.pt
5. Como conservar o medicamento Dymol
O medicamento deve ser conservado em local não visível e inacessível às crianças.
Não utilize este medicamento após o prazo de validade impresso na etiqueta da garrafa e na embalagem, após EXP. O prazo de validade é o último dia do mês indicado.
Não conserve no frigorífico nem congele.
Prazo de validade após a primeira abertura da garrafa: O medicamento não utilizado deve ser eliminado após 6 meses a partir da primeira abertura da garrafa com spray nasal.
Os medicamentos não devem ser eliminados na canalização nem nos contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Dymol
As substâncias ativas do medicamento são: cloridrato de azelastina e propionato de fluticasona.
Cada grama da suspensão contém 1000 microgramas de cloridrato de azelastina e 365 microgramas de propionato de fluticasona.
Após cada pressão da bomba (0,14 g), são libertados 137 microgramas de cloridrato de azelastina (o que corresponde a 125 microgramas de azelastina) e 50 microgramas de propionato de fluticasona.
Os outros componentes são: edetato dissódico, glicerol, celulose microcristalina, carmelose sódica, polissorbato 80, cloridrato de benzalcônio, álcool feniletilico e água purificada.
Como é o medicamento Dymol e conteúdo da embalagem
O medicamento Dymol é uma suspensão branca e homogênea.
O medicamento Dymol está disponível em garrafa de vidro âmbar com bomba de spray, aplicador nasal e tampa de protecção, em embalagem de cartão.
A garrafa de 10 ml contém 6,4 g de spray nasal em suspensão (pelo menos 28 doses). A garrafa de 25 ml contém 23 g de spray nasal em suspensão (pelo menos 120 doses).
O medicamento Dymol está disponível em:
- Embalagens com 1 garrafa contendo 6,4 g de spray nasal em suspensão
- Embalagens com 1 garrafa contendo 23 g de spray nasal em suspensão
- Embalagens colectivas de 10 garrafas, cada uma contendo 6,4 g de spray nasal em suspensão
- Embalagens colectivas de 3 garrafas, cada uma contendo 23 g de spray nasal em suspensão.
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de introdução no mercado
Viatris Limited
Damastown Industrial Park
Mulhuddart, Dublin 15
Dublin
Irlanda
Fabricante
MEDA Pharma GmbH & Co. KG
Benzstrasse 1
61352 Bad Homburg
Alemanha
Haupt Pharma Amareg GmbH
Donaustaufer Str. 378
93055 Regensburg
Alemanha
Mylan Hungary Kft./ Mylan Hungary Ltd
Mylan utca 1
2900 Komárom
Hungria
Madaus GmbH
Lütticher Straße 5
53842 Troisdorf
Alemanha
Para obter informações mais detalhadas sobre este medicamento, deve contactar o representante local do titular da autorização de introdução no mercado:
Viatris Healthcare, S.A.
Tel.: +351 21 412 33 00
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu sob os seguintes nomes:
Data da última revisão do folheto: 08/2024
| Áustria | Azeflu |
| República Checa | Dymol |
| Dinamarca | Flutista |
| Finlândia | Flutista |
| França | AZÉLASTINE CHLORHYDRATE/ FLUTICASONE PROPIONATE VIATRIS 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale |
| Grécia | Flutista 137 microgram/50 microgram nasal spray, suspension |
| Países Baixos | Azelastine/ Fluticasonpropionaat Viatris 137 microgram/50 microgram per verstuiving, neusspray, suspensie |
| Alemanha | Azelastin/Fluticason Viatris 137 Mikrogramm/50 Mikrogramm pro Sprühstoß Nasenspray, Suspension |
| Noruega | Dymol |
| Polónia | Dymol |
| Portugal | Azelastine + Fluticasone Mylan |
| Roménia | AZEFLU 137 micrograme / 50 micrograme spray nazal, suspensie |
| Eslováquia | Dymol |
| Eslovénia | Dymol 137 mikrogramov/50 mikrogramov na vpih pršilo za nos, suspenzija |
| Suécia | Flutista |
| Hungria | Azelasztin/Flutikazon Viatris 137 mikrogramm / 50 mikrogramm szuszpenziós orrspray |
| Itália | Azelastina e Fluticasone Viatris |
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorHaupt Pharma Amareg GmbH MADAUS GmbH Meda Pharma GmbH & Co. KG Mylan Hungary Kft.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a DimolForma farmacêutica: Aerossol, (137 mcg + 50 mcg)/doseSubstância ativa: fluticasone, combinationsRequer receita médicaForma farmacêutica: Aerossol, (137 mcg + 50 mcg)/ doseSubstância ativa: fluticasone, combinationsRequer receita médicaForma farmacêutica: Aerossol, (137 mcg + 50 mcg)/dose nasalSubstância ativa: fluticasone, combinationsRequer receita médica
Alternativas a Dimol noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Dimol em Espanha
Alternativa a Dimol em Ukraine
Médicos online para Dimol
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Dimol – sujeita a avaliação médica e regras locais.








