
Decapeptil Depot

Pergunte a um médico sobre a prescrição de Decapeptil Depot

Como usar Decapeptil Depot
Folheto informativo para o doente: informação para o paciente
DECAPEPTYL DEPOT,
3,75 mg, pó e solvente para suspensão injetável
Triptorelina
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
Deve guardar este folheto para poder relê-lo se necessário.
Em caso de dúvidas adicionais, deve consultar um médico.
Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode
prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados
neste folheto, deve informar o seu médico. Ver ponto 4.
Índice do folheto:
- 1. O que é Decapeptyl Depot e para que é utilizado
- 2. Informações importantes antes de tomar Decapeptyl Depot
- 3. Como tomar Decapeptyl Depot
- 4. Efeitos não desejados
- 5. Como conservar Decapeptyl Depot
- 6. Conteúdo da embalagem e outras informações
1. O que é Decapeptyl Depot e para que é utilizado
Decapeptyl Depot contém triptorelina (na forma de octanoato de triptorelina). Uma das suas ações é
diminuir a produção de hormonas sexuais pelo organismo.
Decapeptyl Depot é utilizado:
Nos homens:
para tratar cancro da próstata dependente de hormonas localmente avançado ou metastático,
para diagnosticar a dependência hormonal do cancro da próstata (avaliação das indicações para tratamento
hormonal).
Nas mulheres:
Para diminuir os níveis de hormonas ovarianas com o objetivo de:
diminuir o tamanho de miomas uterinos (comumente conhecidos como fibromas), que são tumores benignos
que se desenvolvem a partir da camada muscular do útero (miométrio),
tratar endometriose (crescimento de tecido uterino fora do útero).
2. Informações importantes antes de tomar Decapeptyl Depot
Quando não tomar Decapeptyl Depot
se o doente for alérgico à triptorelina ou a qualquer outro componente deste medicamento (listados no
ponto 6),
se o doente for alérgico ao hormônio liberador de gonadotropina (GnRH) ou a qualquer outro análogo de
GnRH.
Nas mulheres:
se a paciente estiver grávida,
se a paciente estiver amamentando.
Página 1 de 9
Precauções e advertências
Antes de iniciar o tratamento com Decapeptyl 0,1 mg, deve discutir com o seu médico.
Nos homens e mulheres
Foram relatados casos de depressão em doentes que tomam Decapeptyl Depot, incluindo casos de depressão
grave. Se durante o tratamento com Decapeptyl Depot ocorrerem sintomas de depressão, deve informar o
seu médico.
Nos homens
Deve ter cuidado:
se o doente tiver dores ósseas ou dificuldades em urinar,
se o doente tiver tumores metastáticos na coluna vertebral ou no trato urinário,
se o doente tiver qualquer distúrbio cardiovascular, incluindo distúrbios do ritmo cardíaco (arritmia), ou
estiver a tomar medicamentos para tratar esses distúrbios; o risco de distúrbios do ritmo cardíaco pode
ser aumentado durante o tratamento com Decapeptyl Depot.
Deve informar o seu médico se qualquer um dos sintomas da doença piorar.
Nas mulheres
Deve ter cuidado:
se durante o tratamento a paciente apresentar sangramento entre os períodos menstruais (com exceção
do primeiro mês),
se a paciente tiver um risco aumentado de diminuição da densidade óssea.
O tratamento com Decapeptyl Depot durante vários meses pode levar a uma diminuição da massa óssea.
Por isso, o tempo de tratamento não deve exceder 6 meses. Após a interrupção do tratamento, a massa óssea
costuma ser reconstruída dentro de 6 a 9 meses. Deve ter especial atenção às pacientes com fatores de
risco adicionais para osteoporose.
Durante o tratamento
No primeiro mês de tratamento, deve usar um método anticoncepcional não hormonal. Também deve
usá-lo a partir da 4ª semana após a última injeção até que os períodos menstruais voltem ou até que seja
usado outro método anticoncepcional.
Durante o tratamento, os períodos menstruais não ocorrem. Após a interrupção do tratamento, os períodos
menstruais costumam voltar dentro de 7 a 12 semanas após a última injeção do medicamento. Se durante o
tratamento os períodos menstruais regulares persistirem, deve informar o seu médico.
- 7 - 12 semanas após a última injeção do medicamento. Se durante o tratamento os períodos menstruais regulares persistirem, deve informar o seu médico.
Decapeptyl Depot e outros medicamentos
Deve informar o seu médico sobre todos os medicamentos que está a tomar atualmente ou recentemente
e também sobre os medicamentos que planeia tomar.
Decapeptyl Depot pode interferir com alguns medicamentos usados para tratar distúrbios do ritmo cardíaco
(por exemplo, quinidina, procanamida, amiodarona e sotalol) ou pode aumentar o risco de distúrbios do
ritmo cardíaco quando usado em conjunto com alguns outros medicamentos [por exemplo, metadona (usada
para diminuir a dor e como parte do tratamento de desintoxicação de drogas), moxifloxacina (antibiótico),
medicamentos antipsicóticos usados para tratar distúrbios psiquiátricos graves].
Deve ter cuidado quando a triptorelina for administrada em conjunto com medicamentos que afetam a
liberação de gonadotropinas pela glândula pituitária.
Gravidez e amamentação
Decapeptyl Depot não deve ser usado durante a gravidez e amamentação (ver também "Quando não tomar
Decapeptyl Depot").
As mulheres em idade fértil devem usar métodos anticoncepcionais eficazes e não hormonais.
Página 2 de 9
Condução de veículos e operação de máquinas
A capacidade de conduzir veículos e operar máquinas pode ser afetada se ocorrerem tonturas, sonolência e
distúrbios da visão, que podem ser efeitos não desejados durante o tratamento ou resultar da doença subjacente.
Decapeptyl Depot contém sódio
Decapeptyl Depot contém menos de 1 mmol de sódio (23 mg) por dose, o que significa que o medicamento
é considerado "livre de sódio".
3. Como tomar Decapeptyl Depot
Normalmente, a mistura do pó e do solvente e a injeção são realizadas por pessoal médico qualificado.
Nos homens:
Uma dose contida em uma seringa pré-cheia deve ser injetada a cada 4 semanas, correspondendo a
3,75 mg de triptorelina. Deve respeitar a administração do medicamento a cada 4 semanas.
Câncer de próstata:
O tratamento é de longo prazo.
Diagnóstico da dependência hormonal do câncer de próstata:
Normalmente, é suficiente usar o medicamento durante 3 meses para determinar a dependência hormonal do
câncer de próstata.
Nas mulheres:
Uma dose contida em uma seringa pré-cheia deve ser injetada a cada 4 semanas, correspondendo a
3,75 mg de triptorelina. O tratamento deve ser iniciado durante os primeiros 5 dias do ciclo menstrual.
O tempo de tratamento é supervisionado pelo médico.
Uso de uma dose maior do que a recomendada de Decapeptyl Depot
É pouco provável que o doente receba uma dose maior de Decapeptyl Depot do que o recomendado. Se o
doente receber uma dose maior do que a recomendada de Decapeptyl Depot, deve informar imediatamente
o seu médico.
Interrupção do tratamento com Decapeptyl Depot
A interrupção do tratamento com Decapeptyl Depot deve ser feita apenas sob orientação do médico. Em caso
de dúvidas sobre o uso do medicamento, deve consultar o seu médico.
4. Efeitos não desejados
Como qualquer medicamento, Decapeptyl Depot pode causar efeitos não desejados, embora não todos os
doentes os experimentem.
Geral (todos os doentes):
Se ocorrer inchaço na face, lábios, boca ou garganta, que pode causar dificuldade em engolir ou respirar,
deve informar imediatamente o seu médico ou procurar atendimento médico de emergência no hospital
mais próximo.
Durante o tratamento com agonistas de LHRH, foram relatados casos de aumento de tamanho de tumores
pré-existentes da glândula pituitária, mas até ao momento não foram observados tais casos em doentes
tratados com triptorelina.
Nos homens:
Página 3 de 9
Os sintomas pela qual o doente está a ser tratado (por exemplo, obstrução do trato urinário, dores ósseas,
compressão da medula espinhal, sintomas musculares, inchaço nas pernas, fraqueza, formigamento nos
pés e mãos), podem piorar inicialmente devido ao aumento do nível de testosterona no início do tratamento.
Muito frequentes– ocorrem em mais de 1 doente em cada 10 doentes tratados:
impotência (disfunção erétil),
perda de libido,
onadas de calor,
suor excessivo.
Frequentes– ocorrem em 1 a 10 doentes em cada 100 doentes tratados:
tonturas,
aumento da pressão arterial,
dores ósseas,
fadiga,
dores no local da injeção.
Pouco frequentes– ocorrem em 1 a 10 doentes em cada 1000 doentes tratados:
diminuição do apetite,
insónia,
parestesias (sensação de formigamento, picadas ou dormência),
náuseas,
constipação,
secura na boca,
perda de cabelo,
dores nas costas,
ginecomastia.
Frequência desconhecida– não pode ser estimada com base nos dados disponíveis:
infecção do trato respiratório superior (resfriado),
dispneia (respiração difícil) na posição deitada,
reações anafiláticas,
hipersensibilidade,
sangramento nasal,
aumento do apetite,
dores abdominais,
gotas (artrite),
diarreia,
diabetes,
vómitos,
depressão,
inchaço abdominal,
mudanças de humor,
inchaço,
confusão,
acne,
diminuição da atividade,
prurido,
humor eufórico,
erupções cutâneas,
ansiedade,
vesículas cutâneas,
apatia,
edema angioneurótico (inchaço que ocorre sob a pele),
dores de cabeça,
distúrbios da memória,
urticária,
distúrbios do paladar,
petéquias (manchas purpúricas na pele),
sonolência,
dores musculoesqueléticas,
dificuldade em ficar de pé,
dores nas pernas,
anomalias visuais,
dores articulares,
visão turva,
espasmos musculares,
visão embaçada,
fraqueza muscular,
zumbido nos ouvidos,
dores musculares,
distúrbios do equilíbrio,
rigidez articular,
diminuição da pressão arterial,
edema articular,
dispneia (respiração difícil),
rigidez musculoesquelética,
Página 4 de 9
osteíte (inflamação do osso),
sintomas gripais,
dores no peito,
febre,
atrofia testicular,
mal-estar,
dores testiculares,
mudanças no ECG (prolongamento do intervalo QT),
ausência de ejaculação,
irritabilidade,
fraqueza,
aumento da atividade de certas enzimas hepáticas,
vermelhidão no local da injeção,
inflamação no local da injeção,
aumento do nível de creatinina no sangue,
reação no local da injeção,
aumento do nível de ureia no sangue,
edema,
aumento da pressão arterial,
dores,
aumento da temperatura corporal,
calafrios,
aumento de peso,
diminuição de peso.
Nas mulheres:
No início do tratamento, os sintomas da endometriose, incluindo dores pélvicas e dores menstruais,
podem piorar frequentemente devido ao aumento inicial e transitório do nível de estradiol no sangue.
Esses sintomas são temporários e geralmente desaparecem dentro de uma a duas semanas.
Muito frequentes– ocorrem em mais de 1 doente em cada 10 doentes tratados:
dores mamárias,
diminuição da libido,
distúrbios do sono,
onadas de calor,
suor excessivo,
sangramento ou manchas vaginais,
secura vaginal,
dores de cabeça.
Frequentes– ocorrem em 1 a 10 doentes em cada 100 doentes tratados:
hiperandrogenismo,
mudanças de humor,
ansiedade,
insónia,
depressão,
humor depressivo,
tonturas,
palpitações,
sintomas do trato respiratório superior,
náuseas,
dispepsia,
distúrbios gastrointestinais,
dores abdominais,
perda de cabelo,
dores articulares,
dores durante as relações sexuais,
distúrbios mamários,
fadiga,
fraqueza,
irritabilidade,
aumento de peso,
alterações de peso.
Pouco frequentes– ocorrem em 1 a 10 doentes em cada 1000 doentes tratados:
parestesias (sensação de formigamento, picadas ou dormência),
distúrbios do equilíbrio,
dores nas costas,
dores ósseas,
Strona 5 de 9
espasmos musculares,
edema,
dores no local da injeção,
reação no local da injeção,
aumento da pressão arterial.
Raro– ocorrem em 1 a 10 doentes em cada 10 000 doentes tratados:
vómitos,
dores musculares,
sangramento menstrual excessivo,
dores pélvicas.
Frequência desconhecida– não pode ser estimada com base nos dados disponíveis:
hipersensibilidade,
prurido cutâneo
reações anafiláticas,
erupções cutâneas
distúrbios abdominais
urticária
febre
mal-estar
dores menstruais,
diarreia
sangramento entre os períodos menstruais,
fraqueza muscular,
visão embaçada,
edema angioneurótico (inchaço que ocorre sob a pele),
visão turva,
dispneia (respiração difícil),
amenorreia (ausência de menstruação)
confusão,
dores no peito,
inflamação no local da injeção,
vermelhidão no local da injeção
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados no
folheto, deve informar o seu médico. Os efeitos não desejados podem ser notificados diretamente ao
Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de
Medicamentos: Rua [inserir rua], [inserir cidade], Telefone: [inserir telefone], Fax: [inserir fax] ou no
endereço [inserir endereço].
Os efeitos não desejados também podem ser notificados ao responsável pelo medicamento.
A notificação de efeitos não desejados pode ajudar a obter mais informações sobre a segurança do
medicamento.
5. Como conservar Decapeptyl Depot
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não use este medicamento após o prazo de validade impresso na embalagem após a expressão EXP.
O prazo de validade é o último dia do mês indicado.
Conservar na geladeira (2°C – 8°C). Conservar na embalagem original.
Os medicamentos não devem ser jogados na canalização ou nos contentores de lixo doméstico. Deve
perguntar ao farmacêutico como eliminar os medicamentos que já não são necessários. Essa ação ajudará a
proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Decapeptyl Depot
- Substância ativa do medicamento é a triptorelina na dose de 3,75 mg
- Outros componentes são: Pó: poli(ácido láctico e ácido glicólico) 1:1 e dicaprilato de glicerol propileno
Página 6 de 9
Solvente: Polissorbato 80, Dextrana 70, cloreto de sódio, dihidrogenofosfato de sódio diidratado, hidróxido de
sódio e água para injeção.
Como é Decapeptyl Depot e que conteúdo tem a embalagem
Decapeptyl Depot é um pó e solvente para suspensão injetável.
O pó tem cor branca a ligeiramente amarelada.
O solvente é um líquido transparente e incolor.
Após a mistura do pó com o solvente, deve ser obtida uma suspensão homogênea, de cor branca a
ligeiramente amarelada.
Está disponível uma única apresentação da embalagem: 1 seringa pré-cheia com pó, 1 seringa pré-cheia
com solvente, 1 conector de polipropileno e 1 agulha para injeção, tudo em uma caixa de cartão.
Responsável e fabricante:
Ferring GmbH
Wittland 11
D-24109 Kiel
Alemanha
Para obter informações mais detalhadas, deve contactar o representante do responsável pelo medicamento:
Ferring Pharmaceuticals Portugal, Lda.
Rua [inserir rua], [inserir cidade]
Telefone: [inserir telefone], Fax: [inserir fax]
Data da última atualização do folheto: ---------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Instruções para o médico sobre a preparação, reconstituição e injeção da suspensão.
Como a preparação correta da suspensão é crucial para a eficácia terapêutica do produto, deve seguir
estrictamente as seguintes instruções:

Informação importante :
DECAPEPTYL Depot deve ser armazenado na embalagem na geladeira.
DECAPEPTYL Depot deve ser injetado dentro de 3 minutos após a preparação.
Revisão dos componentes do kit DECAPEPTYL Depot:



Página 7 de 9
1. Preparação
Para garantir a preparação correta da suspensão, deve seguir as instruções:
Retirar a embalagem
DECAPEPTYL Depot da
geladeira.
Abrir a embalagem
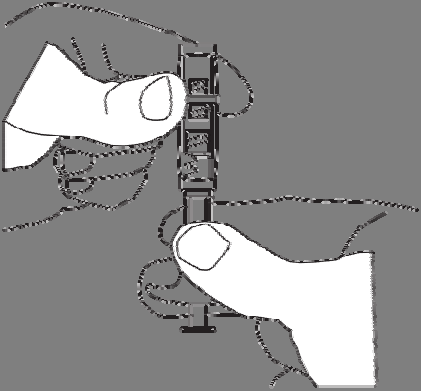
do conector e retirar o conector.
Remover a tampa da seringa com o pó. Segurar
a seringa com a abertura para cima, para evitar
derramar o pó.
Enrosar a seringa com o pó em um dos filetes do
conector até o fim.



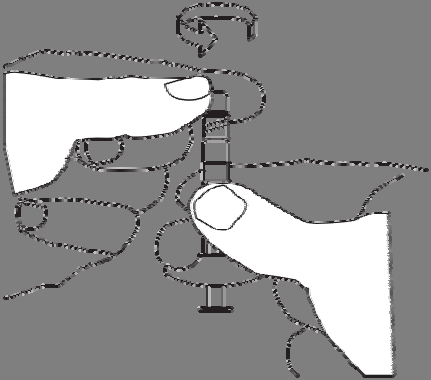
Sempre deve conectar a seringa com o pó ao
conector, e em seguida
a seringa com o
solvente.
Remover a tampa da seringa com o solvente.
Segurar a seringa
com a abertura para cima,
para evitar derramar o líquido.
Não deve tocar no filete do conector.
Não deve pressionar o êmbolo da seringa.







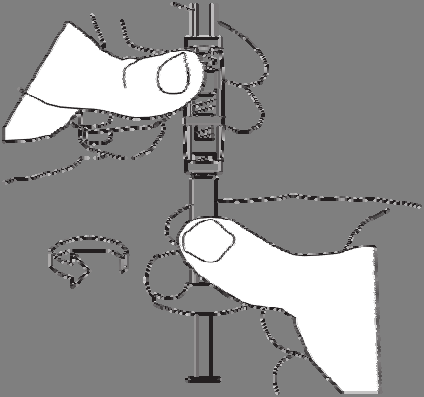
Enrosar a seringa com o solvente no filete livre do
conector, até o fim.

Não deve pressionar o êmbolo da seringa.
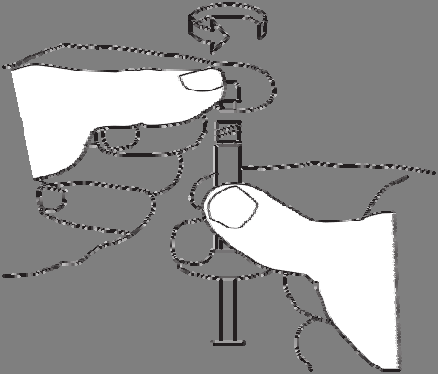


2. Reconstituição da suspensão
Para preparar a suspensão, deve:
Empurrar o líquido para a seringa com o pó.
Transferir lentamente a suspensão entre as duas seringas e o conector até que seja obtida uma suspensão
homogênea, de cor branca a ligeiramente amarelada.
As seringas devem ser seguradas retas, não dobradas.
Página 8 de 9
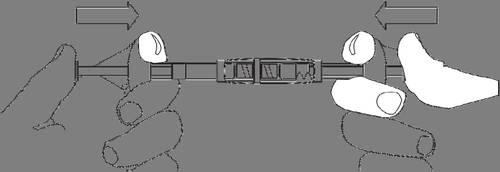
3. Injeção
Remover a seringa com a suspensão pronta para injeção do conector.
Fixar a agulha à seringa.
Realizar a injeção dentro de 3 minutos.
DECAPEPTYL Depot é para uso único e qualquer suspensão não utilizada deve ser descartada.
Página 9 de 9
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorFerring GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Decapeptil DepotForma farmacêutica: Solução, 0.1 mg/mlSubstância ativa: triptorelinFabricante: Ferring GmbHRequer receita médicaForma farmacêutica: Pó, 0,1 mgSubstância ativa: triptorelinFabricante: Ipsen Pharma Biotech SASRequer receita médicaForma farmacêutica: Pó, 11,25 mgSubstância ativa: triptorelinFabricante: Ipsen Pharma Biotech SASRequer receita médica
Alternativas a Decapeptil Depot noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Decapeptil Depot em Ukraine
Alternativa a Decapeptil Depot em Spain
Médicos online para Decapeptil Depot
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Decapeptil Depot – sujeita a avaliação médica e regras locais.











