TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL
Pergunte a um médico sobre a prescrição de TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL

Como usar TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Trangorex 150 mg / 3 ml solução injetável
amiodarona hidrocloruro
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, ainda que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Trangorex e para que é utilizado
- O que precisa saber antes de começar a usar Trangorex
- Como usar Trangorex
- Possíveis efeitos adversos
- Conservação de Trangorex
- Conteúdo do envase e informações adicionais
1. O que é Trangorex e para que é utilizado
Trangorex pertence a um grupo de medicamentos conhecidos como agentes antiarrítmicos (utilizados para controlar o ritmo cardíaco rápido ou irregular).
Trangorex é utilizado para tratar alterações graves do ritmo cardíaco quando o paciente não responde a outros antiarrítmicos ou quando os medicamentos alternativos não se toleram. É administrado em casos de:
- Taquiarritmias associadas ao síndrome de Wolff-Parkinson-White.
- Prevenção da reaparição da fibrilação e flutter auricular.
- Todos os tipos de taquiarritmias de natureza paroxística, incluindo: taquicardias supraventricular, nodal e ventricular, fibrilação ventricular.
A via intravenosa será utilizada quando for necessária uma resposta rápida. Deve ser utilizada em unidades com meios adequados para a monitorização cardíaca e a reanimação cardiopulmonar.
2. O que precisa saber antes de começar a usar Trangorex
Não use Trangorex
- Se é alérgico ao iodo, amiodarona ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6).
- Se possui uma frequência cardíaca baixa (bradicardia sinusal) ou padece outras alterações do ritmo ou da condução cardíaca (bloqueio sinoauricular, doença do nódulo sinusal, alterações graves da condução auriculoventricular), a menos que um marcapasso seja implementado.
- Se padece doença do seio do coração e não se lhe implantou um marcapasso. Se sofre colapso cardiovascular ou hipotensão arterial grave.
- Se padece alguma doença relacionada com a glândula tireoide.
- Se está grávida, excepto em circunstâncias especiais ou em período de amamentação (ver apartado “Gravidez e amamentação”).
- Em associação com medicamentos que possam produzir “torsades de pointes” (problemas graves do ritmo cardíaco): ver apartado “Uso de Trangorex com outros medicamentos”.
Se padece hipotensão (tensão arterial baixa), insuficiência respiratória grave, miocardiopatia, insuficiência cardíaca ou parada cardíaca, não deve administrar-se este medicamento em forma de injeção intravenosa.
Todas as contraindicações acima mencionadas não se aplicam quando o médico utilize amiodarona para a ressuscitação cardiopulmonar (situação em que o paciente sofreu uma parada cardiorrespiratória) no tratamento de fibrilação ventricular resistente à desfibrilhação.
Advertências e precauções
Amiodarona por via injetável deve ser utilizada apenas em meio hospitalar especializado e sob controle permanente (eletrocardiograma, tensão arterial).
A administração intravenosa (direta) deve limitar-se às situações de urgência quando as demais alternativas terapêuticas falharem.
A diminuição do ritmo cardíaco pode ser mais pronunciada em pacientes maiores de 65 anos.
Há casos em que se podem produzir novas arritmias ou agravar as arritmias tratadas. Isso costuma acontecer quando se associa com outros medicamentos ou com alterações dos eletrólitos (como, por exemplo, as alterações dos níveis de cálcio no sangue). Nesses casos, deve avaliar-se a retirada do tratamento com este medicamento.
Deve tomar-se especial precaução em caso de hipotensão, insuficiência respiratória grave, insuficiência cardíaca grave ou miocardiopatia descompensada.
Consulte o seu médico ou farmacêutico antes de começar a usar Trangorex se tomar atualmente um medicamento que contém sofosbuvir para o tratamento da hepatite C, porque pode provocar uma diminuição da frequência cardíaca potencialmente mortal. O seu médico pode considerar outros tratamentos alternativos. Se for necessário tratamento com amiodarona e sofosbuvir, pode precisar de monitorização cardíaca adicional.
Consulte imediatamente o seu médico se está tomando um medicamento que contém sofosbuvir para o tratamento da hepatite C e durante o tratamento experimenta:
- batimentos lentos ou irregulares ou problemas do ritmo cardíaco;
- falta de ar ou piora da falta de ar existente;
- dor no peito;
- sensação de tontura;
- palpitações;
- desmaio ou estar a ponto do mesmo.
Durante o tratamento, o seu médico pode indicar a realização de testes: radiografia de tórax (para descartar que se produzam complicações respiratórias), determinação das transaminases mediante análise de sangue (antes de iniciar o tratamento e regularmente enquanto durar o tratamento, para controlar que o seu fígado funciona corretamente), e níveis no sangue de potássio.
Consulte o seu médico no caso de que apareçam alterações da vista: visão borrosa, diminuição da visão, visão de halos de cor, sensação de névoa. Se aparecer algum desses problemas, deve praticar-se um exame completo da vista.
Anestesia: antes de uma intervenção cirúrgica, deve advertir-se o anestesista que o paciente está a tomar amiodarona.
Durante o tratamento, podem aparecer alterações na pele (reações bulhosas graves) como o Síndrome de Stevens-Johnson ou como a necrólise epidérmica tóxica, que podem ser muito graves ou até fatais (ver secção 4). Se aparecerem sintomas ou sinais do Síndrome de Stevens-Johnson ou da necrólise epidérmica tóxica (erupção cutânea progressiva, muitas vezes com bolhas ou lesões das mucosas), o tratamento com amiodarona deve interromper-se imediatamente.
Não se estabeleceu a segurança e eficácia de amiodarona em crianças, por isso não se recomenda a administração de amiodarona em crianças.
Recentemente, foram comunicados casos de toxicidade no fígado após a administração intravenosa que poderiam dever-se ao dissolvente (polissorbato 80) mais do que ao próprio medicamento.
Antes de iniciar o tratamento com amiodarona, no caso de que os níveis no sangue de potássio sejam baixos, estes devem corrigir-se.
Se está numa lista de espera para transplante de coração, o seu médico pode mudar o tratamento. Isso deve-se ao facto de que tomar amiodarona antes do transplante de coração demonstrou um maior risco de uma complicação ameaçadora para a vida (disfunção primária do enxerto) em que o coração transplantado deixa de funcionar corretamente dentro das primeiras 24 horas após a cirurgia.
Uso de Trangorex com outros medicamentos
Este medicamento pode alterar a resposta de outros medicamentos; por isso, deve informar o seu médico se está a tomar ou tomou recentemente qualquer outro medicamento, mesmo os adquiridos sem receita. O seu médico decidirá que medicação deve abandonar ou se deve modificar a dose.
1- Medicamentos que podem induzir torsades de pointes(problemas graves do ritmo cardíaco) ou prolongação do intervalo QT:
- Medicamentos que induzem torsades de pointes
Está contraindicado o tratamento associado com medicamentos que possam induzir torsades de pointes:
- Medicamentos utilizados para controlar o ritmo irregular do coração, como os medicamentos antiarrítmicos de Classe Ia (quinidina, hidroquinidina, disopiramida), sotalol, bepridil.
- Medicamentos não antiarrítmicos, como vincamina (utilizada para aumentar a quantidade de oxigénio no cérebro), alguns medicamentos neurolépticos (medicamentos que têm um efeito sedante e que diminuem a ansiedade, como a clorpromazina, levomepromazina, tioridazina, trifluoperazina, haloperidol, amisulprida, sulpirida, tiaprida, pimozida), cisaprida (utilizada para tratar o refluxo esofágico), eritromicina intravenosa (antibiótico), pentamidina (quando este antibiótico é administrado por via parenteral), porque há um maior risco de torsades de pointespotencialmente fatais.
- Medicamentos que prolongam o intervalo QT
A administração de amiodarona juntamente com medicamentos que prolongam o intervalo QT deve basear-se numa cuidadosa avaliação dos riscos e benefícios para cada paciente, porque o risco de torsades de pointespode aumentar. Deve monitorizar-se a prolongação do intervalo QT.
Também deve evitar-se o uso de um tipo de antibióticos (fluorquinolonas) durante o tratamento com amiodarona.
2 - Medicamentos que reduzem o ritmo cardíaco ou produzem automaticidade ou distúrbios da condução:
Não se recomenda o tratamento com os seguintes medicamentos:
- Com outros antiarrítmicos (para controlar o ritmo irregular do coração) ou medicamentos que pudessem produzir arritmia (alteração do ritmo do coração, como fenotiazinas, antidepressivos tricíclicos, terfenadina).
- Beta-bloqueantes e inibidores dos canais de cálcio que diminuem a frequência cardíaca (verapamilo, diltiazem).
- Sofosbuvir, utilizado para o tratamento da hepatite C.
3- Agentes que podem induzir hipopotasemia:
O tratamento combinado com os seguintes medicamentos não é recomendado:
- Laxantes estimulantes que podem induzir diminuição dos níveis de potássio no sangue e, por isso, aumentar o risco de torsades de pointes.
Deve ter especial cuidado quando amiodarona se combina com os seguintes medicamentos:
- Diuréticos que diminuem os níveis de potássio no sangue sozinhos ou associados, corticosteroides, tetracosactida (utilizada para diagnosticar problemas suprarrenais e para tratar a colite ulcerosa), anfotericina B por via intravenosa (antibiótico).
- Anticoagulantes orais: (acenocumarol, warfarina, dabigatrán) porque aumenta o risco de hemorragia.
- Digitálicos (utilizados para tratar a insuficiência cardíaca), fenitoína (antiepiléptico), flecainida (para tratar problemas do ritmo do coração), fentanilo (para tratar a dor), lidocaína (para tratar a dor), sildenafilo (para tratar problemas de ereção do pênis), midazolam (relaxante muscular e antiepiléptico), triazolam (para tratar a ansiedade), dihidroergotamina (para tratar as enxaquecas), ergotamina (para tratar as enxaquecas), colchicina (para tratar a gota), porque pode aparecer um aumento das concentrações no sangue destes medicamentos.
- Ciclosporina, tacrolimus e sirolimus (utilizados para ajudar a prevenir a rejeição de transplantes), porque pode aumentar o efeito destes medicamentos.
- Estatinas, como a simvastatina, atorvastatina e lovastatina (medicamentos utilizados para diminuir os níveis altos de gorduras no sangue, principalmente colesterol e triglicéridos), porque aumenta o risco de toxicidade no músculo (por exemplo, rabdomiólise, uma doença que se caracteriza pela descomposição do tecido muscular).
Anestesia geral
Foram observadas complicações potencialmente graves após a associação com anestésicos gerais.
Amiodarona contém iodo e pode interferir na captação de iodo marcado. No entanto, os testes da tireoide (T3 livre, T4 livre e TSHus) continuam a ser interpretáveis.
Recomenda-se evitar tomar sumo de toranja durante o tratamento com amiodarona, porque se podem aumentar os níveis de amiodarona.
Comunique ao seu médico ou farmacêutico se está a tomar, tomou recentemente ou poderia ter que tomar qualquer outro medicamento.
Gravidez e amamentação
Em caso de gravidez, não deve administrar-se Trangorex, salvo se os benefícios superam os riscos, porque afeta a glândula tireoide do feto. Informe o seu médico se está grávida ou acredita que possa estar grávida.
Em caso de amamentação, não deve administrar-se Trangorex, porque passa para o leite materno em quantidade significativa.
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem a intenção de ficar grávida, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Trangorex contém álcool benzílico
Este medicamento contém 60 mg de álcool benzílico em cada ampola de 3 ml, equivalente a 20 mg/ml.
O álcool benzílico pode provocar reações alérgicas.
O álcool benzílico foi relacionado com o risco de efeitos adversos graves que incluem problemas respiratórios (“síndrome de jadeo”) em crianças pequenas.
Este medicamento não se deve utilizar em recém-nascidos (até 4 semanas de idade) a menos que seja recomendado pelo médico.
Este medicamento não se deve utilizar durante mais de uma semana em crianças menores de 3 anos de idade a menos que seja indicado pelo médico ou farmacêutico.
Consulte o seu médico ou farmacêutico se está grávida ou em período de amamentação. Isso deve-se ao facto de que se podem acumular grandes quantidades de álcool benzílico no seu organismo e provocar efeitos adversos (acidose metabólica).
Consulte o seu médico ou farmacêutico se tem doenças do fígado ou rim. Isso deve-se ao facto de que se podem acumular no organismo grandes quantidades de álcool benzílico e provocar efeitos adversos (acidose metabólica).
3. Como usar Trangorex
O tratamento só se iniciará sob supervisão do médico especialista. Em caso de dúvida, consulte novamente o seu médico.
A administração intravenosa direta em bolo está geralmente desaconselhada devido aos riscos hemodinâmicos (hipotensão grave, colapso cardiovascular); por isso, sempre que for possível, é preferível a administração mediante perfusão intravenosa. A administração intravenosa direta deve limitar-se a situações de urgência.
Não adicione qualquer outro produto na mesma seringa. Não administre outras preparações na mesma linha. Em caso de que o tratamento deva prolongar-se, inicie uma perfusão contínua.
Os médicos ou profissionais do sector sanitário devem consultar o apartado “INFORMAÇÃO PARA O PERSONAL SANITÁRIO” no final deste prospecto.
Em pacientes maiores de 65 anos, recomenda-se começar com a dose mais baixa, tendo em conta a função cardíaca, renal e hepática do paciente, bem como qualquer outra doença ou medicação que se esteja a tomar.
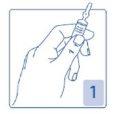
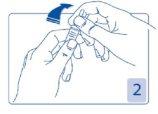
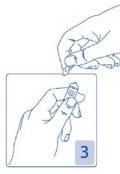
Abertura da ampola
|
|
|
Segure firmemente a ampola, com o ponto colorido a olhar para si (Figura 1).
Segure a cabeça da ampola entre o dedo polegar e o índice (o polegar sobre o ponto colorido); depois, pressione para trás (Figura 2 e 3).
Uso em crianças e adolescentes
Os medicamentos administrados por via intravenosa que contêm álcool benzílico devem ser utilizados com precaução em crianças menores de 3 anos (ver também “Trangorex contém álcool benzílico”).
Os dados sobre a segurança e eficácia em crianças são limitados. O seu médico decidirá a dose apropriada.
Siga estas instruções a menos que o seu médico lhe tenha dado outras instruções distintas.
Consulte o seu médico ou farmacêutico se tiver dúvidas.
Se usar mais Trangorex do que deve
Se recebeu mais medicamento do que devia, deve receber tratamento sintomático. Nem amiodarona nem os seus metabolitos se eliminam através de diálise.
Em caso de sobredosagem ou ingestão acidental, consulte o Serviço de Informação Toxicológica, telefone 91 562 04 20, indicando o medicamento e a quantidade tomada.
4. Possíveis efeitos adversos
Tal como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos observados de acordo com a sua frequência de apresentação, muito frequentes (podem afetar mais de 1 em cada 10 pessoas); frequentes (podem afetar até 1 em cada 10 pessoas); pouco frequentes (podem afetar até 1 em cada 100 pessoas); raros (podem afetar até 1 em cada 1.000 pessoas); muito raros (podem afetar até 1 em cada 10.000 pessoas); frequência não conhecida (não se pode estimar a frequência a partir dos dados disponíveis), foram:
Do sangue e do sistema linfático:
- Frequência não conhecida: O paciente pode ter mais infecções do que o habitual. Isso pode dever-se a uma diminuição no número de glóbulos brancos (neutropenia). Redução grave no número de glóbulos brancos que torna mais prováveis as infecções (agranulocitose).
Cardíacos:
- Frequentes: Ritmo cardíaco débil (bradicardia) de forma moderada que varia em função da dose administrada.
- Muito raros: Ritmo cardíaco débil (bradicardia) de forma acentuada. Em alguns casos, principalmente em pacientes com disfunção sinusal e/ou maiores de 65 anos, requer a supressão do tratamento. Aparição ou piora da arritmia (mudança no ritmo cardíaco), às vezes seguida de parada cardíaca. Estes efeitos ocorrem com menor frequência do que com a maioria dos outros antiarrítmicos e são observados, geralmente, com certas associações medicamentosas ou distúrbios eletrolíticos. Alterações da condução do impulso nervoso do coração.
- Frequência não conhecida: Torsades de pointes.
Endócrinos:
- Muito raros:Sensação de mal-estar, confusão ou fraqueza, náuseas (vontade de vomitar), perda de apetite, irritabilidade. Estes podem ser sintomas inativos de uma doença chamada “síndrome de secreção inadequada de hormona antidiurética (SIADH)”.
- Frequência não conhecida:Hipertireoidismo (quando as glândulas tireoides produzem mais hormona tireoidiana do que o corpo precisa).
Oculares:
- Muito raros: Inflamação do nervo óptico (neurite óptica) que pode progredir para cegueira (ver seção 2, “Advertências e precauções”).
Gastrointestinais:
- Muito raros: Náuseas.
- Frequência não conhecida: Inflamação súbita do pâncreas (pancreatite aguda).
Gerais e no local de administração:
- Frequentes: No ponto de injeção pode aparecer dor, manchas vermelhas (eritema), inchaço da pele por acumulação de líquido (edema), enegrecimento (necrose), saída de líquido (extravasação), acumulação de líquido (infiltração), inflamação, endurecimento (induração), inflamação das veias (flebite, tromboflebite), celulite, infecção, mudanças na pigmentação. Pode ser evitado com a colocação de um catéter central.
Hepatobiliares:
- Muito raros: Aumento de forma isolada e muitas vezes moderada das transaminases (relacionadas com a função do fígado) no início do tratamento. Isso pode remitir ao reduzir as doses ou mesmo de forma espontânea. Alterações agudas do fígado com aumento no sangue das transaminases e/ou coloração amarela da pele (icterícia), que podem pôr em perigo a vida.
A aparência de reações adversas com amiodarona é frequente, particularmente a nível cardíaco, pulmonar e hepático. Em ocasiões, estas manifestações estão relacionadas com a dose e reverteram após uma redução da dose.
Sistema imunológico:
- Muito raros: Reação alérgica grave que pode pôr em perigo a vida (choque anafilático).
- Frequência não conhecida: Também pode ocorrer inchaço por acumulação de líquido sob a pele (Edema de Quincke).
Musculares e esqueléticos:
- Frequência não conhecida: Dor de costas.
Sistema nervoso:
- Muito raros: Aumento da tensão craniana de tipo benigno, dor de cabeça.
Psiquiátricos:
- Frequentes:Diminuição do desejo sexual.
- Frequência não conhecida: Estado de confusão (delírio). Ver, ouvir ou sentir coisas que não existem (alucinações).
Respiratórios:
- Muito raros: Pneumonia ou fibrose (doença pulmonar na qual se forma tecido fibroso), em ocasiões mortais (ver seção 2, “Advertências e precauções”), complicações respiratórias graves. Contracção dos músculos bronquiais (broncoespasmo) e/ou falta de respiração (apneia) em caso de insuficiência respiratória grave, principalmente em pacientes asmáticos. Geralmente são reversíveis após finalizar o tratamento.
Da pele e do tecido subcutâneo:
- Frequentes: Rash pruriginoso avermelhado (eczema).
- Muito raros:Sudorese.
- Frequência não conhecida:Urticária, que se caracteriza pela aparência de ronchas, irritação e coceira da pele. Reações cutâneas ameaçadoras para a vida caracterizadas por erupção cutânea, bolhas, descamação e dor (necrólise epidérmica tóxica (NET)), síndrome de Stevens-Johnson (SSJ), dermatite bolhosa, reação ao medicamento com eosinofilia e sintomas sistémicos (DRESS).
Vasculares:
- Frequentes: Diminuição da tensão da sangue, geralmente moderada e de forma transitória. Em caso de sobredose ou de uma injeção muito rápida pode aparecer hipotensão grave ou colapso.
- Muito raros: Sofocos.
Lesões traumáticas, intoxicações e complicações de procedimentos terapêuticos:
- Frequência não conhecida:Complicação ameaçadora para a vida após o transplante de coração (disfunção primária do enxerto) na qual o coração transplantado deixa de funcionar corretamente (ver seção 2, “Advertências e precauções”).
Se considera que algum dos efeitos adversos que sofre é grave ou se aprecia qualquer outro efeito adverso não mencionado neste prospecto, informe ao seu médico ou farmacêutico.
Comunicação de efeitos adversos:
Se experimenta qualquer tipo de efeito adverso, consulte ao seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Trangorex
Não conservar a temperatura superior a 25 ºC.
Conservar no envase original para protegê-lo da luz.
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de caducidade que aparece no envase e nas ampolas após CAD. A data de caducidade é o último dia do mês que se indica.
Os medicamentos não devem ser jogados pelos desgües nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRe da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se desfazer dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Trangorex
- O princípio ativo é amiodarona hidrocloruro.
- Os demais componentes são: álcool benzílico, polissorbato 80 e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
A solução injetável é um líquido de cor amarela pálida. Apresenta-se em ampolas de vidro incolor. Cada ampola contém 3 ml de solução injetável.
Envase normal: contém 6 ampolas.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização:
sanofi-aventis, S.A.
C/ Roselló i Porcel, 21
08016 Barcelona
Espanha
Responsável pela fabricação:
Delpharm Dijon
6, boulevard de l’Europe
21800 Quétigny (França)
Ou
Sanofi S.r.l.
Via Valcanello, 4
03012 Anagni (FR)
Itália
Data da última revisão deste prospecto: Janeiro 2022
A informação detalhada e atualizada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS): http://www.aemps.gob.es/.
INFORMAÇÃO PARA O PESSOAL SANITÁRIO
Esta informação está destinada unicamente a médicos ou profissionais do setor sanitário.
Ver apartado “Advertências e precauções”.
Posologia e forma de administração
Tratamento de ataque ou inicial, são possíveis duas alternativas:
Perfusão intravenosa
- Dose inicial ou de ataque:a dose habitual é de 5 mg/kg de peso administrada em 250 ml de dextrose a 5% exclusivamente, administrado em um período de 20 minutos a 2 horas. A perfusão pode ser repetida de 2 a 3 vezes em 24 horas. Deve-se ajustar a velocidade de perfusão de acordo com a resposta clínica.
- A ação se manifesta desde os primeiros minutos e vai diminuindo paulatinamente, por isso deve ser instituída uma perfusão de manutenção.
- Dose de manutenção: de 10 a 20 mg/kg de peso/24 horas (geralmente de 600 a 800 mg/24 horas, limite 1.200 mg/24 horas) em 250 ml de dextrose a 5% durante vários dias. Tome o relevo da administração oral desde o primeiro dia de perfusão.
Injeção intravenosa(ver apartado “Advertências e precauções”).
A dose é de 5 mg/kg de peso. A duração da injeção não deve ser nunca inferior a 3 minutos. Não deve ser misturado com outras preparações na mesma seringa.
Resuscitação cardiopulmonar no tratamento de fibrilação ventricular resistente à desfibrilhação: A dose inicial IV é de 300 mg (ou 5 mg/kg de peso) diluídos em 20 ml de dextrose a 5%, e injetados rapidamente. Deve-se ter em conta uma dose IV adicional de 150 mg (ou 2,5 mg/kg de peso) se a fibrilação ventricular persiste.
Exceto em ressuscitação cardiopulmonar, a amiodarona deve ser injetada em um tempo nunca inferior a 3 minutos e não deve ser administrada uma segunda injeção intravenosa direta antes de que passem 15 minutos após a primeira injeção, embora tenha sido administrada apenas uma única ampola (risco de colapso irreversível).
A utilização de equipamento médico ou produtos que contenham material plástico de tipo DEHP (di-2-etilexil ftalato) na presença de amiodarona pode produzir a diluição de dicho material. Com o fim de minimizar a exposição dos pacientes ao DEHP, a diluição final de amiodarona para perfusão deve ser administrada preferivelmente com materiais que não contenham DEHP.
Não adicione nenhum outro produto na mesma seringa. Não administre outras preparações na mesma linha. Em caso de que o tratamento deva ser prolongado, iniciar uma perfusão contínua.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVELForma farmacêutica: COMPRIMIDO, 200 mgSubstância ativa: amiodaroneFabricante: Aurovitas Spain, S.A.U.Requer receita médicaForma farmacêutica: COMPRIMIDO, 200 mgSubstância ativa: amiodaroneFabricante: Sanofi Aventis S.A.Requer receita médicaForma farmacêutica: COMPRIMIDO, 400 mgSubstância ativa: dronedaroneFabricante: Aristo Pharma GmbhRequer receita médica
Alternativas a TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL em Polónia
Alternativa a TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL em Ukraine
Médicos online para TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TRANGOREX 150 mg / 3 ml SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.