RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS

Pergunte a um médico sobre a prescrição de RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS

Como usar RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS
Introdução
Prospecto: informação para o utilizador
Rivastigmina Tevagen 4,6 mg/24 h patches transdérmicos EFG
Rivastigmina Tevagen 9,5 mg/24 h patches transdérmicos EFG
Rivastigmina Tevagen 13,3 mg/24 h patches transdérmicos EFG
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Rivastigmina Tevagen e para que é utilizado
- O que precisa saber antes de começar a usar Rivastigmina Tevagen
- Como usar Rivastigmina Tevagen
- Possíveis efeitos adversos
- Conservação de Rivastigmina Tevagen
- Conteúdo do envase e informações adicionais
1. O que é Rivastigmina Tevagen e para que é utilizado
O princípio ativo de Rivastigmina Tevagen é rivastigmina.
A rivastigmina pertence a uma classe de medicamentos denominados inibidores da colinesterase. Em pacientes com demência de Alzheimer, determinadas células nervosas morrem no cérebro, provocando baixos níveis de neurotransmissores de acetilcolina (uma substância que permite que as células nervosas se comuniquem entre si). A rivastigmina actua bloqueando as enzimas que rompem a acetilcolina: acetilcolinesterase e butirilcolinesterase. Bloqueando estas enzimas, rivastigmina permite o aumento de acetilcolina no cérebro, ajudando a reduzir os sintomas da doença de Alzheimer.
Rivastigmina é utilizado para o tratamento de pacientes adultos com demência de Alzheimer de leve a moderadamente grave, um distúrbio progressivo do cérebro que afeta gradualmente a memória, capacidade intelectual e o comportamento.
2. O que precisa saber antes de começar a usar Rivastigmina Tevagen
Não use Rivastigmina Tevagen
- se é alérgico à rivastigmina (o princípio ativo de Rivastigmina Tevagen) ou a algum dos outros componentes deste medicamento (incluídos na secção 6),
- se alguma vez teve uma reação alérgica a um medicamento semelhante (derivados de carbamato),
- se tem uma reação da pele que se estende além do tamanho do patch, se há uma reação local mais intensa (tais como bolhas, inflamação da pele em aumento, inchaço) e se não há melhoria durante as 48 horas após retirar o patch transdérmico.
Se se encontra em algumas destas situações, informe o seu médico e não use Rivastigmina patches transdérmicos.
Advertências e precauções
Consulte o seu médico antes de começar a usar Rivastigmina
- se tem ou teve alguma vez, alguma doença cardíaca, tais como o ritmo cardíaco (pulso) irregular ou lento, prolongação do QTc, antecedentes familiares de prolongação do QTc, torsade de pointes ou níveis baixos de potássio ou magnésio em sangue,
- se tem ou teve alguma vez úlcera de estômago ativa,
- se tem ou teve alguma vez dificuldades ao urinar,
- se tem ou teve alguma vez convulsões,
- se tem ou teve alguma vez asma ou uma doença respiratória grave,
- se sofre tremores,
- se tem peso corporal baixo,
- se tem reações gastrointestinais, tais como sensação de mal-estar (náuseas), vômitos e diarreia. Pode desidratar-se (perda de grande quantidade de fluido) se os vômitos ou diarreia forem prolongados,
(vômitos) e diarreia. Pode desidratar-se (perda de grande quantidade de fluido) se os vômitos ou diarreia forem prolongados,
se tem problemas do fígado (insuficiência hepática).
Se se encontra em alguma destas situações, pode que o seu médico considere necessário realizar um maior seguimento enquanto estiver em tratamento.
Se não usou os patches durante mais de três dias, não se ponha outro antes de consultar o seu médico. O tratamento com patch transdérmico pode ser reiniciado à mesma dose se o tratamento não for interrompido durante mais de três dias. De outra forma, o seu médico fará reiniciar o tratamento com Rivastigmina Tevagen 4,6 mg/24 h.
Uso em crianças e adolescentes
Rivastigmina Tevagen não deve ser utilizado na população pediátrica no tratamento da doença de Alzheimer.
Outros medicamentos e Rivastigmina Tevagen
Informa o seu médico ou farmacêutico se está utilizando, utilizou recentemente ou poderia ter que utilizar qualquer outro medicamento.
Rivastigmina pode interferir com medicamentos anticolinérgicos, alguns dos quais são medicamentos utilizados para aliviar os cãibras ou espasmos estomacais (por exemplo, diciclomina), para o tratamento da doença de Parkinson (por exemplo, amantadina) ou para prevenir os mareios de viagem (por exemplo, difenhidramina, escopolamina ou meclizina).
Os patches de Rivastigmina não devem ser administrados ao mesmo tempo que metoclopramida (um medicamento utilizado para aliviar ou prevenir as náuseas e os vômitos). A tomada dos dois medicamentos juntos pode causar problemas, como rigidez nas extremidades e tremor de mãos.
Em caso de que tenha que se submeter a uma intervenção cirúrgica enquanto está utilizando Rivastigmina patches transdérmicos, informe o seu médico de que o está utilizando, porque pode potenciar excessivamente os efeitos de alguns relaxantes musculares durante a anestesia.
Deve ter precaução quando se utilizam os patches de Rivastigmina juntamente com beta-bloqueadores (medicamentos, como atenolol, utilizados para tratar a hipertensão, angina e outras afeções cardíacas). A tomada dos dois medicamentos juntos pode causar complicações, como o descenso da frequência cardíaca (bradicardia) que pode dar lugar a desmaios ou perdas de consciência.
Deve ter precaução quando rivastigmina é tomada juntamente com outros medicamentos que podem afetar o seu ritmo cardíaco ou o sistema elétrico do seu coração (prolongação QT).
Gravidez, lactação e fertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou está planeando engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Se está grávida, é necessário avaliar os benefícios do uso de Rivastigmina Tevagen face aos possíveis efeitos adversos para o feto. Não se deve utilizar este medicamento durante a gravidez, a menos que seja claramente necessário.
Não deve amamentar durante o tratamento com Rivastigmina patches transdérmicos.
Condução e uso de máquinas
O seu médico informá-lo-á se a sua doença o permite conduzir ou utilizar maquinaria de forma segura. Rivastigmina patches transdérmicos pode causar tonturas e confusão grave. Se se sentir tonto ou confuso, não conduza nem utilize maquinaria, nem desenvolva outras tarefas que requeiram a sua atenção.
3. Como usar Rivastigmina Tevagen
Siga exatamente as instruções de administração de Rivastigmina Tevagen patches transdérmicos indicadas pelo seu médico. Em caso de dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
IMPORTANTE:
- Retire o patch anterior antes de se pôr UM patch novo.
- Apenas um patch por dia.
- Não corte o patch em pedaços.
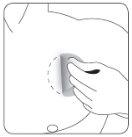
- Pressione firmemente o patch contra a pele com a palma da mão durante um mínimo de 30 segundos.
Como iniciar o tratamento
O seu médico indicar-lhe-á a dose de Rivastigmina patches transdérmicos mais adequada no seu caso.
- Normalmente, começa-se o tratamento com Rivastigmina Tevagen 4,6 mg/24 h.
- A dose recomendada diária habitual é Rivastigmina Tevagen 9,5 mg/24 h. Se esta dose for bem tolerada, o médico que o trata pode considerar aumentar a dose para 13,3 mg/24 h.
- Leve apenas um patch de Rivastigmina ao mesmo tempo e substitua o patch por outro novo a las 24 horas.
Durante o tratamento, o seu médico pode ajustar a dose dependendo das suas necessidades individuais.
Se não usou os patches durante mais de três dias, não se ponha outro antes de consultar o seu médico. O tratamento com patch transdérmico pode ser reiniciado à mesma dose se o tratamento não for interrompido durante mais de três dias. De outra forma, o seu médico fará reiniciar o tratamento com Rivastigmina Tevagen 4,6 mg/24 h.
Rivastigmina pode ser utilizado com alimentos, bebida e álcool
Onde colocar Rivastigmina Tevagen patches transdérmicos
? Antes de se pôr um patch, certifique-se de que a pele esteja limpa, seca e sem pelo, sem pós, óleo, hidratante ou loção que impeçam que o patch se pegue bem à pele, sem cortes, vermelhidão ou irritações.
? Retire cuidadosamente qualquer patch que esteja a usar antes de se pôr um novo.O uso de múltiplos patches no seu corpo pode expô-lo a uma quantidade excessiva deste medicamento e isso pode ser potencialmente perigoso.
? Ponha UMpatch por dia em uma únicadas possíveis zonas, como se mostra nos seguintes diagramas:
- parte superior esquerda ou parte superior direita do braço
- parte superior esquerda ou parte superior direita do peito (evitando os seios)
- parte superior esquerda ou parte superior direita das costas
- parte inferior esquerda ou parte inferior direita das costas
Cada 24 horas, retire o patch anterior antes de se pôr UM patch novo em APENAS UMA das seguintes zonas possíveis.
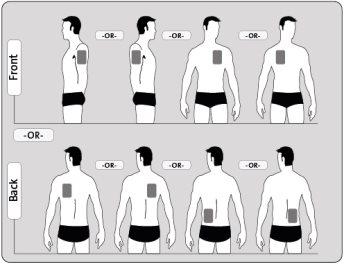
Cada vez que se muda o patch, deve retirar o patch do dia anterior, antes de se pôr o novo em um local diferente da pele cada vez (por exemplo, um dia no lado direito do corpo e no dia seguinte no lado esquerdo; ou um dia na parte superior do corpo e no dia seguinte na parte inferior). Espere pelo menos 14 dias para voltar a se pôr um patch novo exatamente na mesma zona da pele.
Como aplicar Rivastigmina Tevagen patches transdérmicos
Os patches de Rivastigmina Tevagen são finos e de cor castanha que se pegam à pele. Cada patch está em um envelope selado que o protege até que se vá pô-lo. Não abra o envelope nem retire o patch até o momento de se pô-lo.
| Retire cuidadosamente o patch existente antes de se pôr um novo. Os pacientes que iniciam o tratamento pela primeira vez e para os pacientes que reiniciam o tratamento com Rivastigmina Tevagen após a interrupção do tratamento, devem começar pela segunda figura. |
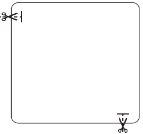
| Cada patch está em um envelope protetor. Apenas se deve abrir o envelope quando se vai pôr o patch. Corte o envelope por onde indicam as marcas de tesoura, mas não mais além da linha indicada. Abra o envelope para rompê-lo. Não corte todo o comprimento do envelope para evitar danificar o patch. Retire o patch do envelope. |
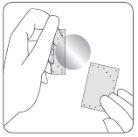
| Uma lâmina protetora cobre o lado adesivo do patch. Retire um lado da lâmina protetora sem tocar com os dedos o lado adesivo do patch. |
| Coloque o lado adesivo do patch sobre a parte superior ou inferior das costas ou no braço ou no peito e, em seguida, retire a segunda folha da lâmina protetora. |
| Pressione firmemente o patch contra a pele com a palma da mão durante um mínimo de 30 segundos e certifique-se de que as bordas se pegaram bem. |
Se isso o ajudar, pode escrever sobre o patch, por exemplo, o dia da semana, com um caneta de ponta fina arredondada.
Deve usar o patch continuamente até o momento de mudá-lo por outro novo. Quando se pôr um novo patch, pode experimentar com diferentes zonas para encontrar as que lhe resultem mais confortáveis e onde a roupa não roce com o patch.
Como retirar Rivastigmina Tevagen patches transdérmicos
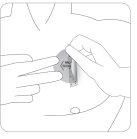
Tire suavemente de um bordo do patch para despegá-lo lentamente da pele. Se restarem resíduos adesivos sobre a pele, embeba a área com água morna e sabão suave ou utilize óleo de bebê para eliminá-los. Não se deve utilizar álcool ou outros líquidos solventes (removedores de esmalte de unhas ou outros solventes).
Depois de retirar o patch, as mãos devem ser lavadas com sabão ou água. Em caso de contato com os olhos ou se os olhos se enrubecem após manipular o patch, deve lavá-los imediatamente com água abundante e pedir conselho médico se os sintomas não se resolverem.
Pode usar Rivastigmina Tevagen patches transdérmicos quando se banha, nada ou se expõe ao sol?
- O banho, a natação ou a ducha não devem afetar o patch. Certifique-se de que não se despega parcialmente enquanto realiza estas atividades.
- Não exponha o patch a uma fonte de calor externa (p. ex., luz solar excessiva, sauna, solário) durante períodos de tempo longos.
O que fazer se se cair um patch
Se se cair um patch, ponha um novo para o resto daquele dia e mude-o no dia seguinte a hora habitual.
Quando e durante quanto tempo deve usar Rivastigmina Tevagen patches transdérmicos
- Para beneficiar-se do tratamento, deve pôr um novo patch todos os dias, preferencialmente à mesma hora.
- Use apenas um patch de Rivastigmina ao mesmo tempo e substitua o patch por outro novo a las 24 horas.
Se usar mais Rivastigmina Tevagen do que deve
Se acidentalmente se pôs mais de um patch, retire todos os patches da pele e informe disso ao seu médico, farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone 91 562 04 20 (indicando o medicamento e a quantidade administrada). É possível que necessite de atenção médica. Algumas pessoas que tomaram acidentalmente quantidades excessivas de rivastigmina por via oral tiveram sensação de mal-estar (náuseas), vômitos, diarreia, tensão alta e alucinações. Pode ocorrer também um atraso na frequência cardíaca e desmaios.
Se esquecer de usar Rivastigmina Tevagen
Se se dar conta de que esqueceu de pôr um patch, ponha-o imediatamente. No dia seguinte, ponha o seguinte patch à hora habitual. Não se ponha dois patches para compensar o que esqueceu.
Se interromper o tratamento com Rivastigmina Tevagen
Informa o seu médico ou farmacêutico se deixar de utilizar os patches.
Se tiver alguma outra dúvida sobre o uso deste produto, pergunte ao seu médico ou farmacêutico.
4. Efeitos adversos possíveis
Tal como todos os medicamentos, Rivastigmina adesivos transdérmicos pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Pode ter efeitos adversos com mais frequência ao começar o seu tratamento ou quando a sua dose for aumentada. Geralmente, os efeitos adversos desaparecerão lentamente à medida que o seu organismo se acostumar com o medicamento.
Se notar algum dos seguintes efeitos adversos que podem ser graves, retire o adesivo e informe imediatamente o seu médico.
Frequentes(podem afetar até 1 em cada 10 pessoas)
- Perda de apetite
- Sensação de tontura
- Sensação de agitação ou adormecimento
- Incontinência urinária (impossibilidade de controlar a urina).
Pouco frequentes(podem afetar até 1 em cada 100 pessoas)
- Problemas com o ritmo do coração, tais como ritmo cardíaco lento
- Ver coisas que realmente não existem (alucinações)
- Úlcera de estômago
- Desidratação (perda excessiva de fluidos)
- Hiperatividade (alto nível de atividade, inquietude)
- Agressividade
Raros(podem afetar até 1 em cada 1.000 pessoas)
- Quedas
Muito raros(podem afetar até 1 em cada 10.000 pessoas)
- Rigidez dos braços e pernas
- Tremor nas mãos
Não conhecidos(a frequência não pode ser estimada a partir dos dados disponíveis)
- Reação alérgica na pele onde o adesivo foi utilizado, tais como, bolhas ou inflamação da pele.
- Piora dos sinais de doença de Parkinson, tais como tremor, rigidez e dificuldade de movimento,
- Inflamação do pâncreas, os sinais incluem dor na parte superior do estômago, frequentemente acompanhada de sensação de malestar (náuseas) ou vômitos.
- Ritmo cardíaco rápido ou irregular
- Pressão arterial alta
- Crisis epilépticas (convulsões)
- Distúrbios hepáticos (coloração amarelada da pele, amarelamento do branco dos olhos, escurecimento anormal da urina ou náuseas inexplicáveis, vômitos, cansaço e perda de apetite)
- Alterações nos exames que mostram o funcionamento do fígado
- Sensação de inquietude
- Pesadelos
- Síndrome de Pisa (uma doença que envolve uma contração muscular involuntária com uma flexão anormal do corpo e da cabeça para um lado
Se notar algum dos efeitos adversos listados acima, retire o adesivo e informe imediatamente o seu médico.
Outros efeitos adversos experimentados com rivastigmina cápsulas ou solução oral e que podem ocorrer com os adesivos:
Frequentes(podem afetar até 1 em cada 10 pessoas)
- Excesso de saliva
- Perda de apetite
- Sensação de cansaço
- Sensação de malestar geral
- Tremor ou sensação de confusão
- Aumento da sudorese
Pouco frequentes(podem afetar até 1 em cada 100 pessoas)
- Frequência cardíaca desigual (por exemplo, frequência cardíaca rápida)
- Dificuldade para dormir
- Quedas acidentais
Raros(podem afetar até 1 em cada 1.000 pessoas)
- Ataques (convulsões)
- Úlcera no intestino
- Dor no peito, causada provavelmente por espasmo no coração
Muito raros(podem afetar até 1 em cada 10.000 pessoas)
- Pressão arterial alta
- Inflamação do pâncreas: os sinais incluem dor grave na parte superior do estômago, frequentemente com sensação de malestar (náuseas) ou vômitos.
- Sangramento gastrointestinal; manifesta-se como sangue nas fezes ou ao vomitar
- Ver coisas que realmente não existem (alucinações)
- Algumas pessoas que estiveram intensamente enjoadas (vômitos) tiveram desgarro de
parte do tubo digestivo que conecta a boca com o estômago (esôfago)
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Rivastigmina Tevagen
- Mantenha este medicamento fora da vista e do alcance das crianças.
- Não utilize este medicamento após a data de validade que aparece na caixa e no sobre após CAD.
A data de validade é o último dia do mês que se indica.
- Este medicamento não requer condições especiais de conservação.
- Conservar o adesivo transdérmico dentro do sobre até o seu uso.
- Não utilize nenhum adesivo se observar que está danificado ou mostra sinais de manipulação.
- Após retirar um adesivo, dobre-o ao meio com o lado adesivo para dentro e pressione. Após introduzi-lo no sobre original, ao se desfazer do adesivo, certifique-se de que fique fora do alcance das crianças. Após retirar o adesivo, não toque os olhos, e lave bem as mãos com água e sabão.
- Os medicamentos não devem ser jogados nos deságues ou na lixeira. Deposite os recipientes e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se desfazer dos recipientes e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informações adicionais
Composição de Rivastigmina Tevagen
O princípio ativo é rivastigmina.
Rivastigmina Tevagen 4,6 mg/24 h adesivos transdérmicos EFG:
Cada adesivo transdérmico libera 4,6 mg de rivastigmina em 24 horas. Cada adesivo transdérmico de 4,3 cm2 contém 6,4 mg de rivastigmina.
Rivastigmina Tevagen 9,5 mg/24 h adesivos transdérmicos EFG
Cada adesivo transdérmico libera 9,5 mg de rivastigmina em 24 horas. Cada adesivo transdérmico de 8,5 cm2 contém 12,8 mg de rivastigmina.
Rivastigmina Tevagen 13,3 mg/24 h adesivos transdérmicos EFG
Cada adesivo transdérmico libera 13,3 mg de rivastigmina em 24 horas. Cada adesivo transdérmico de 12,8 cm2 contém 19,2 mg de rivastigmina.
Os demais componentes são:
Lâmina externa:
polietileno/resina termoplástica /película de poliéster revestida de alumínio
Lâmina reservatório do medicamento:
poli [(2-etilhexil)acrilato, vinilacetato]
Lâmina matriz adesiva:
poliisobuteno de peso molecular médio
poliisobuteno de elevado peso molecular
sílica coloidal anidra
parafina líquida leve
Lâmina de liberação:
película de poliéster (tereftalato de polietileno) revestida de fluoropolímero
Tinta de impressão laranja
Aspecto do produto e conteúdo do envase
Cada adesivo transdérmico, é um adesivo fino de forma circular. A camada externa é de cor marrom e marcada em laranja com o seguinte:
Rivastigmina Tevagen 4,6 mg/24 h adesivos transdérmicos EFG
“RIV-TDS 4.6 mg/24 h”
Rivastigmina Tevagen 9,5 mg/24 h adesivos transdérmicos EFG
“RIV-TDS 9.5 mg/24 h”
Rivastigmina Tevagen 13,3 mg/24 h adesivos transdérmicos EFG
“RIV-TDS 13.3 mg/24 h”
Cada adesivo transdérmico é envasado em um sobre selado.
Rivastigmina Tevagen 4,6 mg/24 h adesivos transdérmicos EFGe Rivastigmina Tevagen 9,5 mg/24 h adesivos transdérmicos EFGestão disponíveis em envases que contêm 7, 30 ou 42 sobres e em multienvases que contêm 60 (2 x 30) ou 84 (2x42) ou 90 (3 x 30) sobres.
Rivastigmina Tevagen 13,3 mg/24 h adesivos transdérmicos EFGestá disponível em envases que contêm 7 ou 30 sobres e em multienvases que contêm 60 (2 x 30) e 90 (3 x 30) sobres.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização
Teva B.V.
Swensweg 5,
2031GA Haarlem,
Países Baixos
Responsável pela fabricação
Luye Pharma AG
Am Windfeld 35
83714 Miesbach,
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Teva Pharma, S.L.U
C/ Anabel Segura, 11, Edifício Albatros B, 1ª planta,
Alcobendas, 28108, Madrid (Espanha)
Este medicamento está autorizado nos Estados Membros do Espaço Econômico Europeucom os seguintes nomes
Áustria | Rivastigmin ratiopharm GmbH 4,6 mg/24 horas adesivo transdérmico Rivastigmin ratiopharm GmbH 9,5 mg/24 horas adesivo transdérmico Rivastigmin ratiopharm GmbH 13,3 mg/24 horas adesivo transdérmico |
Bélgica | Rivastigmine Teva 4,6mg/24 u/h, 9,5mg/24 u/h & 13,3mg/24 u/h adesivo transdérmico para uso transdérmico/ dispositivo transdérmico/ adesivo transdérmico |
Alemanha | Rivastigmin-ratiopharm 4,6 mg/24 horas adesivo transdérmico Rivastigmin-ratiopharm 9,5 mg/24 horas adesivo transdérmico Rivastigmin-ratiopharm 13,3 mg/24 horas adesivo transdérmico |
Islândia | Rivastigmine Teva |
Países Baixos | Rivastigmine Teva 4,6 mg/24 u, adesivo transdérmico para uso transdérmico Rivastigmine Teva 9,5 mg/24 u, adesivo transdérmico para uso transdérmico Rivastigmine Teva 13,3 mg/24 u, adesivo transdérmico para uso transdérmico |
Portugal | Rivastigmina Teva |
Eslovênia | Rivastigmin Teva B.V. 4,6 mg/24 ur adesivo transdérmico Rivastigmin Teva B.V. 9,5 mg/24 ur adesivo transdérmico Rivastigmin Teva B.V.13,3 mg/24 ur adesivo transdérmico |
Espanha | Rivastigmina Tevagen 4,6 mg/24 h adesivos transdérmicos EFG Rivastigmina Tevagen 9,5 mg/24 h adesivos transdérmicos EFG Rivastigmina Tevagen 13,3 mg/24 h adesivos transdérmicos EFG |
Suécia | Rivastigmine Teva |
Data da última revisão deste prospecto:março 2025
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
Pode acessar informação detalhada e atualizada sobre este medicamento escaneando com o seu telefone móvel (smartphone) o código QR incluído no cartonagem. Também pode acessar a esta informação na seguinte direção de internet: https://cima.aemps.es/cima/dochtml/p/86431/P_86431.html
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOSForma farmacêutica: ADESIVO TRANSDÉRMICO, 13,3 mg/24hSubstância ativa: rivastigmineFabricante: Esteve Pharmaceuticals S.A.Requer receita médicaForma farmacêutica: ADESIVO TRANSDÉRMICO, 4,6 mg/24 hSubstância ativa: rivastigmineFabricante: Esteve Pharmaceuticals S.A.Requer receita médicaForma farmacêutica: PENSO TRANSDÉRMICO, 9,5 mg/24hSubstância ativa: rivastigmineFabricante: Esteve Pharmaceuticals S.A.Requer receita médica
Alternativas a RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS em Polónia
Alternativa a RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS em Ukraine
Médicos online para RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de RIVASTIGMINA TEVAGEN 9,5 mg/24h AUTOCLIVANTES TRANSDÉRMICOS – sujeita a avaliação médica e regras locais.