

Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose

Pergunte a um médico sobre a prescrição de Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose

Como usar Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose
Introdução
Prospecto: informação para o utilizador
Dorzolamida/Timolol Stulln PF 20 mg/ml + 5 mg/ml colírio em solução em embalagem unidose
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Dorzolamida/Timolol Stulln PF e para que é utilizado
- O que necessita de saber antes de começar a usar Dorzolamida/Timolol Stulln PF
- Como usar Dorzolamida/Timolol Stulln PF
- Possíveis efeitos adversos
- Conservação de Dorzolamida/Timolol Stulln PF
- Conteúdo do embalagem e informação adicional
1. O que é Dorzolamida/Timolol Stulln PF e para que é utilizado
Dorzolamida/Timolol Stulln PF contém dois medicamentos: dorzolamida e timolol.
- Dorzolamida pertence a um grupo de medicamentos chamados "inibidores da anidrase carbónica".
- Timolol pertence a um grupo de medicamentos chamados "betabloqueantes".
Estes medicamentos diminuem a pressão no olho de diferentes maneiras.
Este medicamento é prescrito para reduzir a pressão ocular elevada no tratamento do glaucoma quando o uso de um único colírio betabloqueante não seja adequado.
2. O que necessita de saber antes de começar a usar Dorzolamida/Timolol Stulln PF
Não use Dorzolamida/Timolol Stulln PF
- se é alérgico a dorzolamida hidrocloruro, timolol maleato ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se tem agora ou teve no passado problemas respiratórios, como asma ou bronquite obstructiva crónica grave (doença do pulmão grave que pode causar assobios, dificuldade para respirar e/ou tosse persistente durante muito tempo).
- se tem um batimento cardíaco lento, insuficiência cardíaca ou alterações do ritmo cardíaco (batimentos irregulares do coração).
- se sofre de doença ou distúrbios do rim graves, ou tem antecedentes de pedras nos rins.
- se tem excesso de acidez do sangue causada por um acúmulo de cloretos no sangue (acidose hipoclorémica).
Se não estiver seguro se deve usar este medicamento, consulte o seu médico ou farmacêutico.
Advertências e precauções
Consulte o seu médico antes de começar a usar este medicamento se padece ou padecia no passado:
- cardiopatia coronária (os sintomas podem incluir dor torácica ou opressão no peito, dificuldade para respirar ou afogamento), insuficiência cardíaca, tensão arterial baixa.
- alterações do ritmo cardíaco, tais como enlentecimento do batimento cardíaco.
- problemas respiratórios, asma ou doença pulmonar obstructiva crónica.
- doença por má circulação do sangue (tal como doença de Raynaud ou síndrome de Raynaud).
- diabetes, porque o timolol pode mascarar sinais e sintomas de um descenso de açúcar no sangue.
- hiperatividade da glândula tireoide, porque o timolol pode mascarar sinais e sintomas.
Informe o seu médico, antes de que tenha uma intervenção cirúrgica, que está usando este medicamento, porque o timolol pode alterar os efeitos de alguns medicamentos usados durante a anestesia.
Também informe o seu médico sobre qualquer alergia ou reações alérgicas, incluindo erupções, inchaço da face, lábios, língua e/ou garganta que pode causar dificuldade na respiração ou ao engolir.
Informe o seu médico se padece fraqueza muscular ou se lhe foi diagnosticada miastenia grave.
Se desenvolver qualquer outra irritação ocular ou problema novo nos olhos, como vermelhidão dos olhos ou inchaço das pálpebras, consulte imediatamente o seu médico.
Se suspeita que este medicamento lhe está causando uma reação alérgica ou hipersensibilidade (por exemplo, erupção cutânea, reação cutânea grave ou vermelhidão e coceira nos olhos), deixe de utilizar este medicamento e consulte imediatamente o seu médico.
Informe o seu médico se se produz uma infecção ocular, se sofre uma lesão no olho, se se submete a uma intervenção cirúrgica ocular ou se desenvolve uma reação que inclua novos sintomas ou agravamento dos existentes.
Quando este medicamento é instilado no olho pode afetar todo o corpo.
Este medicamento não foi estudado em pacientes que usam lentes de contacto.
Se usa lentes de contacto macias, deve consultar com o seu médico antes de usar este medicamento.
Uso em crianças
Dispõe-se de experiência limitada com dorzolamida/timolol, colírio em solução (formulação com conservante) em lactentes e em crianças.
Uso em pacientes de idade avançada
Em estudos com dorzolamida/timolol, colírio em solução (formulação com conservante), os efeitos foram semelhantes tanto nos pacientes de idade avançada como nos mais jovens.
Uso em pacientes com deterioração hepática
Informe o seu médico se sofre ou sofreu problemas do fígado.
Uso em desportistas
Este medicamento contém timolol que pode produzir um resultado positivo nas provas de controlo de dopagem.
Uso de Dorzolamida/Timolol Stulln PF com outros medicamentos
Este medicamento pode afetar ou ser afetado por outros medicamentos que está a usar, incluindo outros colírios para o tratamento do glaucoma. Informe o seu médico se está a usar ou tem intenção de usar medicamentos para reduzir a pressão arterial, medicamentos para o coração ou medicamentos para tratar a diabetes. Informe o seu médico ou farmacêutico se está a utilizar, usou recentemente ou poderia ter que utilizar qualquer outro medicamento. Isto é particularmente importante se está:
- toma medicamentos para reduzir a pressão arterial ou para tratar doenças cardíacas, tais como bloqueadores dos canais de cálcio, betabloqueantes ou digoxina.
- toma medicamentos para tratar uma alteração ou irregularidade do batimento cardíaco, tais como bloqueadores dos canais de cálcio, betabloqueantes ou digoxina.
- usa outro colírio que contém betabloqueantes.
- toma outro inibidor da anidrase carbónica, tal como acetazolamida.
- toma inibidores da monoamino oxidase (IMAO).
- toma um fármaco parasimpaticomimético que poderia ter sido prescrito para ajudar a urinar. Os parasimpaticomiméticos são também um tipo particular de medicamento que, por vezes, é utilizado para ajudar a restaurar os movimentos normais através do intestino.
- toma narcóticos, tais como a morfina utilizada para tratar a dor moderada a grave.
- toma medicamentos para tratar a diabetes.
- toma antidepressivos conhecidos como fluoxetina e paroxetina.
- toma uma sulfamida.
- toma quinidina (usada para tratar distúrbios do coração e alguns tipos de malária).
Gravidez e lactação
Consulte o seu médico ou farmacêutico antes de utilizar qualquer medicamento.
Gravidez
Não use este medicamento se está grávida, a não ser que o seu médico o considere necessário.
Lactação
Não use este medicamento se está a amamentar o seu filho. Timolol pode chegar ao leite materno. Peça ao seu médico conselho antes de tomar qualquer medicamento durante a lactação.
Condução e uso de máquinas
Não se realizaram estudos dos efeitos sobre a capacidade para conduzir ou utilizar máquinas. Há efeitos adversos associados a este medicamento, tais como visão borrosa, que podem afetar a sua capacidade para conduzir e/ou manejar máquinas. Não conduza ou maneje máquinas até que se sinta bem ou a sua visão seja clara.
3. Como usar Dorzolamida/Timolol Stulln PF
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte de novo o seu médico ou farmacêutico. A posologia apropriada e a duração do tratamento serão estabelecidas pelo seu médico.
A dose recomendada é de uma gota no olho ou olhos afectados pela manhã e à noite.
Se está a usar este medicamento ao mesmo tempo que outro colírio, as gotas devem ser instiladas com, pelo menos, 10 minutos de diferença.
Não altere a dose do medicamento sem consultar o seu médico.
Se tem dificuldade na administração das gotas, procure ajuda num membro da família ou cuidador.
Não deixe que a ponta do embalagem unidose toque os olhos ou as zonas que os rodeiam. Isto poderia causar lesão nos olhos. Pode estar contaminada com bactérias capazes de causar infecções oculares que originem graves danos nos olhos, e até a perda da visão. Para evitar uma possível contaminação do embalagem unidose, lave as mãos antes de utilizar este medicamento e evite que a ponta do embalagem entre em contacto com qualquer superfície. O embalagem unidose deve ser aberto imediatamente antes do seu uso. Em caso de que o seu médico lhe tenha indicado usar o colírio em ambos os olhos, um embalagem unidose contém solução suficiente para ambos os olhos.
Elimine o embalagem uma vez aberto imediatamente após o seu uso com o seu conteúdo restante
Instruções de uso
- Lave as mãos.
- Abra o sobrecartão de alumínio e extraia uma tira de embalagens unidose.
- Separe um embalagem unidose da tira (Fig. 1).
- Abra o embalagem unidose girando a ponta. Não toque a ponta após abrir o embalagem (Fig. 2).
- Incline a cabeça para trás (Fig. 3).
- Puxe a pálpebra inferior para baixo com o dedo e segure o embalagem unidose com a outra mão. Aperte o embalagem para que caia uma gota no olho (Fig. 4).
- Feche o olho e pressione com o dedo a esquina interna do olho com o seu dedo durante aproximadamente dois minutos. Isto ajuda a evitar que o medicamento chegue ao resto do corpo (Fig. 5). Se for necessário, repita os passos 5 a 7 com o seu outro olho.
- Elimine o embalagem unidose após o seu uso.
- Volte a colocar as embalagens unidose restantes no sobrecartão e feche o sobrecartão dobrando a borda. Coloque o sobrecartão na caixa. Se restarem embalagens unidose 3 meses após abrir o sobrecartão, devem ser eliminados adequadamente e abrir-se um novo sobrecartão. É importante continuar a usar o colírio segundo o prescrito pelo seu médico.
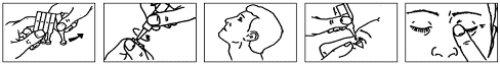
Fig. 1 Fig. 2 Fig. 3 Fig. 4 Fig. 5
Se usar mais Dorzolamida/Timolol Stulln PF do que deve
Se aplicar demasiadas gotas no olho ou engolir algo do conteúdo do embalagem, entre outros efeitos, pode sentir tontura, ter dificuldade para respirar ou notar que o coração lhe bate mais devagar. Contacte o seu médico imediatamente.
Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone: 91 562 04 20. Indicando o medicamento e a quantidade tomada.
Se esquecer de usar Dorzolamida/Timolol Stulln PF
É importante usar este medicamento como lhe foi prescrito pelo seu médico.
Se esquecer de aplicar uma dose, deve administrá-la o mais breve possível. No entanto, se for quase a hora da próxima dose, não se administre a dose esquecida e continue com o programa de doses previsto normalmente.
Não utilize uma dose dupla para compensar as doses esquecidas.
Se interromper o tratamento com Dorzolamida/Timolol Stulln PF
Se quiser interromper o tratamento com este medicamento, consulte primeiro o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Por regra, pode continuar a usar as gotas, a menos que os efeitos sejam graves. Se estiver preocupado, consulte o médico ou farmacêutico. Não deixe de usar este medicamento sem falar com o seu médico.
Podem ocorrer reações alérgicas generalizadas que incluem inchaço debaixo da pele em zonas como a face e as extremidades, e podem obstruir as vias respiratórias, podendo causar dificuldade ao engolir ou ao respirar, erupções ou exantema com coceira, erupção generalizada e localizada, coceira, reação alérgica grave repentina que pode chegar a ser mortal.
As seguintes reações adversas foram notificadas com dorzolamida/timolol, colírio em solução (formulação sem conservante) ou com um dos seus componentes durante os ensaios clínicos ou durante a experiência após a comercialização:
Muito frequentes (podem afectar mais de 1 de cada 10 pessoas)
Queimadura e ardor nos olhos, alteração do sabor.
Frequentes (podem afectar até 1 de cada 10 pessoas)
Vermelhidão em e à volta do olho(s), lagrimeo ou coceira no olho(s), erosão da córnea (dano na camada frontal do globo ocular), inflamação e/ou irritação em e à volta do olho(s), sensação de corpo estranho no olho (sensação de que tem algo no olho), diminuição da sensibilidade da córnea (não aprecia que tem algo no olho e não sente dor), dor no olho, olhos secos, visão borrosa, dor de cabeça, sinusite (sensação de tensão ou congestão no nariz), náuseas, fraqueza/cansaço e fadiga.
Pouco frequentes (podem afectar até 1 de cada 100 pessoas)
Tonturas, depressão, inflamação do íris, alterações da visão, incluindo as modificações da refração (em alguns casos devido à supressão da terapia miótica), diminuição dos batimentos cardíacos, desfalecimento, dificuldade para respirar (dispneia), indigestão, pedras nos rins (por vezes marcado por um início repentino de dor insuportável e cãibras na parte baixa das costas e/ou nos lados, a virilha ou o abdómen).
Raros (podem afectar até 1 de cada 1.000 pessoas)
Lúpus eritematoso sistémico (uma doença imune que pode causar uma inflamação dos órgãos internos), formigamento ou entorpecimento das mãos ou dos pés, insónia, pesadelos, perda de memória, aumento dos sinais e sintomas de miastenia grave (distúrbio muscular), diminuição do desejo sexual, acidente cerebrovascular, miopia transitória que remite ao cessar a terapia, desprendimento da camada de debaixo da retina que contém vasos sanguíneos após a cirurgia de filtração que pode causar alterações visuais, pálpebra caída (fazendo com que o olho permaneça meio fechado), visão dupla, crostas na pálpebra, inchaço da córnea (com sintomas de alterações visuais), pressão baixa no olho, sons de campainhar no ouvido, pressão arterial baixa, alterações no ritmo ou velocidade com que bate o coração, insuficiência cardíaca congestiva (doença do coração com respiração entrecortada e inchaço de pés e pernas devido à acumulação de líquidos), edema (acumulação de líquidos), isquemia cerebral (chegada reduzida de sangue ao cérebro), dor no peito, batimentos cardíacos fortes que podem ser rápidos ou irregulares (palpitações), ataque cardíaco, fenómeno de Raynaud, mãos e pés inchados ou frios e diminuição da circulação nos braços e pernas, cãibras nas pernas e/ou dor de perna quando se caminha (claudicação), dificuldade para respirar, insuficiência respiratória, rinite, sangramento de nariz, constrição das vias respiratórias nos pulmões, tosse, irritação da garganta, boca seca, diarreia, dermatite de contacto, perda de cabelo, erupção cutânea com aparência de cor branco prateado (erupção psoriasiforme), doença de Peyronie (que pode causar um encurvamento do pênis), reações de tipo alérgico, tais como erupção cutânea, urticária, coceira, em raros casos, possível inchaço dos lábios, olhos e boca, sibilância, ou reações cutâneas graves (síndrome de Stevens-Johnson, necrólise epidérmica tóxica).
Como outros medicamentos aplicados nos olhos, timolol é absorvido no sangue. Isto pode causar efeitos secundários semelhantes aos que se observam com os agentes beta-bloqueantes orais. A incidência de efeitos adversos após a administração tópica oftálmica é menor do que quando, por exemplo, os medicamentos são administrados via oral ou injetados. Os seguintes efeitos adversos foram observados com medicamentos betabloqueantes para o tratamento de distúrbios oculares:
Não conhecida (a frequência não pode ser estimada a partir dos dados disponíveis)
Níveis de glicose baixos no sangue, alucinações, insuficiência cardíaca, um tipo de distúrbio do ritmo cardíaco, aumento da frequência cardíaca, aumento da tensão arterial, dor abdominal, vómitos, dor muscular não causada pelo exercício, disfunção sexual.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Dorzolamida/Timolol Stulln PF
Mantenha este medicamento fora da vista e do alcance das crianças.
Não conserve a uma temperatura superior a 30°C.
Conserva no embalagem original para protegê-lo da luz.
Não utilize mais de 3 meses após a primeira abertura do sobrecartão de alumínio.
Este medicamento não contém conservantes. Uma vez aberto, o conteúdo do embalagem unidose deve ser usado imediatamente e não pode ser armazenado. Deve ser eliminado o conteúdo restante no embalagem unidose após a sua aplicação.
Não utilize este medicamento após a data de caducidade que aparece na caixa, no sobrecartão e no embalagem unidose após CAD. A data de caducidade é o último dia do mês que se indica.
Os medicamentos não devem ser deitados fora pelos esgotos nem para o lixo. Deposite os embalagens e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos embalagens e dos medicamentos que não precisa. Deste modo, ajudará a proteger o meio ambiente.
6. Conteúdo do embalagem e informação adicional
Composição deDorzolamida/Timolol Stulln PF
- Os princípios ativos são dorzolamida e timolol.
Cada ml contém 20 mg de dorzolamida (como 22,26 mg de dorzolamida hidrocloruro) e 5 mg de timolol (como 6,83 mg de timolol maleato).
- Os demais componentes são hidroxietilcelulosa (4000 ‑ 5000 mPa·s), manitol, citrato de sódio, hidróxido de sódio (para ajustar o pH) e água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Dorzolamida/Timolol Stulln PF é uma solução transparente, quase incolor, ligeiramente viscosa, praticamente livre de partículas visíveis. Um envase unidose contém 0,2 ml ou 0,3 ml.
Dorzolamida/Timolol Stulln PF encontra-se disponível em envases de 10, 20, 30, 50, 60, 100 ou 120 envases unidose. Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
Pharma Stulln GmbH
Werksstrasse 3
92551 Stulln
Alemanha
Este medicamento está autorizado nos estados-membros do Espaço Económico Europeu com os seguintes nomes:
Áustria: Dorzolamida + Timolol Stulln sine 20 mg/ml + 5 mg/ml colírio, solução em envase unidose
Alemanha: Dorzocomp-Stulln sine 20 mg/ml + 5 mg/ml colírio, solução em envase unidose
França: DORTIRUS 20 mg/ml + 5 mg/ml colírio em solução em recipiente unidose
Grécia: DORZYLEA 20 mg/ml + 5 mg/ml colírio, solução em recipiente unidose
Holanda: Dorzolamida + Timolol Stulln sem conservante 20 mg/ml + 5 mg/ml colírio, solução em embalagem para uso único
Polônia: Dorzolamidum + Timololum Stulln
Espanha: Dorzolamida/Timolol Stulln PF 20 mg/ml + 5 mg/ml colírio em solução em envase unidose
Data da última revisão deste prospecto:Novembro 2023
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (http://www.aemps.gob.es/)
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem UnidoseForma farmacêutica: COLÍRIO, 10 mg/ml + 5 mg/mlSubstância ativa: timolol, combinationsFabricante: Novartis Europharm LimitedRequer receita médicaForma farmacêutica: COLÍRIO, 0,3 mg/ml + 5 mg/mlSubstância ativa: timolol, combinationsFabricante: Brill Pharma S.L.Requer receita médicaForma farmacêutica: COLÍRIO, 0,3 mg/ml + 5 mg/mlSubstância ativa: timolol, combinationsFabricante: Laboratorio Stada S.L.Requer receita médica
Alternativas a Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose em Polónia
Alternativa a Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose em Ukraine
Médicos online para Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Dorzolamida/Timolol Stulln PF 20 mg/mL + 5 mg/mL Colírio em Embalagem Unidose – sujeita a avaliação médica e regras locais.














