
Travoprost + Timolol Medical Vallei
Pergunte a um médico sobre a prescrição de Travoprost + Timolol Medical Vallei

Como usar Travoprost + Timolol Medical Vallei
Folheto informativo para o utilizador
Travoprost + Timolol Medical Valley, 40 microgramas/mL + 5 mg/mL, gotas para os olhos, solução
Travoprosto + Timolol
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Travoprost + Timolol Medical Valley e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Travoprost + Timolol Medical Valley
- 3. Como tomar o medicamento Travoprost + Timolol Medical Valley
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Travoprost + Timolol Medical Valley
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Travoprost + Timolol Medical Valley e para que é utilizado
O medicamento Travoprost + Timolol Medical Valley, sob a forma de solução de gotas para os olhos, é uma combinação de duas substâncias ativas (travoprosto e timolol). O travoprosto é um análogo de prostaglandina que actua aumentando o escoamento do humor aquoso do olho, o que diminui a pressão intraocular. O timolol é um beta-bloqueador que actua diminuindo a produção de humor aquoso dentro do olho. Ambas as substâncias atuam juntas, contribuindo para a diminuição da pressão intraocular.
Travoprost + Timolol Medical Valley, sob a forma de gotas para os olhos, é utilizado para tratar a hipertensão ocular em adultos, incluindo pacientes idosos. Esta pressão pode levar ao desenvolvimento de uma doença chamada glaucoma.
2. Informações importantes antes de tomar o medicamento Travoprost + Timolol Medical Valley
Quando não tomar o medicamento Travoprost + Timolol Medical Valley
- se o doente for alérgico ao travoprosto, prostaglandinas, timolol, medicamentos que bloqueiam os receptores beta-adrenérgicos ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6);
- se o doente tiver ou tiver tido no passado distúrbios respiratórios, tais como asma, doença pulmonar obstrutiva crónica grave (uma doença pulmonar grave que pode causar sibilância, dificuldade em respirar e/ou tosse prolongada) ou outros tipos de distúrbios respiratórios;
- se o doente tiver rinite alérgica grave;
- se o doente tiver bradicardia, insuficiência cardíaca ou distúrbio do ritmo cardíaco (irregularidade da ação cardíaca);
- se a superfície do olho do doente estiver opaca.
Se qualquer um dos estados mencionados acima se aplicar ao doente, deve consultar o médico.
Advertências e precauções
Antes de iniciar o tratamento com o medicamento Travoprost + Timolol Medical Valley, deve discutir com o médico se os seguintes estados de doença ocorrem atualmente ou ocorreram no passado:
- doença coronária (sintomas podem incluir dor ou sensação de pressão no peito, dificuldade em respirar, falta de ar), insuficiência cardíaca, hipotensão;
- distúrbios do ritmo cardíaco, tais como bradicardia;
- dificuldade em respirar, asma ou doença pulmonar obstrutiva crónica;
- doenças com circulação sanguínea alterada (tais como doença de Raynaud ou síndrome de Raynaud);
- diabetes (pois o timolol pode mascarar os sintomas de baixo nível de açúcar no sangue);
- hipertireoidismo (pois o timolol pode mascarar os sintomas objetivos e subjetivos da doença da tiróide);
- miastenia (fraqueza muscular crónica);
- cirurgia de catarata;
- inflamação do olho.
Se o doente for submeter a qualquer cirurgia, deve informar o médico sobre a utilização do medicamento Travoprost + Timolol Medical Valley, pois o timolol pode alterar a ação de alguns anestésicos.
Se o doente apresentar qualquer reação alérgica grave (erupção cutânea, vermelhidão e coceira no olho) durante a utilização do medicamento Travoprost + Timolol Medical Valley, pois o tratamento com adrenalina pode não ser suficientemente eficaz. É importante, portanto, que o doente informe o médico sobre a utilização do medicamento Travoprost + Timolol Medical Valley se for receber qualquer outro tratamento.
Travoprost + Timolol Medical Valley pode alterar a cor da íris (parte colorida do olho);
esta alteração pode ser permanente.
Travoprost + Timolol Medical Valley pode aumentar o comprimento, a espessura, a cor e/ou o número de cílios e pode causar crescimento anormal de cabelo nas pálpebras.
O travoprosto pode ser absorvido pela pele e, portanto, não deve ser utilizado por mulheres grávidas ou que planeiam engravidar. Se alguma quantidade do medicamento entrar em contato com a pele, deve ser lavada imediatamente.
Crianças e adolescentes
O medicamento Travoprost + Timolol Medical Valley não é destinado a ser utilizado em crianças e adolescentes com menos de 18 anos.
Travoprost + Timolol Medical Valley e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar, incluindo medicamentos sem prescrição médica.
O medicamento Travoprost + Timolol Medical Valley pode alterar a ação de outros medicamentos tomados concomitantemente ou estes podem alterar a ação do medicamento Travoprost + Timolol Medical Valley;
isso inclui outros colírios utilizados no tratamento do glaucoma. Deve informar o médico sobre a utilização de medicamentos para reduzir a pressão arterial, medicamentos utilizados no tratamento de doenças cardíacas (incluindo quinidina, utilizada no tratamento de doenças cardíacas e certas formas de malária), medicamentos anti-diabéticos ou medicamentos antidepressivos, tais como fluoxetina ou paroxetina.
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeiar ter um filho, deve consultar o médico antes de tomar este medicamento.
Não deve tomar o medicamento Travoprost + Timolol Medical Valley se estiver grávida, a menos que o médico considere que seja necessário. Se a paciente puder engravidar, deve utilizar métodos adequados de contracepção durante a utilização do medicamento.
Não deve tomar o medicamento Travoprost + Timolol Medical Valley se estiver a amamentar.
Travoprost + Timolol Medical Valley pode passar para o leite materno.
Condução de veículos e utilização de máquinas
Por algum tempo após a instilação do medicamento Travoprost + Timolol Medical Valley, a visão pode estar turva. O medicamento Travoprost + Timolol Medical Valley também pode causar alucinações, tonturas, nervosismo e/ou fadiga.
Não deve conduzir veículos ou operar máquinas até que estes efeitos tenham desaparecido.
Travoprost + Timolol Medical Valley contém cloreto de benzalcônio e hidroxiestearato de macrogol 40
O medicamento contém 150 mg de cloreto de benzalcônio em cada mL de solução.
O cloreto de benzalcônio pode ser absorvido por lentes de contato macias e alterar a sua cor. Deve remover as lentes de contato antes de instilar e esperar pelo menos 15 minutos antes de voltar a colocá-las.
O cloreto de benzalcônio também pode causar irritação nos olhos, especialmente em pessoas com síndrome do olho seco ou distúrbios da córnea (camada transparente da frente do olho). Se ocorrerem sensações anormais nos olhos, coceira ou dor no olho após a utilização do medicamento, deve contactar o médico.
Este medicamento contém hidroxiestearato de macrogol 40, que pode causar reações cutâneas.
3. Como tomar o medicamento Travoprost + Timolol Medical Valley
Este medicamento deve ser sempre utilizado de acordo com as recomendações do médico. Em caso de dúvidas, deve consultar o médico ou farmacêutico.
Dosagem recomendada
Uma gota no saco conjuntival do olho afetado ou olhos, uma vez por dia, de manhã ou à noite. O medicamento deve ser utilizado todos os dias à mesma hora.
O medicamento Travoprost + Timolol Medical Valley pode ser utilizado em ambos os olhos apenas após recomendação do médico.
O medicamento Travoprost + Timolol Medical Valley deve ser utilizado apenas como colírio.
1 |
|
2 |
|
3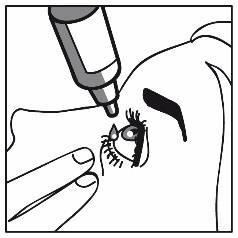 |
|
4 |
|
Utilização de uma dose maior do que a recomendada do medicamento Travoprost + Timolol Medical Valley
Se for utilizada uma dose maior do que a recomendada do medicamento Travoprost + Timolol Medical Valley,
deve lavar os olhos com água morna. Não deve instilar mais medicamento até a hora normal da próxima dose.
Omissão da utilização do medicamento Travoprost + Timolol Medical Valley
Se se esquecer de instilar uma dose do medicamento Travoprost + Timolol Medical Valley, deve continuar a utilizá-lo de acordo com o esquema de doses normal. Não deve instilar uma dose dupla para compensar a dose omitida. A dose do medicamento para o olho afetado (olhos) não deve exceder uma gota por dia.
Interrupção da utilização do medicamento Travoprost + Timolol Medical Valley
Se interromper a utilização do medicamento Travoprost + Timolol Medical Valley sem o acordo do médico, a pressão no olho não será controlada, o que pode levar à perda de visão.
Se estiver a utilizar outros colírios com o medicamento Travoprost + Timolol Medical Valley, deve esperar pelo menos 5 minutos entre a instilação do medicamento Travoprost + Timolol Medical Valley e a utilização de outros colírios.
Se o doente utilizar lentes de contato macias, não deve instilar o medicamento enquanto estiver a usar as lentes de contato. Após a instilação do medicamento, deve esperar 15 minutos antes de colocar as lentes de contato.
Se tiver alguma dúvida adicional sobre a utilização deste medicamento, deve consultar o médico ou farmacêutico.
4. Efeitos não desejados
Como todos os medicamentos, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Geralmente, pode continuar a utilizar as gotas, a menos que os efeitos não desejados sejam graves.
Se tiver preocupações, deve contactar o médico ou farmacêutico. Não deve interromper a utilização do medicamento Travoprost + Timolol Medical Valley sem consultar o médico.
Muito comuns efeitos não desejados(podem afetar mais de 1 em cada 10 pessoas):
Sintomas oculares: vermelhidão do olho.
Comuns efeitos não desejados(podem afetar até 1 em cada 10 pessoas):
Sintomas oculares: inflamação da superfície do olho com dano à superfície do olho, dor no olho, visão turva, visão anormal, secura no olho, coceira no olho, desconforto no olho, sintomas objetivos e subjetivos de irritação do olho (por exemplo, ardor, coceira).
Menos comuns efeitos não desejados(podem afetar até 1 em cada 100 pessoas):
Sintomas oculares: inflamação da superfície do olho, inflamação das pálpebras, inchaço da conjuntiva, crescimento aumentado de cílios, inflamação da íris, inflamação do olho, sensibilidade à luz, visão reduzida, fadiga ocular, alergia ocular, inchaço do olho, aumento da produção de lágrimas, vermelhidão das pálpebras, alterações da cor das pálpebras, escurecimento da pele (ao redor do olho).
Sintomas gerais: reação alérgica à substância ativa, tonturas, dores de cabeça, pressão arterial aumentada ou diminuída, falta de ar, crescimento excessivo de cabelo, corrimento nasal ou sensação de nariz entupido, tosse.
Raros efeitos não desejados(podem afetar até 1 em cada 1000 pessoas):
Sintomas oculares: adelgaçamento da superfície do olho, inflamação das glândulas da pálpebra, ruptura dos vasos sanguíneos no olho, crostas nos cantos das pálpebras, posição anormal dos cílios, crescimento anormal dos cílios.
Sintomas gerais: nervosismo, ritmo cardíaco irregular, perda de cabelo, distúrbios da voz, dificuldade em respirar, tosse, irritação da garganta, erupção cutânea, sintomas de alergia, reações alérgicas graves, incluindo inchaço da pele em áreas como o rosto e os membros, que pode causar dificuldade em respirar e engolir, erupção cutânea generalizada, coceira, reações alérgicas graves e potencialmente fatais.
Desconhecidos(frequência não pode ser estimada com base nos dados disponíveis):
Sintomas oculares: ptose (queda da pálpebra, dando a sensação de que o olho está fechado pela metade), enoftalmia (olhos que parecem mais fundos), alterações da cor da íris (parte colorida do olho).
Sintomas gerais: erupção cutânea, insuficiência cardíaca, dor no peito, acidente vascular cerebral, síncope, depressão, asma, aumento da frequência cardíaca, sensação de formigamento ou dormência, palpitações, inchaço dos membros inferiores, sabor desagradável, alucinações.
Informações adicionais:
O medicamento Travoprost + Timolol Medical Valley é uma combinação de duas substâncias ativas, travoprosto e timolol. O travoprosto e o timolol (um medicamento beta-bloqueador), como outros medicamentos para os olhos, são absorvidos para o sangue. Isso pode levar a efeitos não desejados semelhantes aos observados quando os medicamentos beta-bloqueadores são administrados por via oral ou injeção.
A frequência de efeitos não desejados após a administração ocular é menor do que após a administração oral ou injeção.
Os efeitos não desejados listados abaixo incluem efeitos observados com o grupo completo de medicamentos beta-bloqueadores utilizados em oftalmologia ou efeitos observados com o travoprosto isolado:
Sintomas oculares: inflamação das pálpebras, inflamação da córnea, descolamento da camada de tecido sob a retina que contém vasos sanguíneos, o que pode causar distúrbios da visão, diminuição da sensibilidade da córnea, erosão da córnea (dano à camada frontal do globo ocular), visão dupla, corrimento ocular, inchaço ao redor dos olhos, coceira das pálpebras, inversão da pálpebra com vermelhidão, irritação e lacrimejamento excessivo, visão turva (sinais de opacidade da lente do olho), inchaço da parte do olho (camada vascular), erupção cutânea nas pálpebras, visão de halos, diminuição da sensibilidade ocular, alteração da cor dentro do olho, dilatação da pupila, alteração da cor ou textura dos cílios, alteração do campo de visão.
Efeitos não desejados gerais:
- Distúrbios do ouvido e do labirinto:tonturas com sensação de rotação, zumbido nos ouvidos.
- Coração e vasos sanguíneos: diminuição da frequência cardíaca, palpitações, inchaço (retenção de líquidos), alterações do ritmo ou frequência cardíaca, insuficiência cardíaca congestiva (doença cardíaca com falta de ar e inchaço dos tornozelos e pés devido à retenção de líquidos), certos tipos de distúrbios do ritmo cardíaco, ataque cardíaco, hipotensão, síndrome de Raynaud, frieza nas mãos e pés, diminuição do fluxo sanguíneo para o cérebro.
- Aparelho respiratório: espasmo das vias respiratórias nos pulmões (principalmente em pacientes com doença pré-existente), corrimento nasal ou sensação de nariz entupido, espirros (devido a alergia), dificuldade em respirar, sangue no nariz, secura da mucosa nasal.
- Sistema nervoso e distúrbios gerais: dificuldade em dormir (insônia), pesadelos, perda de memória, alucinações, perda de força e energia, ansiedade (excesso de ansiedade emocional).
- Aparelho digestivo: distúrbios do paladar, náuseas, dispepsia, diarreia, secura na boca, dores abdominais, vômitos e constipação.
- Alergias: agravamento dos sintomas alérgicos, reações alérgicas generalizadas, incluindo inchaço da pele em áreas como o rosto e os membros, que pode causar dificuldade em respirar e engolir, erupção cutânea generalizada, coceira, reações alérgicas graves e potencialmente fatais.
- Pele: erupção cutânea de cor prateada (semelhante à psoríase) ou piora da psoríase, descamação da pele, textura anormal do cabelo, inflamação da pele com coceira e vermelhidão, alteração da cor do cabelo, perda de cabelo, sensação de formigamento ou dormência, coceira, crescimento anormal do cabelo, vermelhidão da pele.
- Sistema muscular: agravamento dos sintomas da miastenia gravis (doença muscular crónica), sensações anormais, como formigamento ou dormência, fraqueza muscular/fadiga, dor muscular não relacionada ao exercício, dor nas articulações.
- Rins e urinário: dificuldade em urinar, dor ao urinar, incontinência urinária.
- Sistema reprodutor: distúrbios da função sexual, diminuição da libido.
- Metabolismo: baixo nível de açúcar no sangue, aumento do valor do marcador de câncer de próstata.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou farmacêutico. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos do Instituto Português de Farmácia e Medicamentos, Rua Luís Pastor de Macedo, n.º 3, 1500-347 Lisboa, Tel.: +351 21 798 73 73, Fax: +351 21 798 73 74, Correio eletrónico: [[email protected]](mailto:[email protected]).
Os efeitos não desejados também podem ser notificados ao titular da autorização de introdução no mercado.
A notificação de efeitos não desejados é importante, pois permite a recolha de mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Travoprost + Timolol Medical Valley
Deve conservar o medicamento em local seguro e fora do alcance das crianças.
Não deve utilizar este medicamento após o prazo de validade impresso na caixa, sachet e garrafa após "Validade (EXP)". O prazo de validade é o último dia do mês indicado.
Antes de abrir, não há recomendações especiais para a conservação do medicamento.
Deve conservar a garrafa no sachet para protegê-la da luz.
Não há recomendações especiais para a conservação do medicamento após a primeira abertura.
Para evitar o risco de infecção a garrafa deve ser eliminada após 28 dias após a primeira abertura. Após cada início da utilização do medicamento com uma nova garrafa, deve anotar a data de abertura nos espaços reservados para esse fim na etiqueta da garrafa e na caixa.
Os medicamentos não devem ser eliminados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Travoprost + Timolol Medical Valley
- As substâncias ativas do medicamento são travoprosto e timolol. Cada mL de solução contém 40 microgramas de travoprosto e 5 mg de timolol (na forma de maleato de timolol).
- Os outros componentes são cloreto de benzalcônio, solução, hidroxiestearato de macrogol 40, trometamol, edetato dissódico, ácido bórico, manitol, hidróxido de sódio (para ajustar o pH) e água purificada.
Como é o medicamento Travoprost + Timolol Medical Valley e que contenções o pacote tem
Travoprost + Timolol Medical Valley é uma solução aquosa transparente e incolor, praticamente livre de partículas, fornecida em uma garrafa de 5 mL, feita de polipropileno, com um bico de gotas incolor, feito de LDPE, e uma tampa branca, não transparente, feita de HDPE/LDPE ou HDPE, com um dispositivo de segurança. Cada garrafa está colocada em um sachet. Cada garrafa contém 2,5 mL de solução. O pacote exterior é uma caixa de cartão.
Estão disponíveis os seguintes tamanhos de pacotes:
Caixa de cartão, contendo 1 ou 3 garrafas.
Nem todos os tamanhos de pacotes podem estar disponíveis.
Titular da autorização de introdução no mercado
Medical Valley Invest AB
Brädgårdsvägen 28
236 32 Höllviken
Suécia
Fabricante
Pharmathen SA
6 Dervenakion Str
15351 Pallini
Grécia
BALKANPHARMA-RAZGRAD AD
68 Aprilsko vastanie Blvd.
7200 Razgrad
Bulgária
JADRAN - GALENSKI LABORATORIJ d.d.
Svilno 20
51000 Rijeka
Croácia
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu sob as seguintes denominações:
Outras informações
Dinamarca:
Travoprost/Timolol Medical Valley 40 microgramas/mL + 5 mg/mL colírio, solução
Islândia:
Travoprost/Timolol Medical Valley 40 microgramas/mL + 5 mg/mL colírio, solução
Noruega: Travoprost/Timolol Medical Valley 40 microgramas/mL + 5 mg/mL colírio, solução
Polónia:
Travoprost + Timolol Medical Valley
Suécia:
Travoprost/Timolol Medical Valley 40 microgramas/mL + 5 mg/mL colírio, solução
Data da última revisão do folheto:07.10.2022
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBalkanpharma-Razgrad AD Jadran-Galenski laboratorij d.d. Pharmathen S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Travoprost + Timolol Medical ValleiForma farmacêutica: Gotas, 50 mcg/ml + 5 mg/mlSubstância ativa: timolol, combinationsFabricante: Pharmaselect International Beteiligungs GmbHNão requer receita médicaForma farmacêutica: Gotas, (0.3 mg + 5 mg)/mlSubstância ativa: timolol, combinationsRequer receita médicaForma farmacêutica: Gotas, 0,3 mg/ml + 5 mg/mlSubstância ativa: timolol, combinationsFabricante: Genetic S.p.ARequer receita médica
Alternativas a Travoprost + Timolol Medical Vallei noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Travoprost + Timolol Medical Vallei em Espanha
Alternativa a Travoprost + Timolol Medical Vallei em Ukraine
Médicos online para Travoprost + Timolol Medical Vallei
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Travoprost + Timolol Medical Vallei – sujeita a avaliação médica e regras locais.














