Como usar Methofill Sd
Folheto informativo para o doente: informação para o paciente
Methofill SD, 7,5 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 10 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 12,5 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 15 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 17,5 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 20 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 22,5 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 25 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 27,5 mg, solução para injeção em injetor pré-preenchido
Methofill SD, 30 mg, solução para injeção em injetor pré-preenchido
Metotrexato
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder reler se necessário.
- Deve consultar o médico, farmacêutico ou enfermeiro se tiver alguma dúvida.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outras pessoas, mesmo que tenham os mesmos sintomas que o seu.
- Se ocorrerem algum efeitos secundários, incluindo possíveis efeitos secundários não listados neste folheto, deve informar o seu médico, farmacêutico ou enfermeiro (ver secção 4).
Índice do folheto
- 1. O que é o Methofill SD e para que é utilizado
- 2. Informações importantes antes de tomar o Methofill SD
- 3. Como tomar o Methofill SD
- 4. Efeitos secundários possíveis
- 5. Como conservar o Methofill SD
- 6. Conteúdo do pacote e outras informações
1. O que é o Methofill SD e para que é utilizado
A substância ativa do Methofill SD é o metotrexato.
O metotrexato tem as seguintes propriedades:
- Inibe o crescimento de certas células que se dividem rapidamente
- Reduz a atividade do sistema imunológico (mecanismos de defesa do organismo)
- Tem efeito anti-inflamatório
Indicações para o uso do Methofill SD:
- Artrite reumatoide em adultos (AR) é uma doença crónica que decorre com inflamação das membranas que revestem as articulações. As membranas sinoviais produzem um líquido que actua como lubrificante para muitas articulações. O estado inflamatório provoca o espessamento das membranas e inchaço das articulações.
- Forma poliarticular de artrite idiopática juvenil grave, se o tratamento com medicamentos anti-inflamatórios não esteroides (AINE) for ineficaz. (A artrite juvenil ocorre em crianças e jovens com menos de 16 anos.)
- Artrite psoriásica grave em adultos (a artrite psoriásica afeta particularmente os dedos das mãos e dos pés, com lesões psoriásicas na pele e unhas).
- Psoríase grave resistente a outros métodos de tratamento (a psoríase é uma doença crónica comum da pele, que decorre com manchas vermelhas cobertas com uma escama grossa, seca, prateada, aderente).
- Doença de Crohn em adultos (é uma doença inflamatória do intestino que causa sintomas como dor abdominal, diarreia, vómitos ou perda de peso).
O Methofill SD modifica e desacelera a progressão da doença.
2. Informações importantes antes de tomar o Methofill SD
Quando não tomar o Methofill SD
- se o doente for alérgico ao metotrexato ou a qualquer outro componente deste medicamento (listados na secção 6);
- se o doente tiver doença hepática ou renal grave ou hematológica;
- se o doente consumir regularmente grandes quantidades de álcool;
- se o doente tiver infecção grave, como tuberculose, infecção por HIV ou outros déficits imunológicos;
- se o doente tiver úlceras na boca, estômago ou intestinos;
- se o doente estiver a receber uma vacina que contenha microrganismos vivos;
- se a doente estiver grávida ou a amamentar (ver secção "Gravidez, amamentação e fertilidade").
Precauções e advertências
Antes de iniciar o tratamento com o Methofill SD, deve discutir com o médico ou farmacêutico:
- se o doente for idoso, estiver debilitado ou em mau estado geral;
- se o doente tiver disfunção hepática;
- se o doente tiver desidratação (falta de água no organismo);
- se o doente tiver diabetes e estiver a ser tratado com insulina.
Durante o tratamento com metotrexato, foram relatados casos de hemorragia pulmonar aguda em doentes com doença reumática subjacente. Se o doente apresentar hemoptise, ou seja, expectoração de secreções com sangue, deve procurar imediatamente um médico.
Precauções especiais de uso do Methofill SD
O metotrexato pode perturbar temporariamente a produção de espermatozoides e ovócitos; na maioria dos casos, este efeito desaparece. O metotrexato pode causar aborto e defeitos congénitos. A doente não deve engravidar durante o tratamento com metotrexato e durante pelo menos 6 meses após a sua interrupção. Os doentes devem evitar a gravidez da parceira durante o tratamento com metotrexato e durante pelo menos 3 meses após a sua interrupção. Ver também a secção "Gravidez, amamentação e fertilidade".
Exames de controlo e precauções recomendados:
Even que o metotrexato seja administrado em doses baixas, podem ocorrer efeitos secundários graves. Para detetá-los o mais cedo possível, o médico deve realizar exames de controlo e análises laboratoriais.
Antes de iniciar o tratamento
Antes de iniciar o tratamento, será realizado um exame de sangue para verificar se o doente tem um número suficiente de células sanguíneas. A sangue também será examinada para verificar a função hepática, para saber se o doente tem hepatite. Além disso, serão verificados os níveis de albumina no sangue, a presença de hepatite e a função renal. O médico pode também decidir realizar outros testes hepáticos. Alguns deles podem incluir exames de imagem, outros podem exigir a recolha de uma pequena amostra de tecido do fígado para um exame mais detalhado. O médico pode também verificar se o doente tem tuberculose, ordenar uma radiografia de tórax ou um exame de função pulmonar.
Durante o tratamento
O médico pode realizar os seguintes exames:
- exame da boca e garganta para detectar alterações da mucosa, como inflamação ou úlceras;
- análises de sangue/morfologia com avaliação do número de células sanguíneas e medição da concentração de metotrexato no soro;
- exame de sangue para monitorizar a função hepática;
- exames de imagem para monitorizar o estado do fígado;
- recolha de uma pequena amostra de tecido do fígado para um exame mais detalhado;
- exame de sangue para monitorizar a função renal;
- monitorização das vias respiratórias e, se necessário, exame de função pulmonar.
É muito importante que o doente se apresente para os exames agendados.
Se os resultados de algum desses exames forem anormais, o médico ajustará o tratamento.
Doentes idosos
Os doentes idosos tratados com metotrexato devem ser monitorizados de perto pelo médico, para que possam ser detetados o mais cedo possível possíveis efeitos secundários. As alterações hepáticas e renais relacionadas com a idade, bem como as reservas baixas de ácido fólico na idade avançada, exigem doses relativamente baixas de metotrexato.
O metotrexato pode afectar o sistema imunológico e os resultados das vacinações. Pode também afectar os resultados dos testes imunológicos. Durante o tratamento com metotrexato, pode ocorrer a reativação de doenças crónicas latentes (por exemplo, herpes zóster, tuberculose, hepatite viral B ou C).
Durante o tratamento com o Methofill SD, não deve ser administrada qualquer vacina que contenha microrganismos vivos.
O metotrexato pode aumentar a sensibilidade da pele à luz solar. Deve evitar-se a exposição prolongada ao sol e não se deve usar solarium ou lâmpada de bronzeamento sem consultar o médico.
Para proteger a pele do sol, deve usar-se roupa adequada ou aplicar um filtro solar com alto fator de proteção.
Durante o tratamento com metotrexato, pode ocorrer a reativação da dermatite de radiação e queimaduras solares (chamada "reação de lembrança"). As lesões cutâneas da psoríase podem agravar-se durante a exposição à luz UV e a administração concomitante de metotrexato.
Pode ocorrer o aumento dos gânglios linfáticos (linfoma). Nesse caso, deve ser interrompido o tratamento.
A diarreia pode ser um sinal de efeito tóxico do Methofill SD e exige a interrupção do tratamento.
Se o doente apresentar diarreia, deve informar o médico.
Foram relatados casos de certas alterações cerebrais (encefalopatia/leucoencefalopatia) em doentes oncológicos que receberam metotrexato. Não pode ser excluída a possibilidade de ocorrerem esses efeitos secundários em doentes que tomam metotrexato para outras indicações.
Se o doente, o seu parceiro ou o seu cuidador notar um novo aparecimento ou agravamento de sintomas neurológicos, incluindo fraqueza muscular generalizada, alterações da visão, alterações do pensamento, memória e orientação que levam à desorientação e alterações da personalidade, deve contactar imediatamente o médico, pois podem ser sintomas de uma infecção cerebral grave e rara, chamada leucoencefalopatia multifocal progressiva (LMP).
Methofill SD e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar. Deve lembrar que isso inclui também os medicamentos que tomará no futuro.
A administração concomitante de certos medicamentos pode afectar a ação do Methofill SD:
- antibióticos como tetraciclinas, clorafenicol, antibióticos não absorvíveis de amplo espectro, penicilinas, glicopeptídeos, sulfonamidas, ciprofloxacina e cefalotina (medicamentos usados para prevenir e tratar certas infecções);
- medicamentos anti-inflamatórios não esteroides ou salicilatos [medicamentos para dor e/ou inflamação, como ácido acetilsalicílico, diclofenaco e ibuprofeno ou pirazóis];
- probenecida (usada no tratamento da gota);
- ácidos orgânicos fracos, como diuréticos de alça (medicamentos para aumentar a produção de urina);
- medicamentos que podem prejudicar a função da medula óssea, como trimetoprima-sulfametoxazol (substância bactericida) ou pirimetamina;
- outros medicamentos usados para tratar a artrite reumatoide, como leflunomida, sulfassalazina e azatioprina);
- ciclosporina (medicamento que inibe a ação do sistema imunológico);
- mercaptopurina (medicamento com ação citostática);
- retinoides (medicamentos para psoríase e outras doenças da pele);
- teofilina (medicamento para asma brônquica e outras doenças pulmonares);
- certos medicamentos para doenças do estômago, como omeprazol e pantoprazol;
- medicamentos que reduzem o nível de açúcar no sangue.
É especialmente importante informar o médico sobre a administração de:
- metamizol (sinónimos: novaminsulfona e dipirona) (medicamento para dor e/ou febre).
Os produtos vitamínicos que contenham ácido fólico devem ser usados apenas se forem recomendados pelo médico, pois podem reduzir a ação do metotrexato.
Methofill SD com alimentos, bebidas e álcool
Durante o tratamento com o Methofill SD, deve evitar-se o consumo de álcool, bem como grandes quantidades de café, bebidas que contenham cafeína e chá preto.
Gravidez, amamentação e fertilidade
Gravidez
Não deve ser administrado o Methofill SD se a doente estiver grávida ou tentar engravidar. O metotrexato pode causar defeitos congénitos, prejudicar o feto ou provocar um aborto. Isso está relacionado com defeitos de desenvolvimento da cabeça, face, coração e vasos sanguíneos, cérebro e membros. Por isso, é muito importante que as doentes que estejam grávidas ou planeiem engravidar não tomem metotrexato. Se a doente estiver em idade fértil, deve ser confirmado definitivamente que não está grávida antes de iniciar o tratamento, tomando as medidas necessárias, por exemplo, realizando um teste de gravidez. A doente deve evitar engravidar durante o tratamento com metotrexato e durante pelo menos 6 meses após a sua interrupção, usando durante todo esse tempo métodos anticoncepcionais fiáveis (ver também a secção "Precauções e advertências").
Se a doente engravidar durante o tratamento ou suspeitar que pode estar grávida, deve consultar imediatamente o médico. A doente deve receber aconselhamento sobre os possíveis efeitos prejudiciais do tratamento no feto.
Se a doente planeia engravidar, deve consultar o médico que a está a tratar, que pode encaminhá-la para um especialista para obter aconselhamento antes de planeiar a gravidez.
Fertilidade masculina
As evidências disponíveis não sugerem um aumento do risco de defeitos congénitos ou aborto após a administração de metotrexato pelo pai em doses inferiores a 30 mg/semana. No entanto, não pode ser excluído totalmente o risco. O metotrexato pode ser genotóxico. Isso significa que o medicamento pode causar mutações genéticas. O metotrexato pode afectar os espermatozoides e causar defeitos congénitos. Por isso, o doente deve evitar a gravidez da parceira e não deve ser dador de sêmen durante o tratamento com metotrexato e durante pelo menos 3 meses após a sua interrupção.
Amamentação
Deve ser interrompida a amamentação antes de iniciar e durante o tratamento com o Methofill SD.
Condução de veículos e utilização de máquinas
Durante o tratamento com o Methofill SD, podem ocorrer efeitos secundários do sistema nervoso central, como fadiga e tonturas. Nesse caso, a capacidade de conduzir veículos ou operar máquinas pode estar prejudicada. Se o doente se sentir sonolento ou fatigado, não deve conduzir veículos ou operar máquinas.
Methofill SD contém sódio
O medicamento contém menos de 1 mmol (23 mg) de sódio por dose, ou seja, o medicamento é considerado "sem sódio".
3. Como tomar o Methofill SD
Este medicamento deve ser sempre administrado de acordo com as recomendações do médico. Em caso de dúvida, deve consultar o médico ou farmacêutico.
O médico decide a dose, que é ajustada individualmente para o doente.
Os efeitos do tratamento são geralmente visíveis apenas após 4 a 8 semanas.
O Methofill SD é administrado por via subcutânea (sob a pele) pelo médico ou por pessoal médico qualificado, ou sob a sua supervisão apenas uma vez por semana. O dia da injeção deve ser decidido pelo doente em conjunto com o médico.
Advertência importante sobre a dosagem do Methofill SD (metotrexato):
No tratamento da artrite reumatoide, artrite idiopática juvenil, artrite psoriásica, psoríase e doença de Crohn, o Methofill SD deve ser administrado apenas uma vez por semana. A administração de uma dose excessiva de Methofill SD (metotrexato) pode ser fatal. Leia atentamente a secção 3 deste folheto. Em caso de dúvida antes de administrar este medicamento, deve consultar o médico ou farmacêutico.
Administração em crianças e jovens
O médico decide a dose adequada para crianças e jovens com artrite idiopática juvenil poliarticular.
O Methofill SD não é recomendado para crianças com menos de 3 anos, devido à falta de experiência em doentes desta faixa etária.
Método e duração da administração
O Methofill SD é injetado uma vez por semana!
A duração do tratamento é decidida pelo médico. O tratamento da artrite reumatoide, artrite idiopática juvenil, psoríase comum e psoríase artrítica e doença de Crohn com o Methofill SD é um tratamento de longa duração.
O Methofill SD deve ser prescrito apenas por médicos que estejam familiarizados com as propriedades do medicamento e o seu modo de ação. O médico que está a tratar o doente pode decidir que o doente pode administrar o medicamento por via subcutânea sozinho.
No início do tratamento, o Methofill SD pode ser administrado por injeção pelo pessoal médico. O médico pode, no entanto, decidir que o doente é capaz de aprender a administrar o Methofill SD sozinho. O doente será devidamente treinado para isso.
Nunca deve tentar administrar o medicamento sozinho sem treinamento prévio.
Apenas para uso único. Deve lembrar-se de usar todo o conteúdo do injetor.
O método de eliminação deve ser semelhante ao de outros medicamentos citostáticos e de acordo com as regulamentações locais. As mulheres grávidas não devem administrar ou usar o Methofill SD.
Deve evitar-se o contacto do metotrexato com a pele ou as mucosas. Em caso de contaminação, a superfície contaminada deve ser lavada abundantemente com água.
Instruções para a administração:
Deve ler atentamente as instruções para a administração do Methofill SD no injetor.
A administração autónoma do injetor requer treinamento adequado pelo médico.
Em caso de dúvida, deve contactar o médico, farmacêutico ou enfermeiro.
Antes de iniciar a administração:
- deve escolher um local limpo e bem iluminado,
- verificar a data de validade do medicamento, não administrar se a data tiver expirado,
- preparar um cotonete com álcool e um recipiente para resíduos.
Preparação para a administração:

- Lavar as mãos com sabão e água morna
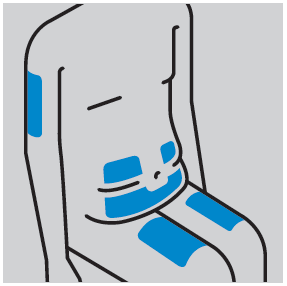
- Escolher o local de injeção (abdômen ou coxa, se o doente estiver a administrar a injeção sozinho ou, opcionalmente, a parte de trás do braço se a injeção for administrada por um médico ou cuidador)
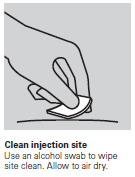
- Limpar a área ao redor do local de administração com um cotonete com álcool. Deixar secar.
Antes da injeção:

- Antes da administração, verificar visualmente a cor da solução, a turbidez ou a presença de partículas sólidas.
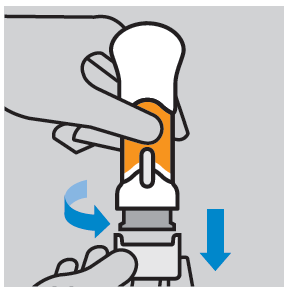
- Remover a cobertura de plástico protetora: para remover a cobertura, deve girá-la e puxá-la para baixo. Após a remoção da cobertura, não tocar na cobertura da agulha. A cobertura deve ser descartada e não deve ser colocada novamente. Não administrar a injeção se o injetor estiver pressionado após a remoção da cobertura.
- A injeção deve ser administrada dentro de 5 minutos após a remoção da cobertura.
Administração da injeção:
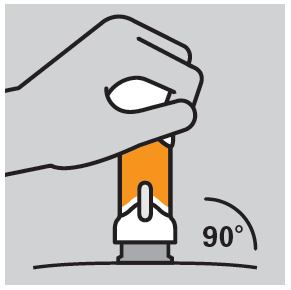
- Aproximar o injetor do local de injeção a um ângulo reto (90°).
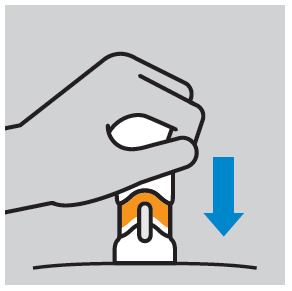
- Pressionar o êmbolo do injetor até que a dose completa seja administrada. A injeção deve ser administrada à velocidade que seja confortável para o doente. Não alterar a posição do injetor durante a administração do medicamento.
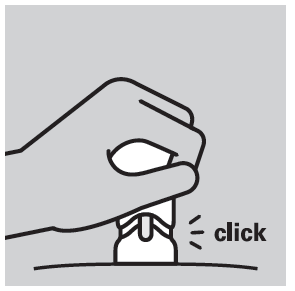
- A pressão máxima do êmbolo é sinalizada por um clique característico; a parte laranja do injetor torna-se invisível.
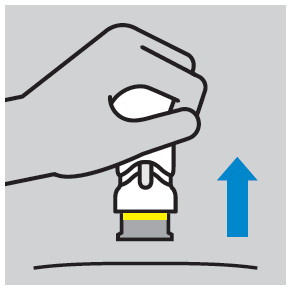
- Após a administração da injeção, é visível um anel amarelo que indica o bloqueio da cobertura da agulha.
Eliminação de resíduos:

- Deve eliminar o injetor usado do Methofill SD descartando-o em um recipiente para objetos cortantes. As diretrizes para a eliminação desses resíduos podem variar dependendo do país/ região. Para obter diretrizes atualizadas, deve contactar o médico ou farmacêutico. Não deve descartar o injetor usado no lixo doméstico comum.
Deve evitar-se o contacto do metotrexato com a pele e as mucosas. Em caso de contaminação, a superfície contaminada deve ser lavada abundantemente com água.
Se o doente ou alguém da sua família se cortar com a agulha do injetor, deve informar imediatamente o médico e não usar o injetor.
Administração de uma dose maior do que a recomendada do Methofill SD
Em caso de administração de uma dose maior do que a recomendada, deve informar imediatamente o médico.
Omissão de uma dose do Methofill SD
Não deve ser administrada uma dose dupla para compensar a dose omitida.
Interrupção do tratamento com o Methofill SD
Em caso de interrupção do tratamento com o Methofill SD, deve informar imediatamente o médico.
4. Efeitos secundários possíveis
Como qualquer medicamento, o Methofill SD pode causar efeitos secundários, embora não todos os doentes os experimentem.
A frequência e a gravidade dos efeitos secundários dependem da dose e da frequência de administração do medicamento. Como os efeitos secundários graves podem ocorrer após a administração de doses baixas, é necessário realizar exames médicos regulares. O médico que está a tratar o doente deve solicitar a realização de exames para excluir anormalidadesnos parâmetros sanguíneos (por exemplo, baixo número de glóbulos brancos, plaquetas, linfoma) e alterações no fígado e nos rins.
Deve informar imediatamente o médicose o doente apresentar algum dos seguintes sintomas, pois podem ser sinais de efeitos secundários graves, potencialmente fatais, que exigem tratamento imediato:
- Tosse seca persistente, falta de ar e febre; podem ser sintomas de pneumonia [frequente]
- Hemoptise, ou seja, expectoração de secreções com sangue;podem ser sintomas de hemorragia pulmonar [frequência desconhecida]
- Sintomas de lesão hepática, como icterícia e olhos amarelados; o metotrexato pode causar lesão hepática crónica (cirrose), formação de tecido cicatricial (fibrose hepática), esteatose hepática [todos pouco frequentes], hepatite (hepatite aguda) [pouco frequente] e insuficiência hepática [muito raro]
- Sintomas de alergia, como erupções cutâneas, incluindo erupções com vermelhidão, coceira, inchaço dos dedos, tornozelos, face, lábios, boca ou garganta (que pode causar dificuldade em engolir ou respirar e sensação de desmaio; podem ser sintomas de reações alérgicas graves ou choque anafilático [pouco frequente]
- Sintomas de lesão renal, como inchaço dos dedos, tornozelos ou face ou alterações na frequência de micção (oligúria) ou redução ou ausência de urina (anúria); podem ser sintomas de insuficiência renal [pouco frequente]
- Sintomas de infecção, como febre, calafrios, dor, dor de garganta; o metotrexato pode aumentar a suscetibilidade a infecções. Infecções graves, como um tipo específico de pneumonia (pneumonia por Pneumocystis jirovecii) ou septicemia [pouco frequente]
- Sintomas como fraqueza de um lado do corpo (acidente vascular cerebral) ou dor, inchaço, vermelhidão e calor em uma das pernas (trombose venosa profunda). Pode ocorrer quando um coágulo sanguíneo fecha o vaso sanguíneo. (evento tromboembólico) [pouco frequente]
- Febre e agravamento grave do estado geral de saúde ou febre súbita, acompanhada de dor de garganta ou boca ou alterações na micção;o metotrexato pode causar agranulocitose e supressão grave da medula óssea [muito raro]
- Sangramento inesperado, como sangramento nasal, sangue na urina, vômitos ou aparecimento de hematomas;podem ser sintomas de trombocitopenia grave devido à supressão grave da medula óssea [muito raro]
- Sintomas como dor de cabeça forte, frequentemente acompanhada de febre, rigidez da nuca, náuseas, vômitos, desorientação e sensibilidade à luzpodem ser sinais de meningite asséptica aguda (meningite asséptica) [muito raro]
- em doentes oncológicos que receberam metotrexato, foram relatados casos de certas alterações cerebrais (encefalopatia/leucoencefalopatia). Não pode ser excluída a possibilidade de ocorrerem esses efeitos secundários em doentes que tomam metotrexato para outras indicações. Sintomas dessas alterações cerebrais podem incluir: alterações do estado mental, alterações motoras (ataxia), alterações da visão ou perturbações da memória[frequência desconhecida]
- Erupções cutâneas graves ou bolhas na pele (que também podem ocorrer na boca, olhos e genitálias);podem ser sintomas de síndrome de Stevens-Johnson ou síndrome de pele escaldada (nekrolise tóxica epidermal/ síndrome de Lyell) [muito raro]
Outros efeitos secundários podem ocorrer:
Muito frequentes:podem ocorrer em mais de 1 em cada 10 doentes
- estomatite, náuseas, vômitos, perda de apetite, dor abdominal
- resultados anormais de testes de função hepática (ASAT, ALAT, bilirrubina, fosfatase alcalina)
Frequentes:podem ocorrer em até 1 em cada 10 doentes
- úlceras na boca, diarreia
- erupções cutâneas, vermelhidão, coceira
- dor de cabeça, fadiga, sonolência
- redução da produção de células sanguíneas, levando a uma redução do número de células sanguíneas brancas e/ou vermelhas e/ou plaquetas
Pouco frequentes:podem ocorrer em até 1 em cada 100 doentes
- faríngite
- enterite, vômitos, pancreatite, icterícia, hemorragia gastrointestinal
- reações de radiação, perda de cabelo, aumento do número de nódulos reumáticos, herpes zóster, vasculite, erupções cutâneas semelhantes a urticária, angioedema
- desenvolvimento de diabetes
- tonturas, confusão, depressão
- redução da albumina no sangue
- redução do número de células sanguíneas
- lesões na bexiga ou vagina, disfunção renal, alterações na micção
- dor articular, dor muscular, perda de massa óssea
Raros:podem ocorrer em até 1 em cada 1.000 doentes
- gengivite
- pigmentação cutânea intensa, acne, equimoses, púrpura
- vasculite alérgica
- redução da imunoglobulina no sangue
- infecção (incluindo reativação de infecções latentes, crónicas), conjuntivite
- alterações do humor
- alterações da visão
- pericardite, efusão pericárdica, disfunção cardíaca, hipotensão
- fibrose pulmonar, asma brônquica, derrame pleural
- fraturas por estresse ósseo
- alterações eletrolíticas
- febre, alterações na cicatrização de feridas
Muito raros:podem ocorrer em até 1 em cada 10.000 doentes
- megacólon tóxico
- pigmentação intensa das unhas, paroníquia aguda, celulite, fenômeno de Raynaud
- lesões locais (formação de abscesso estéril, alterações no tecido adiposo) no local da injeção
- dor, fraqueza muscular ou sensação de formigamento ou alterações da sensibilidade, alterações do paladar (sabor metálico), convulsões, paralisia, meningite asséptica aguda
- retinopatia, visão turva
- redução da libido, impotência, ginecomastia em homens
- alterações da espermatogênese (oligospermia), alterações da menstruação, leucorréia
- linfoma
- alterações linfoproliferativas (produção excessiva de células brancas)
Frequência desconhecida:não pode ser estimada com base nos dados disponíveis
- aumento do número de certos glóbulos brancos
- sangramento nasal
- proteinúria
- astenia
- hemorragia pulmonar
- lesões ósseas da mandíbula (devido à produção excessiva de glóbulos brancos)
- destruição do tecido no local da injeção
- eritema, descamação da pele
- edema
As injeções subcutâneas de metotrexato são geralmente bem toleradas localmente. Foram observadas apenas reações cutâneas locais leves (como sensação de queimadura, vermelhidão, inchaço, alterações da pigmentação, coceira, prurido intenso, dor) que diminuem durante o tratamento.
Notificação de efeitos secundários
Se ocorrerem algum efeito secundário, incluindo possíveis efeitos secundários não listados neste folheto, deve informar o médico ou farmacêutico. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos do Instituto de Regulação de Medicamentos, Dispositivos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Varsóvia
telefone: + 48 22 49 21 301
fax: + 48 22 49 21 309
site da internet: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar o Methofill SD
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Conservar a uma temperatura inferior a 30°C.
Conservar no embalagem original para proteger da luz.
Não usar este medicamento após o prazo de validade impresso na etiqueta ou caixa após EXP. O prazo de validade é o último dia do mês indicado.
Não usar o Methofill SD se o doente notar alguma alteração na cor da solução ou presença de partículas sólidas.
Os medicamentos não devem ser jogados na canalização ou lixeiras domésticas. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são necessários. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém o Methofill SD
A substância ativa é o metotrexato.
1 injetor com 0,15 ml de solução contém 7,5 mg de metotrexato.
1 injetor com 0,20 ml de solução contém 10 mg de metotrexato.
1 injetor com 0,25 ml de solução contém 12,5 mg de metotrexato.
1 injetor com 0,30 ml de solução contém 15 mg de metotrexato.
1 injetor com 0,35 ml de solução contém 17,5 mg de metotrexato.
1 injetor com 0,40 ml de solução contém 20 mg de metotrexato.
1 injetor com 0,45 ml de solução contém 22,5 mg de metotrexato.
1 injetor com 0,50 ml de solução contém 25 mg de metotrexato.
1 injetor com 0,55 ml de solução contém 27,5 mg de metotrexato.
1 injetor com 0,60 ml de solução contém 30 mg de metotrexato.
Os outros componentes são cloreto de sódio, hidróxido de sódio (para ajustar o pH) e água para injeções.
Como é o Methofill SD e que conteúdo tem o embalagem
O medicamento no injetor tem a forma de solução transparente, amarela a marrom.
Estão disponíveis os seguintes tamanhos de embalagem:
Injetores com 0,15 ml, 0,20 ml, 0,25 ml, 0,30 ml, 0,35 ml, 0,40 ml, 0,45 ml, 0,50 ml, 0,55 ml e 0,60 ml de solução estão disponíveis em embalagens contendo 1, 4 ou 8 injetores, cada um em uma caixa de cartão.
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de comercialização
Accord Healthcare Polska Sp. z o.o.
ul. Taśmowa 7
02-677 Varsóvia
Telefone: +48 22 577 28 00
Fabricante/Importador
Accord Healthcare Polska Sp. z o.o.
ul. Lutomierska 50
95-200 Pabianice
Este medicamento está autorizado para comercialização nos Estados-Membros do Espaço Económico Europeu e no Reino Unido (Irlanda do Norte) sob as seguintes denominações:
| País Membro | Nome do medicamento |
| Irlanda | Methofill 7.5 mg/10 mg/12.5 mg/15 mg/17.5 mg/20 mg/22.5 mg/25 mg/27.5 mg/30 mg solução para injeção em injetor pré-preenchido |
| Polônia | Methofill SD |
| Suécia | Injexate |
| Reino Unido (Irlanda do Norte) | Methofill 7.5 mg/10 mg/12.5 mg/15 mg/17.5 mg/20 mg/22.5 mg/25 mg/27.5 mg/30 mg solução para injeção em injetor pré-preenchido |
Data da última revisão do folheto: dezembro de 2024
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorAccord Healthcare Polska Sp. z o.o.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Methofill SdForma farmacêutica: Solução, 20 mg/mlSubstância ativa: methotrexateRequer receita médicaForma farmacêutica: Solução, 7.5 mgSubstância ativa: methotrexateRequer receita médicaForma farmacêutica: Solução, 12.5 mgSubstância ativa: methotrexateRequer receita médica
Alternativas a Methofill Sd noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Methofill Sd em Espanha
Alternativa a Methofill Sd em Ukraine
Médicos online para Methofill Sd
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Methofill Sd – sujeita a avaliação médica e regras locais.