
Como usar Menopur
folheto PARA O DOENTE
Folheto anexo ao embalagem: informação para o doente
MENOPUR, 1200 UI FSH + 1200 UI LH, pó e solvente para preparar solução para
injeções
Menotropina
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico.
- O medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico. Ver ponto 4.
Índice do folheto:
- 1. O que é Menopur e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Menopur
- 3. Como tomar Menopur
- 4. Efeitos não desejados
- 5. Como conservar Menopur
- 6. Conteúdo do embalagem e outras informações
1. O que é Menopur e para que é utilizado
Menopur é um pó em frasco que, antes da administração, deve ser dissolvido em líquido (solvente). O medicamento é administrado por injeção subcutânea ou intramuscular. Menopur (menotropina de alta pureza obtida da urina de mulheres pós-menopáusicas) contém dois hormônios: hormônio folículo-estimulante (FSH) e hormônio luteinizante (LH). FSH e LH são hormônios naturais produzidos no organismo da mulher e do homem. Eles permitem o funcionamento normal dos órgãos do aparelho reprodutor. Menopur é utilizado no tratamento da infertilidade nas seguintes situações: em mulheres que não podem engravidar porque os ovários não produzem óvulos (também no caso da síndrome dos ovários policísticos). Menopur é utilizado em mulheres que, para o tratamento da infertilidade, já receberam citrato de clomifeno, mas o medicamento não foi eficaz; em mulheres que participam em programas de reprodução assistida, tais como fertilização in vitro e transferência de embrião, transferência de gameta para o oviduto e injeção intracitoplasmática de espermatozoide no óvulo. Menopur ajuda a produzir vários folículos ovarianos nos ovários, nos quais os óvulos podem se desenvolver (desenvolvimento de vários folículos ovarianos); em homens que têm testículos que produzem uma quantidade insuficiente de espermatozoides devido à falta de gonadotropinas (hormônios produzidos pela hipófise e que afetam os testículos).
2. Informações importantes antes de tomar o medicamento Menopur
Antes de iniciar o tratamento com o medicamento Menopur, é necessário que o médico avalie as causas dos distúrbios da fertilidade em ambos os parceiros. É especialmente importante verificar se não há doenças que requeiram um tratamento diferente: hipotireoidismo e hipoadrenalismo níveis elevados de hormônio prolactina (hiperprolactinemia) tumores da hipófise (glândula localizada na base do cérebro) tumores do hipotálamo (área localizada sob a parte do cérebro chamada tálamo). Se o doente tiver alguma dessas doenças, deve informar o médico antes de iniciar o tratamento com o medicamento Menopur.
Quando não tomar o medicamento Menopur
Nas mulheres e homens: se o doente tiver alergia à menotropina ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6); se tiver sido diagnosticado com tumores da hipófise ou do hipotálamo. Nas mulheres: se a doente estiver grávida ou amamentando; se tiver sido diagnosticado com cistos ovarianos ou aumento dos ovários não causado pela síndrome dos ovários policísticos; se tiver sangramento vaginal de causa desconhecida; se tiver sido diagnosticado com tumores do útero, ovários ou seios; se tiver anomalias congênitas dos órgãos genitais que impeçam o desenvolvimento da gravidez; se tiver fibromiomas uterinos que impeçam o desenvolvimento da gravidez; se tiver entrado na menopausa precocemente. Nos homens: se tiver sido diagnosticado com câncer de próstata; se tiver sido diagnosticado com tumores testiculares.
Precauções e advertências
Deve ter cuidado se a doente tiver: dor abdominal; inchaço abdominal; náuseas; vômitos; diarreia; ganho de peso; dificuldades respiratórias; diminuição da frequência ou quantidade de urina eliminada. Deve informar imediatamente o médico sobre esses sintomas, mesmo que apareçam alguns dias após a última dose do medicamento. Podem ser sintomas de hiperestimulação ovarian, que pode ser grave. Se esses sintomas piorarem, deve interromper o tratamento da infertilidade e iniciar o tratamento apropriado no hospital. A observância da dose prescrita e a monitorização cuidadosa do tratamento reduzem a probabilidade de ocorrência desses sintomas. Esses sintomas também podem ocorrer quando o medicamento Menopur for interrompido. Se ocorrer algum desses sintomas, deve contatar imediatamente o médico. Durante o tratamento com o medicamento Menopur, o médico geralmente encaminha a doente para exames de ultrassom (com uso de ultrassom) e, às vezes, para exames de sangue para verificar a reação ao tratamento. O tratamento com hormônios, como o Menopur, pode aumentar o risco de: gravidez ectópica (fora do útero) em mulheres com doenças dos tubos uterinos diagnosticadas anteriormente; aborto; gravidez múltipla (gêmeos, trigêmeos, etc.); anomalias congênitas (defeitos físicos presentes no bebê ao nascer). Em algumas mulheres tratadas por infertilidade, desenvolveram-se cistos ovarianos ou tumores de outros órgãos do aparelho reprodutor. Até o momento, não se sabe se isso foi causado pelo tratamento com hormônios como o Menopur. A probabilidade de ocorrência de tromboses nas veias ou artérias é maior em mulheres grávidas. O tratamento da infertilidade pode aumentar a probabilidade de tromboses, especialmente se a doente tiver excesso de peso ou se tiver tido tromboses anteriormente ou se elas ocorreram em algum familiar (parentes). A doente deve informar o médico se achar que isso a afeta. Menopur, juntamente com o hormônio chamado gonadotropina coriônica humana (hCG), pode ser administrado no tratamento da infertilidade em homens.
Crianças e adolescentes
O medicamento Menopur não é adequado para crianças e adolescentes.
Menopur e outros medicamentos
Deve informar o médico sobre todos os medicamentos que está tomando atualmente ou recentemente, bem como sobre os medicamentos que planeja tomar. Citrato de clomifeno é outro medicamento utilizado no tratamento da infertilidade. Se o Menopur for administrado ao mesmo tempo que o citrato de clomifeno, o efeito nos ovários pode ser aumentado. Menopur pode ser utilizado concomitantemente com o medicamento Bravelle. Ver ponto 3.
Gravidez e amamentação
O medicamento Menopur não deve ser utilizado durante a gravidez ou amamentação.
Condução de veículos e operação de máquinas
É pouco provável que o Menopur afete a capacidade de conduzir veículos ou operar máquinas.
Menopur contém cloreto de sódio
Menopur contém menos de 1 mmol de cloreto de sódio (23 mg) por dose, ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar Menopur
Este medicamento deve ser sempre utilizado de acordo com as instruções do médico. Em caso de dúvidas, deve consultar o médico. Mulheres que não ovulam (não produzem óvulos) O tratamento deve ser iniciado dentro dos primeiros 7 dias do ciclo menstrual (dia 1 é o primeiro dia da menstruação). O medicamento deve ser administrado diariamente por pelo menos 7 dias. A dose inicial é geralmente de 75 UI (unidades internacionais) de FSH + 75 UI de LH a 150 UI de FSH + 150 UI de LH por dia. Dependendo da reação da doente, a dose pode ser aumentada para um máximo de 225 UI de FSH + 225 UI de LH. A dose prescrita deve ser administrada por pelo menos 7 dias antes de qualquer alteração da dose. Recomenda-se que, a cada alteração, a dose seja aumentada em 37,5 UI de FSH + 37,5 UI de LH, mas não mais de 75 UI de FSH + 75 UI de LH. O ciclo de tratamento deve ser interrompido se, após 4 semanas, não for detectada reação. Quando a reação for satisfatória, no dia seguinte à última injeção do medicamento Menopur, deve ser administrada uma injeção única de outro hormônio, hCG, em dose de 5000 UI a 10 000 UI. Recomenda-se que a doente tenha relações sexuais no dia da administração e no dia seguinte à administração do hCG. Alternativamente, pode ser realizada uma inseminação (introdução de sêmen diretamente no útero). A doente permanece sob observação cuidadosa do médico por pelo menos 2 semanas após a administração do hCG. O médico verificará os resultados do tratamento com o medicamento Menopur. Dependendo do progresso do tratamento, o médico pode decidir interromper a administração do medicamento Menopur e não administrar o hCG. Nesse caso, a doente será aconselhada a usar um método anticoncepcional mecânico (por exemplo, preservativo) ou a abster-se de relações sexuais até a próxima menstruação. Mulheres que participam em programas de reprodução assistida Se a doente também receber tratamento com um agonista do GnRH (medicamento que ajuda a ação do hormônio que libera as gonadotropinas), a administração do medicamento Menopur deve ser iniciada cerca de 2 semanas após o início do tratamento com o agonista do GnRH. Se a doente também receber tratamento com um antagonista do GnRH, a administração do medicamento Menopur deve ser iniciada no 2º ou 3º dia do ciclo menstrual (1º dia da menstruação é o 1º dia do ciclo). O medicamento deve ser administrado diariamente por pelo menos 5 dias. A dose inicial do medicamento Menopur é geralmente de 150 UI de FSH + 150 UI de LH a 225 UI de FSH + 225 UI de LH por dia. Dependendo da reação da doente ao tratamento, a dose pode ser aumentada para um máximo de 450 UI de FSH + 450 UI de LH por dia. Não deve aumentar a dose de uma vez por mais de 150 UI de FSH + 150 UI de LH. Geralmente, o tratamento não deve durar mais de 20 dias. Após a detecção de um número suficiente de folículos ovarianos de tamanho apropriado, a doente recebe uma injeção única do hormônio hCG em dose de até 10 000 UI para induzir a ovulação (liberação do óvulo). A doente permanece sob observação cuidadosa do médico por pelo menos 2 semanas após a administração do hCG. O médico verificará os resultados do tratamento com o medicamento Menopur. Dependendo do progresso do tratamento, o médico pode decidir interromper a administração do medicamento Menopur e não administrar o hCG. Nesse caso, a doente será aconselhada a usar um método anticoncepcional mecânico (por exemplo, preservativo) ou a abster-se de relações sexuais até a próxima menstruação. Homens: O tratamento é iniciado com a administração de hCG 3 vezes por semana em dose de 1000 UI a 3000 UI até que se obtenha um nível adequado de testosterona no sangue. Em seguida, é administrado o medicamento Menopur por via intramuscular em dose de 75 UI de FSH + 75 UI de LH a 150 UI de FSH + 150 UI de LH, 3 vezes por semana, por vários meses.
INSTRUÇÕES PARA A ADMINISTRAÇÃO
Se o médico prescrever a autoadministração do medicamento Menopur, deve seguir todas as instruções fornecidas. A primeira injeção do medicamento Menopur deve ser feita sob supervisão do médico. Menopur é um pó em frasco que, antes da administração, deve ser reconstituído (dissolvido). O líquido para dissolver o medicamento Menopur está em duas seringas-ampolas fornecidas com o frasco de pó.
Menopur 1200 UI FSH + 1200 UI LH deve ser dissolvido no solvente contido em duas seringas-ampolas.
Após a dissolução, o medicamento contido em um frasco é administrado durante vários dias e, portanto, deve-se certificar de que está retirando apenas a dose prescrita pelo médico. O médico prescreve a dose do medicamento Menopur em unidades internacionais (UI). Deve usar uma das 18 seringas para injeções, graduadas em unidades internacionais FSH/LH, que estão no embalagem.

Para isso, deve:
1  | 2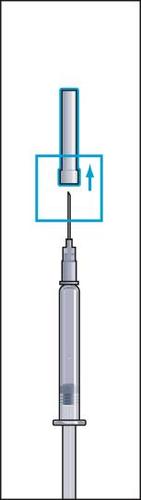 |
- 1. Retirar a tampa protetora do frasco de pó e a tampa de borracha de uma das seringas-ampolas com solvente (figura 1).
- 2. Colocar firmemente a agulha (agulha para reconstituição) na seringa-ampola com solvente e retirar a tampa protetora da agulha (figura 2).
3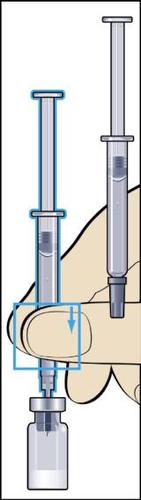 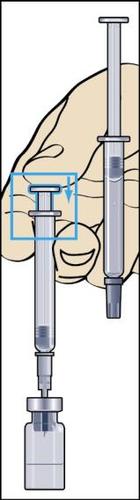 | 4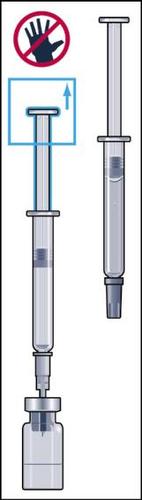 | 5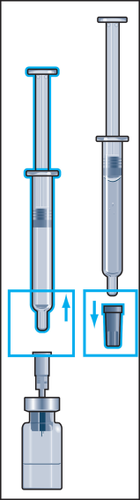 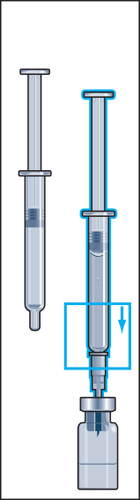 | 6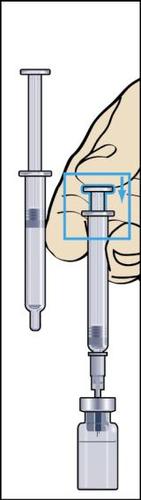 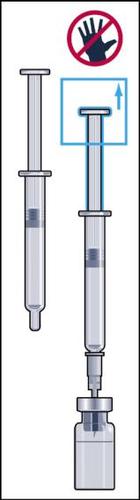 |
- 3. Inserir a agulha verticalmente através do centro do batoque de borracha do frasco de pó e injetar lentamente todo o líquido para evitar a formação de bolhas (figura 3).
- 4. Durante a injeção do solvente no frasco, ocorre pressão no frasco. Portanto, após a injeção do solvente, deve-se liberar a pressão no êmbolo por cerca de 10 segundos e permitir que o êmbolo retorne sozinho para cima. Isso eliminará a pressão no frasco (figura 4).
- 5. Com um movimento de rotação suave, desconectar a seringa-ampola da agulha, deixando a agulha no frasco. Retirar a tampa de borracha da segunda seringa-ampola com solvente e conectar firmemente a seringa-ampola à agulha que permanece no frasco. Injetar lentamente todo o líquido para evitar a formação de bolhas (figura 5).
- 6. Durante a injeção do solvente no frasco, ocorre pressão no frasco. Portanto, após a injeção do solvente, deve-se liberar a pressão no êmbolo por cerca de 10 segundos e permitir que o êmbolo retorne sozinho para cima. Isso eliminará a pressão no frasco (figura 6).
Descartar as seringas-ampolas e a agulha para reconstituição.
7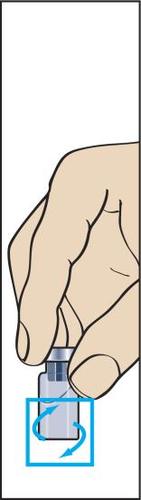 | 8 | 9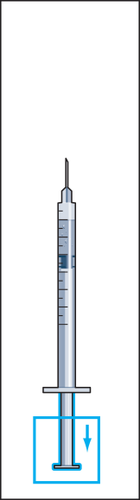 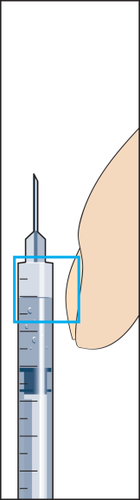 | 10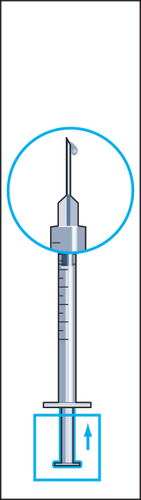 |
- 7. O pó deve se dissolver rapidamente (em 2 minutos), formando uma solução transparente. Embora normalmente isso ocorra após a injeção de algumas gotas do solvente, deve-se injetar todo o solvente. Para facilitar a dissolução do pó, pode-se balançar o frasco (figura 7). Não deve agitar o frasco, pois isso causa a formação de bolhas de ar.
Se a solução não for transparente ou contiver partículas sólidas, não deve ser usada.
A solução resultante da dissolução do pó no solvente das duas seringas-ampolas agora está pronta para uso.
- 8. Retirar da embalagem a seringa para injeções com agulha acoplada e inserir a agulha verticalmente através do centro do batoque de borracha do frasco. A seringa para injeções contém uma pequena quantidade de ar, que deve ser injetada no frasco acima da solução. Inverter o frasco e retirar a dose prescrita do medicamento Menopur para a seringa para injeções (figura 8).
ATENÇÃO: como o frasco contém medicamento para uso durante vários dias, deve-se certificar de que está retirando apenas a dose prescrita pelo médico.
Se o médico prescrever o medicamento Bravelle juntamente com o medicamento Menopur, pode-se misturar os dois medicamentos. Para isso, após a reconstituição do medicamento Menopur, deve-se injetar a dose prescrita do medicamento Menopur no frasco com a solução reconstituída do medicamento Bravelle. Em seguida, deve-se retirar a solução misturada que contém os dois medicamentos para a seringa e administrar por via subcutânea. Esse procedimento evita a necessidade de injeções separadas para cada medicamento.
- 9. Desconectar a seringa do frasco e retirar uma pequena quantidade de ar para a seringa (figura 9).
- 10. Manter a seringa na posição com a agulha para cima e bater suavemente com o dedo na seringa para injeções para que todas as bolhas de ar subam para o topo (figura 10). Retirar o ar da seringa pressionando suavemente o êmbolo até que uma gota do líquido apareça na ponta da agulha.
O médico ou a enfermeira informa a doente sobre onde injetar o medicamento (por exemplo, parte da frente da coxa, abdômen, etc.). Antes da injeção, deve-se desinfetar a pele no local da injeção.
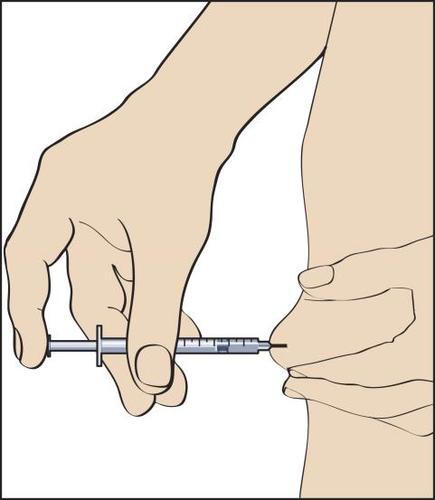
11
- 11. Para fazer a injeção, deve-se formar um dobra na pele entre os dedos e, com um movimento rápido, inserir a agulha em um ângulo de 90 graus (perpendicularmente). Injetar a solução, pressionando suavemente o êmbolo da seringa (figura 11), e, em seguida, retirar a seringa com a agulha.
Ao retirar a seringa com a agulha, deve-se pressionar o local da injeção para evitar sangramento. Um massage suave no local da injeção ajuda a espalhar a solução sob a pele. Os objetos usados não devem ser jogados fora em recipientes comuns de lixo, mas sim descartados de forma apropriada.
- 12. As injeções subsequentes da solução reconstituída do medicamento Menopur são feitas repetindo as etapas descritas nos pontos 8 a 11.
Uso de dose maior do que a recomendada do medicamento Menopur
Em caso de uso de dose maior do que a recomendada do medicamento Menopur, deve-se informar o médico.
Omissão da dose do medicamento Menopur
Não deve tomar uma dose dupla para compensar a dose omitida. Em caso de omissão da dose do medicamento Menopur, deve-se informar o médico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não todos os doentes os apresentem. Os hormônios utilizados no tratamento da infertilidade, como o Menopur, podem causar hiperestimulação ovarian, levando à ocorrência de uma doença chamada síndrome de hiperestimulação ovarian (OHSS), especialmente em mulheres com síndrome dos ovários policísticos. Os sintomas incluem: dor abdominal, inchaço abdominal, náuseas, vômitos, diarreia e ganho de peso. Em casos graves de OHSS, ocorreram complicações, como acúmulo de líquido na cavidade abdominal, cavidade pélvica e (ou) cavidade pleural, dificuldades respiratórias e diminuição da frequência ou quantidade de urina eliminada, formação de coágulos sanguíneos nos vasos sanguíneos (distúrbios tromboembólicos) e torção do ovário. Se ocorrer algum desses sintomas, deve contatar imediatamente o médico, mesmo que apareçam alguns dias após a última dose do medicamento. Durante o tratamento com o medicamento, podem ocorrer reações alérgicas (sensibilidade). Os sintomas dessas reações podem ser: erupções cutâneas, coceira, inchaço da garganta e dificuldades respiratórias. Se ocorrer algum desses sintomas, deve contatar imediatamente o médico. Os seguintes efeitos não desejados são comuns, ou seja, ocorrem em 1 a 10 de cada 100 doentes tratados: dor abdominal; dor de cabeça; náuseas; inchaço abdominal; dor na região pélvica; hiperestimulação ovarian que causa um nível alto de atividade (síndrome de hiperestimulação ovarian); reações no local da injeção, como dor, vermelhidão, hematoma, inchaço e (ou) coceira. Os seguintes efeitos não desejados são menos comuns, ou seja, ocorrem em 1 a 10 de cada 1000 doentes tratados: vômitos; distúrbios abdominais; diarreia; fadiga; tontura; cistos ovarianos (cistos contendo líquido nos ovários); distúrbios mamários, incluindo dor mamária, sensibilidade mamária, desconforto e inchaço mamário; ondas de calor. Os seguintes efeitos não desejados são pouco comuns, ou seja, ocorrem em 1 a 10 de cada 10 000 doentes tratados: acne; erupções cutâneas. Além dos anteriormente mencionados, foram observados após a autorização do medicamento Menopur para comercialização os seguintes efeitos não desejados, cuja frequência é desconhecida: distúrbios da visão; febre; mal-estar; reações alérgicas; ganho de peso; dor muscular e articular (por exemplo, dor nas costas, dor no pescoço e dor nos braços e pernas); torção do ovário, como complicação da hiperestimulação ovarian induzida; coceira; urticária; coágulos sanguíneos, como complicação da hiperestimulação ovarian induzida.
Notificação de efeitos não desejados
Se ocorrer algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Medicamentos do Ministério da Saúde: Rua São Sebastião, 45, 1200-829 Lisboa Tel: +351 21 792 70 00 Fax: +351 21 792 70 99 e-mail: [[email protected]](mailto:[email protected]) Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização. A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar Menopur
O medicamento deve ser conservado em local não acessível e invisível para crianças. Antes da reconstituição, conservar na geladeira (2°C - 8°C). Não congelar. Conservar no embalagem original para proteger da luz. Após a reconstituição, a solução pode ser conservada por 28 dias a uma temperatura inferior a 25°C. Não congelar. Não deve ser administrada a solução se contiver partículas sólidas ou não for transparente. Não deve ser utilizado este medicamento após o prazo de validade impresso na embalagem após a palavra Válido até. O prazo de validade é o último dia do mês indicado. Os medicamentos não devem ser jogados fora no esgoto ou em recipientes comuns de lixo. Deve-se perguntar ao farmacêutico como descartar os medicamentos que não são mais necessários. Esse procedimento ajudará a proteger o meio ambiente.
6. Conteúdo do embalagem e outras informações
O que contém Menopur
- O princípio ativo do medicamento é menotropina de alta pureza (menotropina, gonadotropina menopáusica humana, hMG) na quantidade equivalente a 1200 UI de FSH (hormônio folículo-estimulante) e 1200 UI de LH (hormônio luteinizante).
- Os outros componentes são: Pó: lactose monoidratada, polissorbato 20, fosfato dissódico heptaidratado, ácido fosfórico (concentrado) Solvente: água para injeções, metacresol (conservante)
Como é Menopur e que conteúdo tem a embalagem
Menopur é um pó e solvente para preparar solução para injeções. A embalagem contém: 1 frasco de pó; 2 seringas-ampolas com solvente para reconstituição; 1 agulha para reconstituição; 18 seringas para injeções de uso único graduadas em unidades FSH/LH com agulhas acopladas.
Titular da autorização de comercialização e fabricante:
Ferring GmbH Wittland 11, D-24109 Kiel, Alemanha Data da última revisão do folheto:01/2018 Para obter mais informações sobre o medicamento, deve-se contatar o representante do titular da autorização de comercialização: Ferring Pharmaceuticals Portugal, S.A. Rua dos Malhões, Edifício D. Sancho I, Quinta da Fonte, 2770-071 Paço de Arcos Tel: +351 21 486 91 00 Fax: +351 21 486 91 01
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorFerring GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a MenopurForma farmacêutica: Pó, 75 UI FSH + 75 UI LHSubstância ativa: human menopausal gonadotrophinFabricante: Ferring GmbHRequer receita médicaForma farmacêutica: Pó, 600 UI FSH + 600 UI LHSubstância ativa: human menopausal gonadotrophinRequer receita médicaForma farmacêutica: Pó, 150 UI FSH + 150 UI LHSubstância ativa: human menopausal gonadotrophinFabricante: Ferring GmbHRequer receita médica
Alternativas a Menopur noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Menopur em Espanha
Alternativa a Menopur em Ukraine
Médicos online para Menopur
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Menopur – sujeita a avaliação médica e regras locais.






