
Como usar Carmustine Zentiva
Folheto informativo: informação para o utilizador
Carmustine Zentiva, 100 mg, pó e solvente para solução para perfusão
para perfusão
karmustina
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Se o doente apresentar algum efeito secundário, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico ou enfermeiro. Ver secção 4.
Índice do folheto
- 1. O que é o medicamento Carmustine Zentiva e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Carmustine Zentiva
- 3. Como tomar o medicamento Carmustine Zentiva
- 4. Efeitos secundários possíveis
- 5. Como conservar o medicamento Carmustine Zentiva
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Carmustine Zentiva e para que é utilizado
Carmustine Zentiva, 100 mg, pó e solvente para solução para perfusão, é um medicamento que contém karmustina. A karmustina pertence a um grupo de medicamentos antineoplásicos, conhecidos como derivados de nitrosourea, cuja ação consiste em retardar o crescimento das células cancerígenas.
Carmustine Zentiva é utilizado no tratamento paliativo (alívio dos sintomas da doença e prevenção do sofrimento dos doentes) como monoterapia ou em tratamento combinado com outros medicamentos antineoplásicos aprovados, em certos tipos de cancro, como por exemplo:
- Tumores cerebrais - glioma, meduloblastoma, astrocitoma e metástases cerebrais
- Mieloma múltiplo (cancro que se desenvolve na medula óssea)
- Doença de Hodgkin (linfoma)
- Linfomas não hodgkinianos (linfoma)
- Tumores do trato gastrointestinal ou do trato digestivo
- Melamina maligna (cancro de pele)
A karmustina também é utilizada como tratamento de condicionamento antes do transplante de células estaminais autólogas (transplante de células estaminais autólogas) em doenças hematológicas malignas do sistema linfático (linfoma de Hodgkin e linfoma não hodgkiniano)
2. Informações importantes antes de tomar o medicamento Carmustine Zentiva
Quando não tomar o medicamento Carmustine Zentiva:
- se o doente for alérgico à karmustina ou a qualquer um dos outros componentes deste medicamento
(listados no ponto 6);
- O medicamento Carmustine Zentiva não deve ser utilizado em doentes com contagem de plaquetas (trombócitos), glóbulos brancos (leucócitos) ou glóbulos vermelhos (eritrócitos) reduzida devido à quimioterapia ou por outras razões;
- se o doente tiver disfunção renal grave;
- em crianças e adolescentes com menos de 18 anos;
- em mulheres que amamentam.
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Carmustine Zentiva, deve discutir com o médico, farmacêutico ou enfermeiro.
O efeito secundário principal deste medicamento é a supressão da medula óssea retardada, pelo que o médico irá controlar a morfologia do sangue semanalmente durante pelo menos 6 semanas após a administração da dose do medicamento. Durante o tratamento com as doses recomendadas, os cursos de tratamento com o medicamento Carmustine Zentiva não serão administrados com frequência superior a 6 semanas. Antes da administração do medicamento, o médico irá controlar a morfologia do sangue.
Deve informar imediatamente o médico se o doente apresentar algum dos seguintes sintomas:
- Sintomas de infecção (febre, dor de garganta persistente)
- Aumento da tendência para hematomas e/ou sangramentos
- Fadiga anormal
- Batimento cardíaco acelerado e/ou irregular
Antes de iniciar o tratamento, serão realizados exames de função hepática, pulmonar e renal, que serão repetidos regularmente durante o tratamento.
Durante o tratamento, podem ocorrer sintomas gastrointestinais, como vômitos e náuseas.
Como o tratamento com o medicamento Carmustine Zentiva pode causar lesões pulmonares, antes de iniciar o tratamento, será realizado um exame radiográfico do tórax e exames de função pulmonar (ver também o ponto "Efeitos secundários possíveis").
O tratamento com altas doses de karmustina (até 600 mg/m2) é utilizado apenas em combinação com o transplante subsequente de células estaminais. As altas doses podem aumentar o risco de lesões pulmonares, renais, hepáticas, cardíacas e gastrointestinais, bem como infecções e distúrbios eletrolíticos (baixo nível de potássio, magnésio e fósforo no sangue).
A dor abdominal (neutropenia) pode ocorrer como efeito secundário relacionado à terapia, após o tratamento com quimioterapia.
Os doentes que têm várias doenças e têm um estado de saúde mais grave estão mais propensos a efeitos secundários. Isso é particularmente importante em doentes idosos.
O médico irá informar o doente sobre a possibilidade de lesões pulmonares e reações alérgicas e seus sintomas.
Se ocorrerem tais sintomas, deve contactar imediatamente o médico (ver ponto 4).
As mulheres e homens em idade reprodutiva devem utilizar métodos anticoncepcionais eficazes durante o tratamento e por pelo menos 6 meses após o tratamento (por favor, leia o subponto "Gravidez, amamentação e fertilidade").
Medicamento Carmustine Zentiva e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar, incluindo medicamentos sem prescrição médica, como:
- Fenitoína utilizada no tratamento de epilepsia
- Cimetidina utilizada no tratamento de problemas gastrointestinais, como dispepsia
- Digoxina utilizada no tratamento de arritmias cardíacas
- Melfalana - medicamento antineoplásico
- Dexametasona utilizada como medicamento anti-inflamatório e imunossupressor
- Metotrexato, ciclofosfamida, procarbazina, clorometina (mostarda azotada), fluorouracila, vinblastina, actinomicina (dactinomicina), bleomicina, doxorrubicina (adriamicina) utilizados no tratamento de vários tipos de cancro.
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeiar engravidar, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
Gravidez e fertilidade
O medicamento Carmustine Zentiva não deve ser utilizado durante a gravidez, pois pode ter efeitos prejudiciais no feto. Portanto, não deve ser administrado a mulheres grávidas.
Em caso de tratamento durante a gravidez, a paciente deve estar ciente dos riscos potenciais para o feto. As mulheres em idade reprodutiva devem evitar engravidar durante o tratamento com este medicamento. As mulheres capazes de engravidar devem ser informadas sobre a necessidade de utilizar métodos anticoncepcionais eficazes para evitar a gravidez durante o tratamento com este medicamento e por pelo menos 6 meses após o tratamento.
Os homens devem utilizar métodos anticoncepcionais adequados durante o tratamento com o medicamento Carmustine Zentiva e por pelo menos 6 meses após o tratamento, para evitar a gravidez em suas parceiras. O medicamento Carmustine Zentiva pode afetar a fertilidade nos homens. Deve ser recomendado aos pacientes que obtenham aconselhamento sobre fertilidade/planeamento familiar antes de iniciar o tratamento com o medicamento Carmustine Zentiva.
Amamentação
Não é permitido amamentar durante o tratamento com este medicamento e por 7 dias após o tratamento. Não pode ser excluída a possibilidade de risco para os recém-nascidos/lactentes.
Condução de veículos e utilização de máquinas
O efeito do medicamento na capacidade de conduzir veículos e utilizar máquinas é desconhecido. Deve consultar o médico antes de conduzir veículos ou utilizar qualquer tipo de ferramenta ou máquina, pois a tontura é um efeito secundário relatado durante o tratamento com este medicamento, que pode afetar a capacidade de conduzir veículos ou utilizar máquinas.
Medicamento Carmustine Zentiva contém propileno glicol
O propileno glicol contido neste medicamento pode ter efeitos semelhantes aos do álcool e aumentar a probabilidade de efeitos secundários.
Não utilizar este medicamento em crianças com menos de 5 anos.
Utilizar este medicamento apenas se prescrito por um médico. O médico pode realizar exames adicionais durante o tratamento com este medicamento.
3. Como tomar o medicamento Carmustine Zentiva
O medicamento Carmustine Zentiva será sempre administrado por pessoal médico especializado com experiência no tratamento com medicamentos antineoplásicos.
Adultos
A posologia depende do estado de saúde, área de superfície corporal e resposta ao tratamento. O medicamento é geralmente administrado não mais frequentemente do que a cada 6 semanas. A dose recomendada do medicamento Carmustine Zentiva utilizado como monoterapia em doentes previamente não tratados é de 150 a 200 mg/m2 de área de superfície corporal (ASC) por via intravenosa a cada 6 semanas. O medicamento pode ser administrado em dose única ou pode ser dividido em infusões diárias em doses de 75 a 100 mg/m2 de ASC durante dois dias consecutivos.
A posologia também depende se o medicamento Carmustine Zentiva é administrado com outros medicamentos antineoplásicos.
As doses serão aumentadas de acordo com a resposta do doente ao tratamento.
A dose recomendada de karmustina administrada por via intravenosa em combinação com outros quimioterápicos antes do transplante de células estaminais da medula óssea é de 300 a 600 mg/m2.
Para evitar a toxicidade da medula óssea, a morfologia do sangue será frequentemente verificada e a dose será ajustada se necessário.
Via de administração
Após a reconstituição e diluição, o medicamento Carmustine Zentiva é administrado por via intravenosa em infusão (infusão intravenosa) durante um a dois horas. O tempo de duração da infusão não deve ser inferior a uma hora - caso contrário, pode ocorrer ardor e dor no local de administração do medicamento. O local de administração do medicamento será observado durante a infusão.
O tempo de duração do tratamento será determinado pelo médico e pode variar de doente para doente.
Utilização em crianças e adolescentes (com menos de 18 anos)
O medicamento Carmustine Zentiva não deve ser utilizado em crianças e adolescentes devido ao alto risco de toxicidade pulmonar.
Utilização em pessoas idosas
O medicamento Carmustine Zentiva pode ser utilizado em doentes idosos com cautela.
A função renal será monitorizada.
Utilização de dose maior do que a recomendada do medicamento Carmustine Zentiva
Como o medicamento será administrado por um médico ou enfermeiro, a utilização de dose incorreta é improvável. Deve informar o médico ou enfermeiro se tiver alguma dúvida sobre a quantidade de medicamento administrada.
Se tiver mais alguma dúvida sobre a utilização deste medicamento, deve consultar o médico, farmacêutico ou enfermeiro.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não todos os doentes os experimentem.
Deve informar imediatamente o médico ou enfermeiro se ocorrer algum dos seguintes sintomas:
respiração sibilante, problemas respiratórios, edema de pálpebras, face ou lábios, erupções cutâneas ou prurido (especialmente se afetam todo o corpo), bem como sensação de desmaio iminente. Estes podem ser sintomas de reação alérgica grave.
O medicamento Carmustine Zentiva pode causar os seguintes efeitos secundários:
Muito frequentes(podem ocorrer em mais de 1 em cada 10 doentes)
- Supressão da medula óssea retardada (redução do número de glóbulos produzidos pela medula óssea);
- Ataxia (falta de coordenação muscular voluntária);
- Tontura;
- Dor de cabeça;
- Olho vermelho, visão turva, hemorragia retiniana, inflamação da íris e do nervo óptico;
- Hipotensão (queda da pressão arterial) no tratamento com altas doses;
- Inflamação da veia associada a dor, edema, vermelhidão, sensibilidade;
- Distúrbios respiratórios (distúrbios pulmonares) associados a dificuldade respiratória. Este medicamento pode causar lesões pulmonares graves (potencialmente fatais). As lesões pulmonares podem ocorrer após muitos anos de tratamento. Deve informar imediatamente o médico se o doente apresentar algum dos seguintes sintomas: falta de ar, tosse persistente, dor no peito, fraqueza/moleza persistentes;
- Náuseas e vômitos intensos; ocorrendo dentro de 2-4 horas após a administração do medicamento e durando 4-6 horas;
- Em caso de contato com a pele: inflamação da pele;
- Contato acidental com a pele pode causar coloração temporária (escurecimento da pele ou unhas).
Frequentes(podem ocorrer em até 1 em cada 10 doentes)
- Leucemias agudas (cancro do sangue) displasias da medula óssea (desenvolvimento anormal da medula óssea) devido ao tratamento prolongado. Podem ocorrer os seguintes sintomas: sangramento gengival, dor óssea, febre, infecções frequentes, sangramento nasal frequente ou intenso, nódulos devido ao edema dos gânglios linfáticos na região do pescoço, antebraço, abdômen ou virilha, palidez da pele, falta de ar, fraqueza, moleza ou falta de energia em geral;
- Anemia (redução do número de glóbulos vermelhos no sangue);
- Encefalopatia (doença cerebral) no tratamento com altas doses; possíveis sintomas incluem: fraqueza muscular em uma área do corpo, incapacidade de tomar decisões ou concentração, movimentos involuntários dos músculos, tremores, dificuldade de fala ou deglutição, convulsões;
- Perda de apetite (inapetência);
- Constipação;
- Diarréia;
- Inflamação da boca e lábios;
- Toxicidade hepática reversível no tratamento com altas doses, retardada até 60 dias após a administração. Este distúrbio pode levar a um aumento da atividade das enzimas hepáticas e do nível de bilirrubina (estes são parâmetros medidos em exames de sangue);
- Alopecia (perda de cabelo);
- Verdade da pele;
- Reações no local de injeção.
Pouco frequentes(podem ocorrer em até 1 em cada 1.000 doentes)
- Doença veno-oclusiva (obstrução progressiva das veias) no tratamento com altas doses, na qual as pequenas veias no fígado são obstruídas. Podem ocorrer os seguintes sintomas: acúmulo de líquido na cavidade abdominal, aumento do baço, sangramento grave no esôfago, icterícia da pele e brancos dos olhos;
- Dificuldade respiratória devido à doença pulmonar, na qual o tecido pulmonar é coberto por cicatrizes
(fibrose pulmonar intersticial) (no tratamento com doses baixas); os sintomas incluem:
tosse seca, falta de ar, fadiga, perda de peso;
- Doenças renais;
- Ginecomastia (aumento da mama em homens);
- Sangramento gastrointestinal;
- Inflamação do nervo óptico e da retina adjacente do olho
Muito raros(podem ocorrer em até 1 em cada 10.000 doentes)
- Inflamação da parede da veia com trombose associada (tromboflebite).
Desconhecidos(frequência não pode ser estimada com base nos dados disponíveis)
- Dor muscular;
- Tumores secundários (cancro causado por radioterapia ou quimioterapia);
- Convulsões (incluindo estado de mal epiléptico);
- Lesões teciduais devido à extravasação do medicamento no local de administração;
- Infertilidade;
- Desenvolvimento prejudicado do embrião e/ou feto em mulheres grávidas;
- Quaisquer sintomas de infecção;
- Batimento cardíaco acelerado, dor no peito;
- Reações alérgicas;
- Distúrbios eletrolíticos (baixo nível de potássio, magnésio e fosfato no sangue);
- Dor abdominal (neutropenia);
- Após a administração de doses cumulativas altas e após tratamento prolongado com o medicamento Carmustine Zentiva e outros derivados de nitrosourea, foi observada redução renal, acúmulo progressivo de certos produtos metabólicos no sangue (azotemia) e insuficiência renal. Após a administração de doses cumulativas mais baixas, também foi observada lesão renal
Notificação de efeitos secundários
Se o doente apresentar algum efeito secundário, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico ou enfermeiro. Os efeitos secundários podem ser notificados diretamente para:
Departamento de Monitorização de Efeitos Secundários de Medicamentos da Autoridade de Regulação de Medicamentos
Rua Jerozolimskie 181C
PL-02 222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Site: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados para o titular da autorização de comercialização ou seu representante em Portugal.
A notificação de efeitos secundários é importante, pois permite a recolha de mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Carmustine Zentiva
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Conservar e transportar em temperatura refrigerada (2°C-8°C).
Não utilizar este medicamento após o prazo de validade impresso na embalagem e na caixa de cartão após: Prazo de validade (EXP). O prazo de validade é o último dia do mês indicado.
O medicamento será conservado pelo médico ou outra pessoa do pessoal médico especializado.
Após a reconstituição de acordo com as recomendações, a karmustina para injeção é estável por 480 horas na geladeira (2°-8°C) e 24 horas à temperatura ambiente (25°C ±2°C) em recipiente de vidro. Antes da utilização, verificar as ampolas reconstituídas para formação de cristais. Se cristais forem observados, podem ser dissolvidos novamente aquecendo a ampola à temperatura ambiente com agitação.
Do ponto de vista microbiológico, a solução reconstituída deve ser utilizada imediatamente.
Conservar a ampola na embalagem externa para proteger da luz.
A solução-mãe preparada deve ser subsequentemente diluída para 500 ml de solução de cloreto de sódio para injeção ou solução de dextrose a 5% para injeção, em recipientes de vidro ou polipropileno. Estas soluções são estáveis fisicamente e quimicamente por 8 horas à temperatura de 25°C± 2°C, se protegidas da luz. As soluções também são estáveis por 48 horas quando armazenadas na geladeira (2°C–8°C) e por mais 6 horas à temperatura de 25°C± 2°C, se protegidas da luz.
A solução deve ser protegida da luz até o final da administração.
Os medicamentos não devem ser jogados na canalização ou lixeiras domésticas. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não sejam necessários. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Carmustine Zentiva
O princípio ativo do medicamento é a karmustina.
Uma ampola de pó para solução para perfusão contém 100 mg de karmustina.
Uma ampola de solvente contém 3 mL de propileno glicol.
Após a reconstituição com o solvente fornecido, 1 mL de solução contém 33,3 mg de karmustina.
Os excipientes são:
- Pó: não contém excipientes.
- solvente: propileno glicol.
Como é o medicamento Carmustine Zentiva e que conteúdo tem a embalagem
O medicamento Carmustine Zentiva é um pó e solvente para solução para perfusão.
O pó é amarelo-pálido e é fornecido em uma ampola de vidro laranja tipo I (30 mL) com uma tampa de borracha de bromobutilo e uma tampa de polipropileno.
O solvente é uma solução clara, incolor e viscosa e é fornecido em uma ampola de vidro incolor tipo I (5 mL) com uma tampa de borracha de bromobutilo e uma tampa de polipropileno.
Uma embalagem contém uma ampola com 100 mg de pó e uma ampola com 3 mL de solvente.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Zentiva k.s.
U Kabelovny 130
Dolni Měcholupy
102 37 Praga 10
República Checa
Importador:
MIAS Pharma Limited
Suite 2, Stafford House, Strand Road
Portmarnock, Co. Dublin
Irlanda
Tillomed Malta Limited,
Malta Life Sciences Park,
LS2.01.06 Industrial Estate,
San Gwann, SGN 3000, Malta
Este medicamento está autorizado para comercialização nos países membros da Área Económica Europeia sob as seguintes denominações:
Bélgica:
Carmustine Tillomed 100 mg pó e solvente para solução para perfusão
República Checa:
Carmustine Zentiva
Dinamarca:
Carmustin Macure
Finlândia:
Carmustine Macure 100 mg pó e solvente para solução para perfusão
Grécia:
Carmustine/Tillomed 100 mg pó e solvente para solução para perfusão
Hungria:
Carmustine Zentiva 100 mg pó e solvente para solução para perfusão
Irlanda:
Carmustine 100 mg pó e solvente para solução para perfusão
Itália:
BICNU
Lituânia
Carmustine Zentiva 100 mg pó e solvente para solução para perfusão
Países Baixos:
Carmustine Glenmark 100 mg, pó e solvente para solução para perfusão
Noruega:
Carmustine Macure
Polônia:
Carmustine Zentiva
Portugal:
Carmustine Tillomed 100 mg pó e solvente para solução para perfusão
Eslováquia:
Carmustine Zentiva
Eslovênia:
Karmustin Tillomed 100 mg pó e solvente para solução para perfusão
Suécia:
Carmustine Macure
Data da última revisão do folheto:março de 2025
---------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico especializado:
Abaixo está uma descrição resumida do modo de preparo e/ou administração, incompatibilidades farmacêuticas, posologia do medicamento, superdose ou ações necessárias para monitorização, bem como exames laboratoriais, com base na caracterização atual do produto.
Pó liofilizado para solução para perfusão não contém conservantes e não é destinado a ser utilizado em ampolas multidose. O produto é destinado apenas a uso único. Deve ser exercida cautela ao manipular o produto e evitar o contato com a pele. A reconstituição e a diluição adicional devem ser realizadas em condições assépticas.
Observando as condições de armazenamento recomendadas, pode ser evitada a degradação das substâncias contidas na ampola não aberta até a data de validade indicada na embalagem.
O armazenamento da karmustina a uma temperatura de 27°C ou superior pode levar à fusão da substância, pois a karmustina tem um ponto de fusão baixo (aproximadamente 30,5°C a 32,0°C). A degradação do produto pode ser indicada pela presença de uma camada oleosa no fundo da ampola. Não deve ser utilizado um produto com tal apresentação.
Em caso de dúvida sobre se o produto permaneceu em condições de refrigeração adequadas, deve ser verificada imediatamente todas as ampolas na caixa. Para verificar, a ampola deve ser colocada em luz clara.
A reconstituição e a diluição do pó para solução para perfusão devem ser realizadas da seguinte forma
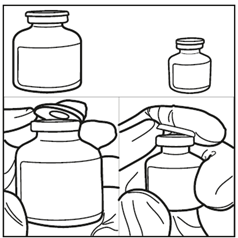
Etapa 1: Retirar as duas ampolas da embalagem e aguardar até que atinjam a temperatura ambiente. (Mín. 10 minutos).
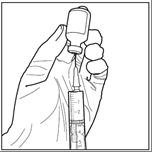
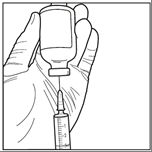
Etapa 2: De forma asséptica, retirar 3 ml do solvente estérilda ampola do solvente utilizando uma seringa estéril. Certificar-se de que foi retirada a totalidade (3 ml) do solvente estéril para a seringa.
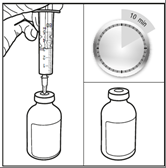
Etapa 3: Injetar o solvente estéril na ampola contendo 100 mg de karmustina e deixar em infusão por pelo menos 10 minutos.
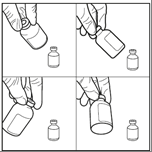
Etapa 4: Misturar (realizando movimentos circulares) por pelo menos 60 segundos sem parar, para obter uma solução clara
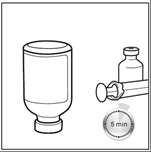
Etapa 5: A ampola deve ser mantida na posição invertida por 5 minutos antes de retirar a solução reconstituída
Cada mililitro da solução-mãe obtida após a reconstituição contém 33,3 mg de karmustina.
A solução obtida após a reconstituição é amarelada.
A solução-mãe deve ser diluída imediatamente para 500 ml de solução de cloreto de sódio para injeção ou solução de dextrose a 5% para injeção, em recipientes de vidro ou polipropileno. A solução resultante contém uma concentração final de 0,2 mg/mL de karmustina, e deve ser armazenada longe da luz.
.
Antes da administração, verificar as ampolas reconstituídas para formação de cristais. Se cristais forem observados, podem ser dissolvidos novamente aquecendo a ampola à temperatura ambiente com agitação. As ampolas reconstituídas devem ser verificadas antes da administração para detectar a presença de partículas sólidas e alterações da cor.
Modo de administração:
A karmustina é destinada a administração intravenosa após reconstituição e diluição adicional.
A solução obtida após a reconstituição e diluição deve ser administrada imediatamente em forma de infusão intravenosa durante 1-2 horas, protegendo a solução da luz. O tempo de duração da infusão não deve ser inferior a 1 hora, pois a administração em tempo mais curto pode causar dor e ardor no local de injeção. O local de injeção deve ser observado durante a administração do medicamento.
A administração do medicamento deve ser concluída dentro de 3 horas após a reconstituição/diluição.
A infusão deve ser realizada utilizando um conjunto de infusão com PE que não contenha PCV.
Deve ser seguido o procedimento recomendado para o manuseio e eliminação de medicamentos antineoplásicos.
Posologia e exames laboratoriais
Doses iniciais
A dose recomendada do medicamento Carmustine Zentiva utilizado como monoterapia em doentes previamente não tratados é de 150 a 200 mg/m2 de área de superfície corporal (ASC) por via intravenosa a cada 6 semanas. O medicamento pode ser administrado em dose única ou pode ser dividido em infusões diárias em doses de 75 a 100 mg/m2 de ASC durante dois dias consecutivos.
Quando o medicamento Carmustine Zentiva é utilizado em combinação com outros medicamentos com efeito mielossupressor ou em doentes com reserva de medula óssea reduzida, as doses devem ser ajustadas de acordo com o perfil hematológico do doente, como descrito abaixo.
Monitorização e doses subsequentes
Um curso de tratamento subsequente com o medicamento Carmustine Zentiva pode ser administrado apenas quando os parâmetros da morfologia do sangue retornarem a valores aceitáveis (contagem de plaquetas acima de 100.000/mm3, leucócitos acima de 4.000/mm3), o que geralmente ocorre dentro de seis semanas. A morfologia do sangue deve ser frequentemente verificada, e o tratamento subsequente não deve ser administrado antes de seis semanas devido à possibilidade de toxicidade hematológica retardada.
Após a administração da dose inicial, as doses subsequentes devem ser ajustadas de acordo com a resposta hematológica do doente à dose anterior, tanto na monoterapia quanto na terapia combinada com outros medicamentos com efeito mielossupressor. É recomendado o seguinte esquema de ajuste de dose:
| Valor mínimo após a dose anterior | Percentagem da dose anterior a administrar | |
| Leucócitos/mm3 | Plaquetas/mm3 | |
| >4000 | >100 000 | 100% |
| 75 000 – 99 999 | 100% |
| 25 000 – 74 999 | 70% |
| <2000 | <25 000< td> | 50% |
Pacientes idosos
Em princípio, em pacientes idosos, as doses devem ser escolhidas com cautela, e particularmente, deve-se começar com a dose mais baixa da faixa de doses, devido à frequência mais elevada de disfunção hepática, renal ou cardíaca; também deve-se levar em consideração as doenças concomitantes e o tratamento com outros medicamentos.
Como os pacientes idosos têm maior probabilidade de disfunção renal, deve-se ter cautela na escolha da dose e monitorar a função renal, bem como ajustar a dose adequadamente.
Crianças e adolescentes
A karmustina é contraindicada em crianças e adolescentes com menos de 18 anos (ver ponto 4.3) devido ao alto risco de toxicidade pulmonar (ver ponto 4.4).
Compatibilidade/Incompatibilidade com recipientes
A solução para perfusão é instável em recipientes de cloruro de polivinila (PVC). A solução de karmustina deve ser administrada apenas em recipientes de vidro ou polipropileno.
Não misturar o medicamento com outros medicamentos, exceto os mencionados no ponto 6.6.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorMIAS Pharma Ltd Tillomed Malta Limited
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Carmustine ZentivaForma farmacêutica: Pó, 100 mgSubstância ativa: carmustineRequer receita médicaForma farmacêutica: Pó, 50 mgSubstância ativa: carmustineRequer receita médicaForma farmacêutica: Pó, 300 mgSubstância ativa: carmustineRequer receita médica
Alternativas a Carmustine Zentiva noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Carmustine Zentiva em Spain
Alternativa a Carmustine Zentiva em Ukraine
Médicos online para Carmustine Zentiva
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Carmustine Zentiva – sujeita a avaliação médica e regras locais.






