
Como usar GLIADEL 7,7 mg IMPLANTE
Introdução
Prospecto: informação para o utilizador
GLIADEL 7,7 mg implante
Carmustina
Leia todo o prospecto atentamente antes de começar a usar o medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é GLIADEL implante e para que é utilizado
- O que precisa saber antes de começar a usar GLIADEL implante
- Como usar GLIADEL implante
- Possíveis efeitos adversos
- Conservação de GLIADEL implante
- Conteúdo do envase e informação adicional
1. O que é Gliadel implante e para que é utilizado
GLIADEL implante é um sistema de libertação do princípio ativo anticancerígeno carmustina directamente no local onde se encontrava o tumor cerebral, após a sua extirpação por cirurgia. A carmustina pertence a um grupo de substâncias anticancerígenas que permitem combater o crescimento das células tumorais localizadas no cérebro.
GLIADEL implante pode ser utilizado em combinação com a radioterapia para o tratamento de tumores cerebrais.
Verificou-se que GLIADEL implante prolonga a sobrevivência dos pacientes com tumor cerebral.
2. O que precisa saber antes de começar a usar Gliadel implante
Não use GLIADEL implante
- se é alérgico ao princípio ativo ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Após a cirurgia para extirpar o tumor cerebral e introduzir GLIADEL implante, o seu médico ou cirurgião o vigiará de perto por si houver complicações. Em alguns casos, pode ser que o cirurgião tenha que voltar a operá-lo (devido a complicações ou reaparição do tumor). As complicações incluem:
- Convulsões (crises)
- Infecções no cérebro (infecções dentro do crânio)
- Inflamação do cérebro devido à acumulação de líquidos
- Perda de fluido cerebral
- Problemas com a cicatrização da ferida
O seu médico o controlará estreitamente no caso de que esteja a tomar esteroides devido a uma inflamação ou pressão elevada de fluidos no cérebro.
Antes de introduzir os implantes, pode ser que o cirurgião tenha que fechar um canal no cérebro para evitar que os implantes passem através deste, o que poderia provocar uma acumulação de líquidos dentro do crânio.
Após a introdução de GLIADEL implante, mediante uma técnica de obtenção de imagens, pode ser detectada inflamação no cérebro devido à acumulação de líquidos e inflamação provocada por GLIADEL implante ou progressão do tumor.
Outros medicamentos e GLIADEL implante
Informa o seu médico se está a utilizar ou utilizou recentemente outros medicamentos, mesmo os adquiridos sem receita.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de utilizar este medicamento. GLIADEL implante não foi estudado em mulheres grávidas. Verificou-se que o princípio ativo, a carmustina, afeta negativamente o desenvolvimento do feto. GLIADEL implante não deve ser utilizado em mulheres grávidas ou em período de amamentação. Aconselha-se às mulheres em idade fértil que utilizem métodos anticonceptivos eficazes durante 6 meses após receber GLIADEL implante. Os varões que tiverem uma parceira em idade fértil devem utilizar métodos anticonceptivos durante 90 dias após receber GLIADEL implante.
Condução e uso de máquinas
Não se recomenda a condução após o tratamento. Consulte com o seu médico antes de conduzir ou usar ferramentas ou máquinas.
3. Como usar Gliadel implante
GLIADEL implante só deve ser utilizado em adultos.
O cirurgião ou o farmacêutico se asegurarão de que o medicamento esteja disponível para a sua operação. Após a extirpação do tumor cerebral, o cirurgião introduzirá até oito implantes no espaço que ocupava o tumor. O seu cirurgião decidirá o número de implantes que introduzirá na cavidade criada após a extirpação do tumor cerebral. Os implantes são colocados de maneira a cobrir a maior superfície possível desta cavidade. Após a operação, os implantes se dissolvem lentamente ao longo de duas a três semanas, libertando assim a carmustina directamente para as células circundantes.
Se tiver alguma outra dúvida sobre o uso deste produto, pergunte ao seu cirurgião.
4. Possíveis efeitos adversos
Como todos os medicamentos, GLIADEL pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Se considera que algum dos efeitos adversos que sofre é grave ou se aprecia algum efeito adverso não mencionado neste prospecto, informe o seu médico.
A seguir são apresentados os efeitos adversos mais frequentes observados durante os ensaios clínicos em pacientes com glioma maligno (tumor cerebral) de novo diagnóstico (120 pacientes) ou glioma maligno recorrente diagnosticado (110 pacientes).
As seguintes quatro categorias de efeitos adversos possivelmente estejam associadas ao uso de GLIADEL implante:
|
Durante os ensaios clínicos, foram observados os seguintes efeitos adversos nos pacientes, que foram semelhantes aos observados em pacientes submetidos à cirurgia de tumor cerebral sem colocação de GLIADEL implantes.
Muito frequentes: podem afetar mais de 1 de cada 10 pacientes
- Trastornos psiquiátricos
Depressão
- Trastornos do sistema nervoso
Debilidade, especialmente de um lado do corpo; convulsões (espasmos); confusão; dor de cabeça, inflamação do crânio; sonolência; alterações da fala
- Trastornos vasculares
Inflamação vascular
- Trastornos gastrointestinais
Náuseas; vómitos; constipação
- Trastornos da pele e do tecido subcutâneo
Erupção cutânea; perda de cabelo
- Trastornos renais e urinários
Infecção urinária
- Trastornos gerais e alterações no local de administração
Piora do estado geral; infecção; dor de cabeça; sensação de debilidade; febre ou dor, cicatrização anormal (lenta) da ferida cirúrgica.
Frequentes: podem afetar até 1 de cada 10 pacientes
- Trastornos do sangue e do sistema linfático
Diminuição de glóbulos vermelhos (anemia), o que pode causar palidez cutânea, fadiga e falta de ar; diminuição de plaquetas sanguíneas, o que aumenta o risco de hemorragia; aumento de glóbulos brancos
- Trastornos endócrinos (problemas hormonais)
Diabetes mellitus
- Trastornos do metabolismo e da nutrição
Edema periférico (excesso de líquido nos braços ou nas pernas); baixa concentração de sódio no sangue, o que pode ocasionar fadiga e confusão, tiques musculares, espasmos e coma; níveis altos de açúcar no sangue, baixa concentração de potássio no sangue, o que pode ocasionar debilidade e tiques musculares, e ritmo cardíaco anormal
- Trastornos psiquiátricos
Mudanças na personalidade, ansiedade excessiva, pensamento anormal, alucinações, insônia (pouco sono)
- Trastornos do sistema nervoso
Amnésia (perda de memória); aumento da tensão arterial intracraniana devido a um excesso de líquido; paralisia facial; falta de coordenação; sensibilidade reduzida à estimulação; sensações anormais de queimadura e picada; dificuldade para caminhar; tontura; crise epiléptica (espasmos); tremores; meningite; abscesso (concentração localizada de pus); perda do conhecimento
- Trastornos oculares
Visão borrosa ou anormal; inflamação do contorno dos olhos; dor de olhos
- Trastornos vasculares
Sangramento, tensão sanguínea alta ou baixa
- Trastornos respiratórios, torácicos e mediastínicos
Infecção pulmonar ou pneumonia causante de falta de ar, tosse e febre
- Trastornos gastrointestinais
Infecção microbiana da boca; diarreia; constipação; incontinência fecal (perda de fezes incontrolada); dificuldade para engolir; hemorragia gástrica ou intestinal
- Trastornos epiteliais e subcutâneos
Erupção cutânea
- Trastornos musculoesqueléticos e do tecido conjuntivo
Infecção geral
- Trastornos renais e urinários
Incontinência urinária, infecções urinárias
- Trastornos gerais e alterações no local de administração
Dor abdominal, desde as costas até o peito; inflamação facial; abscesso (concentração localizada de pus); lesão acidental; reação alérgica; dor de pescoço; infecção sanguínea
Efeitos adversos pouco frequentes (entre 1 e 10 pacientes de cada 1000)
Lesões traumáticas, intoxicações e complicações de procedimentos terapêuticos
Neumocefalia (acumulação de ar na zona do implante)
Comunicação de efeitos adversos
Se experimentar algum tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto.
Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Gliadel implante
Mantenha este medicamento fora da vista e do alcance das crianças.
Conservar no congelador a uma temperatura de -20ºC ou inferior.
Os sobres exteriores sem abrir podem ser mantidos a uma temperatura menor de 22ºC durante um máximo de 6 horas. Podem ser recongelados uma única vez os sobres se não foram abertos e permaneceram por um máximo de 6 horas a uma temperatura menor de 22º C. Após a recongelção, o medicamento deve ser utilizado em 30 dias.
Não utilize GLIADEL implante após a data de validade que aparece no envase e/ou no sobre após CAD. A data de validade é o último dia desse mês que se indica. O seu cirurgião ou o farmacêutico do hospital verificarão a data de validade antes do uso dos implantes.
6. Conteúdo do envase e informação adicional
Composição do implante GLIADEL
- O princípio ativo é a carmustina. Cada implante contém 7,7 mg de carmustina
- O outro componente é o polifeprosan 20.
Aspecto do produto e conteúdo do envase
O implante GLIADEL está disponível em caixas de oito lâminas circulares implantáveis. Essas lâminas são implantes em forma de disco de cor branca opaca a amarela. Cada implante está embalado individualmente em um sobrecartão recoberto por uma lâmina de alumínio.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
CLINIGEN HEALTHCARE B.V.
Schiphol Boulevard 359
WTC Schiphol Airport, D Tower 11th floor
1118BJ Schiphol
Países Baixos
Responsável pela fabricação
ALMAC PHARMA SERVICES (IRELAND) LIMITED
Finnabair Industrial Estate
Dundalk
Co. Louth A91 P9KD
Irlanda
Tel: +353 42 932 0718
Fax: +353 42 932 0718
ALMAC PHARMA SERVICES LIMITED
20 Seagoe Industrial Estate
Craigavon, BT63 5QD,
Reino Unido
Tel: +44 (0)28 3836 3363
Fax: +44 (0)28 3836 3300
Data da última revisão deste prospecto: 04/2021
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Española de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
PROSPECTO INFORMATIVO PARA PROFISSIONAIS DE SAÚDE
- NOME DO MEDICAMENTO
GLIADEL 7,7 mg implante
- COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada implante contém 7,7 mg de carmustina.
Para consultar a lista completa de excipientes, ver seção 6.1.
- FORMA FARMACÊUTICA
Implante.
Implante em forma de disco de cor branca opaca a amarela.
- DADOS CLÍNICOS
4.1Indicações terapêuticas
O implante GLIADEL está indicado para o tratamento de pacientes adultos com glioma maligno de alto grau de novo diagnóstico como terapia adjuvante à cirurgia e radiação.
O implante GLIADEL está indicado como terapia adjuvante à cirurgia para o tratamento de pacientes com glioblastoma multiforme recidivante diagnosticado histologicamente, nos quais está indicada a ressecção cirúrgica.
4.2Posologia e forma de administração
Posologia
Via intralesional apenas.
Cada implante de GLIADEL contém 7,7 mg de carmustina, por lo que, após a colocação de oito implantes na cavidade de ressecção do tumor, se libera uma dose de 61,6 mg.
População pediátrica
Não se determinaram a segurança e a eficácia do implante GLIADEL em crianças menores de 18 anos. Não há dados disponíveis.
Forma de administração
Recomenda-se a colocação de um máximo de oito implantes se o tamanho e a forma da cavidade de ressecção o permitirem. Podem ser utilizados implantes seccionados pela metade, mas os implantes fracionados em mais de duas partes devem ser eliminados em contêineres apropriados para resíduos biopeligrosos (ver seção 6.6).
Recomenda-se proceder à colocação dos implantes diretamente do envase interior estéril do produto para a cavidade de ressecção. Podem ser colocados apósitos de oxicelulosa sobre os implantes para fixá-los à superfície da cavidade (ver seção 6.6).
4.3Contraindicações
Hipersensibilidade ao princípio ativo, ou a algum dos excipientes incluídos na seção 6.1.
4.4Advertências e precauções especiais de emprego
Os pacientes submetidos à craneotomia e implantação do implante GLIADEL, devem ser monitorizados de forma estrita para detectar as possíveis complicações da craneotomia, que incluem convulsões, infecções intracranianas, cicatrização anormal, edema cerebral e neumocefalia (ver seção 4.8). Em pacientes tratados com implante GLIADEL, foram descritos casos de efeito de massa intracerebral que não respondem aos corticosteroides, incluindo um caso que resultou em uma hernia cerebral. Nos pacientes tratados com implante GLIADEL, deve-se monitorizar rigorosamente a aparência de edema cerebral/hipertensão intracraniana após a utilização de corticoides (ver seção 4.8). As perdas de líquido cefalorraquídeo (LCR) foram mais frequentes em pacientes tratados com implante GLIADEL. Recomenda-se um cuidado especial para o fechamento impermeável da duramadre e no tratamento das lesões locais (ver seção 4.8).
Foram descritos mudanças na parede dos vasos sanguíneos cerebrais localizados perto da oblea de Gliadel, incluindo os casos de aneurisma que ocasionam sangramento cerebral vários meses após o implante de uma oblea de Gliadel. Deve-se evitar a implantação de obleas de Gliadel adjacente a grandes vasos cerebrais.
O desenvolvimento de edema cerebral com efeito de massa (devido à recidiva do tumor, infecção intracraniana ou necrose) pode necessitar de reintervenção e, em alguns casos, retirada do implante GLIADEL ou seus restos.
Deve-se evitar a comunicação entre a cavidade de ressecção cirúrgica e o sistema ventricular para evitar que os implantes se desloquem para o sistema ventricular e possam produzir hidrocefalia obstructiva. Se existe uma via de comunicação maior que o diâmetro do implante, esta deve ser fechada previamente à implantação do implante GLIADEL.
A tomografia computadorizada e a ressonância magnética podem mostrar uma intensificação da densidade do tecido cerebral que rodeia a cavidade de ressecção após a colocação dos implantes de GLIADEL. Este aumento de intensidade poderia refletir edema ou inflamação causados pelos implantes de GLIADEL, ou progressão do tumor.
As mulheres em idade fértil devem utilizar métodos anticonceptivos eficazes durante pelo menos 6 meses após receber o implante GLIADEL.
Deve-se aconselhar os pacientes do sexo masculino com parceiras em idade fértil que utilizem métodos anticonceptivos eficazes durante pelo menos 90 dias após receber o implante GLIADEL
4.5Interação com outros medicamentos e outras formas de interação
As interações do implante GLIADEL com outros fármacos ou quimioterapia não foram estudadas formalmente.
4.6Fertilidade, gravidez e lactação
Gravidez:
Não existem estudos do implante GLIADEL em mulheres grávidas, nem estudos que avaliem a toxicidade do implante GLIADEL sobre a reprodução.
Quando administrado de forma sistêmica, a carmustina, o princípio ativo do implante GLIADEL, pode ter efeitos genotóxicos e afetar de forma negativa o desenvolvimento fetal (ver seção 5.3). Portanto, não se recomenda utilizar o implante GLIADEL durante a gravidez, nem em mulheres em idade fértil que não estejam utilizando métodos anticonceptivos. As mulheres em idade fértil devem utilizar métodos anticonceptivos eficazes durante pelo menos 6 meses após receber o implante GLIADEL.
Deve-se aconselhar os pacientes do sexo masculino com parceiras em idade fértil que utilizem métodos anticonceptivos eficazes durante pelo menos 90 dias após receber o implante GLIADEL. No entanto, se ainda assim se considera necessário o uso do implante GLIADEL durante a gravidez, deve-se informar a paciente dos potenciais riscos para o feto. No caso de a paciente ficar grávida após receber o implante GLIADEL, deve-se buscar aconselhamento genético.
Lactação:
Desconhece-se se os componentes do implante GLIADEL se excretam pelo leite materno. Dado que alguns fármacos se eliminam pelo leite materno e devido ao possível risco de reações adversas graves da carmustina em lactentes, está contraindicada a lactação.
Fertilidade:
Não se realizaram estudos de fertilidade com o implante GLIADEL.
4.7Efeitos sobre a capacidade para conduzir e utilizar máquinas
O implante GLIADEL não influencia na capacidade para conduzir veículos e utilizar maquinaria. No entanto, a craniotomia e o implante GLIADEL podem provocar alterações da visão e do sistema nervoso. Portanto, o paciente deve conhecer o efeito potencial dessas reações sobre a capacidade para conduzir ou utilizar máquinas.
4.8Reações adversas
O espectro de reações adversas observadas em pacientes com glioma maligno de alto grau de novo diagnóstico e gliomas malignos recidivantes foi consistente com o observado em pacientes submetidos à craneotomia por gliomas malignos.
Abaixo se enumeram as reações adversas muito frequentes (≥ 1/10), frequentes (≥1/100 a <1>
As reações adversas se enumeram em ordem decrescente de gravidade dentro de cada frequência.
Cirurgia Primária
Os seguintes dados correspondem às reações adversas mais frequentes observadas em 5% ou mais dos 120 pacientes com glioma maligno de novo diagnóstico tratados com o implante GLIADEL no ensaio clínico.
Reações adversas frequentes observadas em ≥ 5% dos pacientes tratados com o implante GLIADEL na cirurgia inicial
Classificação por órgãos e sistemas | Reações adversas | |
Trastornos endócrinos | frequentes* | Diabetes mellitus |
Trastornos psiquiátricos | muito frequentes | Depressão |
frequentes | Trastorno da personalidade, ansiedade, pensamento anormal, alucinações, insônia | |
Trastornos do sistema nervoso | muito frequentes | Hemiplegia, convulsões, confusão, edema cerebral, afasia, sonolência, alterações do habla |
frequentes | Amnésia, aumento da pressão intracraniana, trastornos da personalidade, ansiedade, paralisia facial, neuropatia, ataxia, hipoestesia, parestesia, pensamento anormal, deambulação anormal, mareio, convulsões tipo “grand mal”, alucinações, insônia, tremores | |
Trastornos oculares | frequentes | Edema conjuntival, visão anormal, alterações do campo visual |
Trastornos vasculares | muito frequentes | Tromboflebite |
frequentes | Hemorragia | |
Trastornos respiratórios, torácicos e mediastínicos | frequentes | Embolia pulmonar |
Infeções e infestações Trastornos gastrointestinais | frequentes | Pneumonia |
muito frequentes | Náuseas, vômitos, constipação | |
Trastornos da pele e do tecido subcutâneo | frequentes | Diarréia |
Trastornos da pele e do tecido subcutâneo | muito frequentes | Erupção cutânea, alopecia |
Trastornos renais e urinários | frequentes | Infecção do trato urinário, incontinência urinária |
Trastornos gerais e alterações no local de administração | muito frequentes | Piora, cefaleia, astenia, infecção, febre, dor, cicatrização anormal |
frequentes | Dor abdominal, dor de costas, edema facial, dor torácica, abscesso, lesão acidental, edema periférico |
Foi notificada hipertensão intracraniana mais frequentemente nos pacientes tratados com o implante GLIADEL do que nos que receberam placebo (9,2% versus 1,7%), sendo um achado tardio coincidente com a recidiva do tumor, e se considerou pouco provável sua associação com o uso do implante GLIADEL (ver seção 4.4).
As perdas de LCR foram mais frequentes em pacientes tratados com o implante GLIADEL do que em pacientes que receberam placebo. No entanto, não aumentaram as infecções intracranianas nem outras anomalias de cicatrização (ver seção 4.4).
Cirurgia em doença recidivante
Foram observadas as seguintes reações adversas após a operação em 4% ou mais dos pacientes tratados com o implante GLIADEL na cirurgia repetida. São listadas apenas as reações que foram mais frequentes no grupo que recebeu o implante GLIADEL do que no grupo placebo, com a exceção dos efeitos sobre o sistema nervoso, dos quais os implantes placebo poderiam ser a causa. Essas reações adversas, ou não estavam presentes antes da operação, ou pioraram após a operação durante o período de seguimento. O período de seguimento foi de até 71 meses.
Reações adversas frequentes observadas em ≥ 4% dos pacientes tratados com o implante GLIADEL na cirurgia repetida
Classificação por órgãos e sistemas | Reações adversas | |
Trastornos do sangue e do sistema linfático | frequentes | Anemia |
Trastornos do metabolismo e da nutrição | frequentes | Hiponatremia |
Trastornos do sistema nervoso | muito frequentes | Convulsão, hemiplegia, cefaleia, sonolência, confusão |
frequentes | Afasia, estupor, edema cerebral, aumento da pressão intracraniana, meningite ou abscesso | |
Trastornos vasculares | frequentes | Tromboflebite |
Trastornos respiratórios, torácicos e mediastínicos | frequentes | Embolia pulmonar |
Trastornos gastrointestinais | frequentes | Náuseas, vômitos |
Trastornos da pele e do tecido subcutâneo | frequentes | Erupção cutânea |
Trastornos renais e urinários | muito frequentes | Infecção do trato urinário |
Trastornos gerais e alterações no local de administração | muito frequentes | Cicatrização anormal |
frequentes | Infecção, dor |
Os seguintes efeitos adversos, que não estão incluídos na tabela a seguir, foram notificados em pacientes tratados com o implante GLIADEL em todos os estudos. Os efeitos enumerados ou não estavam presentes durante o período pré-cirúrgico, ou pioraram após a cirurgia durante o período de seguimento. Não foi possível estabelecer se o implante GLIADEL foi a causa desses efeitos
Efeitos adversos em pacientes que recebem implante de GLIADEL
Classificação por órgãos e sistemas | Reações adversas | |
Trastornos do sangue e do sistema linfático | frequentes | Trombocitopenia, leucocitose |
Trastornos do metabolismo e da nutrição | frequentes | Hiponatremia, hiperglicemia, hipopotassêmia |
Trastornos do sistema nervoso | frequentes | Hidrocefalia, ataxia, mareio, hemiplegia, coma, amnésia, diplopia, |
pouco frequentes | Hemorragia cerebral, infarto cerebral | |
Trastornos psiquiátricos | frequentes | Depressão, pensamento anormal, insônia, reação paranoide |
Trastornos oculares | frequentes | Alteração visual, dor ocular |
Trastornos cardíacos e vasculares | frequentes | Hipertensão, hipotensão |
Trastornos respiratórios, torácicos e mediastínicos | frequentes | Infecção, pneumonia por aspiração |
Trastornos gastrointestinais | frequentes | Diarréia, constipação, disfagia, hemorragia gastrointestinal, incontinência fecal |
Trastornos da pele e do tecido subcutâneo | frequentes | Erupção cutânea |
Trastornos musculoesqueléticos e do tecido conjuntivo | frequentes | Infecção |
Trastornos renais e urinários | frequentes | Incontinência urinária |
Trastornos gerais e alterações no local de administração | frequentes | Edema periférico, dor de pescoço, lesão acidental, dor de costas, reação alérgica, astenia, dor torácica, sepsis |
Lesões traumáticas, intoxicações e complicações de procedimentos terapêuticos | Pouco frequentes | Neumocefalia |
Foram notificados casos de acúmulo de ar na zona do implante com Gliadel, em ocasões associados com sintomas neurológicos (hemiplegia, afasia, convulsões).
As seguintes quatro categorias de reações adversas estão possivelmente relacionadas com o tratamento com o implante GLIADEL.
Convulsões:
No ensaio clínico de cirurgia inicial, a incidência de convulsões nos cinco primeiros dias após a implantação foi de 2,5% no grupo implante GLIADEL.
No ensaio clínico de cirurgia em doença recidivante, a incidência de convulsões após a operação foi 19% em pacientes tratados com o implante GLIADEL. Nesse ensaio, 12/22 (54%) dos pacientes tratados com o implante GLIADEL experimentaram o início das convulsões ou o pioramento das existentes durante os cinco primeiros dias após a operação. A mediana do tempo até o início das convulsões ou o pioramento das existentes após a operação foi 3,5 dias nos pacientes tratados com o implante GLIADEL.
Edema cerebral:
O desenvolvimento de um edema cerebral com efeito de massa (devido à recidiva do tumor, infecção intracraniana ou necrose) pode obrigar a uma reintervenção e, em alguns casos, à retirada do implante GLIADEL ou seus restos (ver seção 4.4).
Anomalias na cicatrização:
Foram registradas as seguintes anomalias na cicatrização em ensaios clínicos do implante GLIADEL: deiscência da ferida, retardamento na cicatrização da ferida, efusões subdurais, subgaleais ou através da sutura, e perdas de líquido cefalorraquídeo.
No ensaio realizado em cirurgia inicial, as perdas de líquido cefalorraquídeo ocorreram em 5% das pessoas que receberam o implante GLIADEL. Durante a cirurgia, deve-se assegurar um fechamento impermeável da duramadre para minimizar o risco de perda de líquido cefalorraquídeo (ver seção 4.4).
Infe
Complicações intracranianas:
No ensaio clínico em cirurgia inicial, a incidência de abscesso cerebral ou meningite foi de 5% em pacientes tratados com GLIADEL implante.
Na cirurgia da doença recidivante, a incidência de abscesso cerebral ou meningite foi de 4% em pacientes tratados com GLIADEL implante.
Em um ensaio clínico publicado, foi relatada a formação de cistos após o tratamento com GLIADEL implante. Esta reação ocorreu em 10% dos pacientes observados no ensaio. No entanto, a formação de cistos é possível após a ressecção de um glioma maligno.
Notificação de suspeita de reações adversas
É importante notificar as suspeitas de reações adversas ao medicamento após a sua autorização. Isso permite uma supervisão contínua da relação benefício/risco do medicamento. Convida-se os profissionais de saúde a notificar as suspeitas de reações adversas através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: https://www.notificaram.es.
4.9Sobredosagem
Não se aplica.
- PROPRIEDADES FARMACOLÓGICAS
5.1Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Agentes antineoplásicos, agentes alquilantes, nitrosoureias, código ATC: L01AD01
Dados pré-clínicos
GLIADEL implante libera carmustina diretamente na cavidade cirúrgica criada após a ressecção tumoral. Ao serem expostos ao meio aquoso da cavidade, os links anidrido do copolímero são hidrolisados, liberando carmustina, carboxifenoxipropano e ácido sebácico. A carmustina liberada de GLIADEL implante difunde ao tecido cerebral circundante e exerce um efeito antineoplásico mediante a alquilação do ADN e ARN.
A carmustina se degrada e metaboliza de forma espontânea, criando o grupo alquilante, presumivelmente um íon carbono cloroetilo, que conduz à formação irreversível de ligações cruzadas (cross-linking) no ADN.
A atividade antitumoral de GLIADEL implante depende da liberação de carmustina na cavidade tumoral em quantidades suficientes para uma citotoxicidade eficaz.
Em 3 semanas, se degrada mais de 70% do copolímero. Os monômeros têm metabolismo e eliminação diferentes. O carboxifenoxipropano é eliminado majoritariamente pelos rins, e o ácido sebácico, um ácido graxo endógeno, é metabolizado pelo fígado e expirado em forma de CO2 em animais.
Eficácia clínica e segurança
Cirurgia inicial
Em um ensaio clínico aleatorizado, duplo-cego, controlado com placebo, em 240 adultos com glioma maligno de alto grau de novo diagnóstico submetidos a craneotomia inicial para ressecção do tumor, a mediana de sobrevivência aumentou de 11,6 meses com placebo para 13,9 meses com GLIADEL implante (p = 0,079, log-rank testnão estratificado) na fase inicial de seguimento do ensaio. O tipo de tumor mais comum foi o glioblastoma multiforme (GBM) (n=207), seguido de oligoastrocitoma anaplásico (n=11), oligodendroglioma (n=11), e astrocitoma anaplásico (n=2). O índice de riscos (hazard ratio) para GLIADEL implante foi de 0,77 (95% IC: 0,57 – 1,03). Na fase de seguimento a longo prazo, os pacientes que ainda seguiam vivos no final da fase inicial de seguimento foram seguidos até três anos como mínimo ou até a morte. A mediana de sobrevivência aumentou de 11,6 meses com placebo para 13,9 meses com GLIADEL implante (p < 0,05, log-rank test). O índice de riscos (hazard ratio) do tratamento com GLIADEL implante foi de 0,73 (95% IC: 0,56 – 0,95).
Cirurgia em doença recidivante
Em um ensaio clínico aleatorizado, duplo-cego, controlado com placebo, em 145 adultos com glioblastoma (GBM) recidivante, GLIADEL implante prolongou a sobrevivência desses pacientes. O 95% dos pacientes tratados com GLIADEL implante recebeu de 7 a 8 implantes.
A taxa de sobrevivência com placebo aos 6 meses foi de 36% (26/73), frente a um 56% (40/72) com o tratamento com GLIADEL implante. A mediana de sobrevivência dos pacientes com GBM foi de 20 semanas com placebo, frente a 28 semanas com o tratamento de GLIADEL implante.
5.2Propriedades farmacocinéticas
Não se conhece a absorção, distribuição, metabolismo nem eliminação do copolímero em humanos. As concentrações de carmustina liberadas por GLIADEL implante no tecido cerebral humano não foram determinadas. Não é possível determinar os níveis plasmáticos de carmustina após a implantação de GLIADEL implante. A carmustina não é detectada em sangue ou líquido cefalorraquídeo, em coelhos com implantes de carmustina a 3,85%.
Após uma perfusão intravenosa de carmustina com doses entre 30 e 170 mg/m2, a média da semivida de eliminação terminal, do aclaramento e do volume de distribuição em estado estacionário são, respectivamente, 22 minutos, 56 ml/min/kg e 3,25 l/kg. Aproximadamente, 60% de uma dose intravenosa de 200 mg/m2 de 14C-carmustina é excretada por urina em 96 horas e 6% é expirada em forma de CO2.
Os implantes de GLIADEL são biodegradáveis no cérebro humano quando são colocados na cavidade após a ressecção do tumor. A velocidade de biodegradação varia entre paciente e paciente. Durante o processo de biodegradação, podem ser observados restos de implantes mediante técnicas de imagem cerebral ou na seguinte operação, mesmo que tenha ocorrido uma ampla degradação de todos os componentes.
5.3Dados pré-clínicos sobre segurança
Não foram realizados estudos de carcinogenicidade, mutagenicidade, toxicidade embrio-fetal, toxicidade pré- e pós-natal, e alteração da fertilidade com GLIADEL implante.
A carmustina, o princípio ativo dos implantes de GLIADEL, quando administrada sistemicamente, tem efeitos embriotóxicos, teratogênicos, genotóxicos e carcinogênicos e pode causar degeneração testicular em vários modelos animais.
- DADOS FARMACÊUTICOS
6.1Lista de excipientes
Polifeprosan 20
6.2Incompatibilidades
Não se aplica.
6.3Período de validade
4 anos.
6.4Precauções especiais de conservação
Conservar em congelador. Não conservar a temperatura superior a -20º C.
Os sobres exteriores sem abrir podem ser mantidos a uma temperatura menor de 22º C durante um máximo de 6 horas.
O medicamento pode ser recongelado uma única vez se os sobres não foram abertos e permaneceram por um máximo de 6 horas a uma temperatura menor de 22º C. Após a recongelção, o medicamento deve ser usado em 30 dias.
6.5Natureza e conteúdo doenvase
GLIADEL implante está disponível em uma caixa que contém 8 implantes. Cada implante está acondicionado de forma individual em 2 sobres de alumínio laminado.
6.6Precauções especiais de eliminaçãoe outras manipulações
Os implantes devem ser manipulados por pessoal provido de luvas quirúrgicas, pois a exposição à carmustina pode ocasionar queimaduras graves e hiperpigmentação da pele. Recomenda-se o uso de luvas duplas e, após o uso, as luvas externas devem ser descartadas em um contêiner de produtos biopeligrosos. Durante a colocação dos implantes, deve-se empregar um instrumento quirúrgico reservado à manipulação dos implantes. Se estiver indicada a repetição da intervenção neurocirúrgica, qualquer implante ou resto de implante deve ser manipulado como um possível agente citotóxico. A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local para agentes citotóxicos.
Os implantes de GLIADEL devem ser manipulados com precaução. Os sobres que contêm os implantes de GLIADEL devem ser entregues na sala de operações e devem permanecer fechados até o momento da colocação dos implantes na cavidade de ressecção. Únicamente a superfície externa do sobre exterior não é estéril. Em qualquer caso, se um implante for deixado cair acidentalmente, deve ser descartado adequadamente.
Instruções para abrir os sobres que contêm o implante:
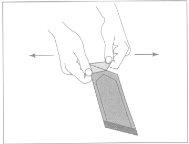
Figura1:Para abrir o sobre exterior,
localizar a esquina dobrada e puxar suavemente para fora.
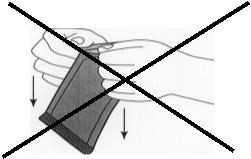
Figura 2:Não puxar para baixo girando os nós
no sobre. Isso poderia exercer pressão sobre o implante
e quebrá-lo.
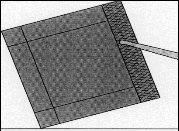
Figura 3:Retirar o sobre interior com a ajuda
de pinças e puxando para cima.
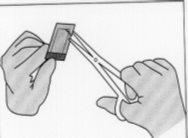
Figura 4:Para abrir o sobre interior, segurar suavemente
e cortar circularmente ao redor do implante.
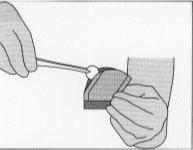
Figura 5:Para retirar o implante, pegar suavemente
com a ajuda de pinças e colocar na cavidade de ressecção.
Em qualquer caso, se um implante for deixado cair, deve ser descartado adequadamente.
Uma vez que se realizou a ressecção do tumor, que o diagnóstico do tumor foi confirmado por anatomia patológica e se conseguiu a hemostasia, podem ser colocados até 8 implantes para cobrir o máximo possível a cavidade de ressecção. É considerado aceitável uma ligeira superposição entre os implantes. Podem ser utilizados implantes seccionados pela metade, mas se estiverem fragmentados em mais de duas partes, devem ser eliminados em contêineres de resíduos biopeligrosos.
Podem ser colocadas tiras de curativo de oxicelulosa sobre os implantes para fixá-los à superfície da cavidade. Após a colocação dos implantes, a cavidade de ressecção deve ser irrigada e a dura-máter deve ser fechada de forma impermeável.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local para resíduos biopeligrosos.
- TITULAR DA AUTORIZAÇÃO DE COMERCIALIZAÇÃO
CLINIGEN HEALTHCARE B.V.
Schiphol Boulevard 359
WTC Schiphol Airport, D Tower 11th floor
1118BJ Schiphol
Países Baixos
- NÚMERO(S) DE AUTORIZAÇÃO DE COMERCIALIZAÇÃO
Reg. A.E.M.P.S. n° 62.745
- DATA DA PRIMEIRA AUTORIZAÇÃO/RENOVAÇÃO DA AUTORIZAÇÃO
Data da primeira autorização: 19/10/1999
Data da última renovação: 10/12/2008
- DATA DA REVISÃO DO TEXTO
Abril 2021
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a GLIADEL 7,7 mg IMPLANTEForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mgSubstância ativa: carmustineFabricante: Zentiva K.S.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 100 mgSubstância ativa: carmustineFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 300 mgSubstância ativa: carmustineFabricante: Accord Healthcare S.L.U.Requer receita médica
Alternativas a GLIADEL 7,7 mg IMPLANTE noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a GLIADEL 7,7 mg IMPLANTE em Polónia
Alternativa a GLIADEL 7,7 mg IMPLANTE em Ukraine
Médicos online para GLIADEL 7,7 mg IMPLANTE
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de GLIADEL 7,7 mg IMPLANTE – sujeita a avaliação médica e regras locais.






