
Brinzolamide Genoptim
Pergunte a um médico sobre a prescrição de Brinzolamide Genoptim

Como usar Brinzolamide Genoptim
Folheto informativo para o doente
Brinzolamide Genoptim, 10 mg/mL, gotas para os olhos, suspensão
Brinzolamida
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Brinzolamide Genoptim e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Brinzolamide Genoptim
- 3. Como tomar o medicamento Brinzolamide Genoptim
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Brinzolamide Genoptim
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Brinzolamide Genoptim e para que é utilizado
O Brinzolamide Genoptim contém brinzolamida, que pertence a um grupo de medicamentos chamados inibidores da anidrase carbónica. O medicamento diminui a pressão no olho. O medicamento Brinzolamide Genoptim é utilizado no tratamento da pressão elevada no olho. A pressão elevada pode levar à formação de uma doença chamada glaucoma. Se a pressão no olho for demasiado elevada, pode danificar a visão.
2. Informações importantes antes de tomar o medicamento Brinzolamide Genoptim
Quando não tomar o medicamento Brinzolamide Genoptim:
- se o doente tiver doença renal grave;
- se o doente for alérgico à brinzolamida ou a qualquer outro componente deste medicamento (listados no ponto 6);
- se o doente for alérgico a medicamentos chamados sulfonamidas. Exemplos de sulfonamidas são medicamentos utilizados no tratamento da diabetes e infecções, bem como diuréticos. O Brinzolamide Genoptim pode causar a mesma alergia;
- se o doente tiver acidose metabólica (estado chamado acidose hiperclorémica).
Em caso de dúvidas, deve consultar um médico.
Precauções e advertências
Antes de começar a tomar o medicamento Brinzolamide Genoptim, deve discutir com o médico ou farmacêutico:
- se o doente tiver distúrbios renais ou hepáticos,
- se o doente tiver olhos secos ou doenças da córnea,
- se o doente estiver a tomar outros medicamentos do grupo das sulfonamidas.
- se o doente tiver um tipo de glaucoma, no qual a pressão dentro do olho aumenta devido ao bloqueio do fluxo de líquido por depósitos (glaucoma pseudoexfoliativo e pigmentar)
ou um tipo de glaucoma, no qual a pressão dentro do olho aumenta (por vezes rapidamente), porque o olho se deformou para a frente, bloqueando assim o fluxo de líquido (glaucoma de ângulo estreito),
- se o doente já teve uma erupção cutânea grave ou descamação da pele, formação de bolhas e (ou) úlceras na boca após a administração de brinzolamida ou outros medicamentos relacionados.
Deve ter cuidado ao tomar brinzolamida: Em relação ao tratamento com brinzolamida, foram relatados casos de reações cutâneas graves, incluindo síndrome de Stevens-Johnson e necrólise tóxica epidermal. Deve interromper a administração de brinzolamida e procurar imediatamente ajuda médica se ocorrerem quaisquer sintomas relacionados com essas reações cutâneas graves descritas no ponto 4.
Crianças e jovens
O medicamento Brinzolamide Genoptim não deve ser utilizado em lactentes, crianças e jovens abaixo de 18 anos, a menos que seja recomendado por um médico.
Brinzolamide Genoptim e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar. Se o doente estiver a tomar outro inibidor da anidrase carbónica (acetazolamida ou dorzolamida, ver ponto 1. O que é o medicamento Brinzolamide Genoptim e para que é utilizado), deve informar o médico.
Gravidez e amamentação
Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar um médico ou farmacêutico antes de tomar este medicamento. As mulheres que possam engravidar são aconselhadas a usar um método eficaz de contracepção durante o tratamento com o medicamento Brinzolamide Genoptim. Não se recomenda a administração do medicamento Brinzolamide Genoptim durante a gravidez ou amamentação. Não se deve administrar o medicamento Brinzolamide Genoptim, a menos que seja explicitamente recomendado por um médico. Antes de tomar qualquer medicamento, deve consultar um médico ou farmacêutico.
Condução de veículos e utilização de máquinas
Não deve conduzir veículos ou operar máquinas até que a visão volte ao normal. Durante algum tempo após a administração do medicamento Brinzolamide Genoptim, a visão pode estar turva. O Brinzolamide Genoptim pode diminuir a capacidade de realizar tarefas que exigem atenção aumentada e (ou) coordenação motora. Deve ter cuidado ao conduzir veículos ou operar equipamentos mecânicos.
Brinzolamide Genoptim contém cloreto de benzalcônio
O medicamento contém aproximadamente 3,1 μg de cloreto de benzalcônio em cada gota (= 1 dose) o que corresponde a 0,1 mg/mL. O cloreto de benzalcônio pode ser absorvido por lentes de contato macias e alterar a sua cor. Deve remover as lentes de contato antes de administrar a gota e esperar pelo menos 15 minutos antes de voltar a colocá-las. O cloreto de benzalcônio também pode causar irritação nos olhos, especialmente em pessoas com síndrome do olho seco ou distúrbios da córnea (camada transparente da frente do olho). Em caso de sensações anormais nos olhos, picadas ou dor nos olhos após a administração do medicamento, deve contactar um médico.
3. Como tomar o medicamento Brinzolamide Genoptim
Este medicamento deve ser sempre utilizado de acordo com as recomendações do médico ou farmacêutico. Em caso de dúvidas, deve consultar um médico ou farmacêutico. O medicamento Brinzolamide Genoptim deve ser administrado apenas nos olhos. Não deve ser ingerido ou injetado. A dose recomendada é de uma gota no olho doente (olhos) duas vezes por dia - de manhã e à noite. Deve tomar a dose prescrita, a menos que o médico recomende outra coisa. O medicamento Brinzolamide Genoptim, 10 mg/ml, gotas para os olhos, suspensão pode ser utilizado em ambos os olhos apenas se o médico o recomendar. O medicamento deve ser utilizado durante o tempo que o médico recomendar.
Modo de administração:
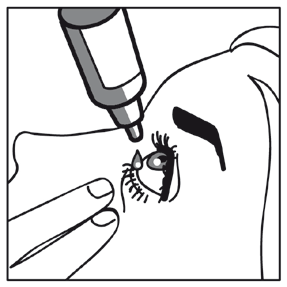

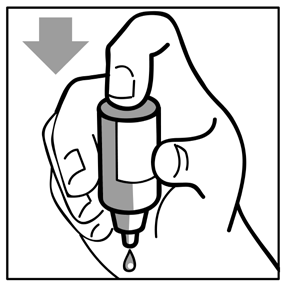
1 2 3
- Preparar a garrafa com o medicamento Brinzolamide Genoptim e um espelho.
- Lavar as mãos.
- Agitar a garrafa e remover a tampa. Se, após remover a tampa, o anel de garantia estiver solto, deve removê-lo antes de administrar o medicamento.
- Inverter a garrafa, segurando-a entre o polegar e o dedo médio.
- Inclinar a cabeça para trás. Com o dedo limpo, afastar a pálpebra para baixo, de modo a criar uma "bolsa" entre a bola do olho e a pálpebra. É aqui que a gota deve cair (figura 1).
- Aproximar a ponta da garrafa do olho. Para facilitar, pode usar um espelho.
- Não tocar na ponta da garrafa nos olhos, pálpebras, áreas ao redor dos olhos ou outras superfícies. Isso pode causar infecção da gota.
- Pressionar suavemente a base da garrafa para liberar uma gota.
- Não apertar a garrafa: ela é projetada para que um toque suave na base seja suficiente. (figura 2).
- Após a administração do medicamento Brinzolamide Genoptim, pressionar o canto do olho ao lado do nariz (figura 3) durante pelo menos 1 minuto. Isso ajudará a prevenir a absorção do medicamento Brinzolamide Genoptim pelo organismo.
- Em caso de administração de gotas para os dois olhos, as etapas acima devem ser repetidas para o segundo olho.
- Fechar a garrafa cuidadosamente imediatamente após o uso.
- Não abrir uma nova garrafa até que o conteúdo da garrafa anterior tenha sido completamente utilizado.
Se a gota não atingir o olho, deve tentar novamente. Em caso de administração de outras gotas para os olhos, deve manter um intervalo de pelo menos 5 minutos entre a administração do medicamento Brinzolamide Genoptim, 10 mg/ml, gotas para os olhos, suspensão, e a administração de outras gotas. As pomadas para os olhos devem ser administradas por último.
Administração de uma dose maior do que a recomendada do medicamento Brinzolamide Genoptim
Em caso de administração de uma quantidade excessiva do medicamento, deve enxaguar bem o olho com água morna. Não deve administrar a gota novamente até o momento da próxima dose.
Omissão da administração do medicamento Brinzolamide Genoptim
Em caso de omissão de uma dose do medicamento, deve administrar uma gota assim que lembrar e, em seguida, retornar ao esquema de doses normal. Não deve administrar uma dose dupla para compensar a dose omitida.
Interrupção da administração do medicamento Brinzolamide Genoptim
Em caso de interrupção da administração do medicamento Brinzolamide Genoptim sem acordo com o médico, a pressão dentro do olho deixará de ser controlada, o que pode levar à perda da visão. Em caso de dúvidas adicionais sobre a administração deste medicamento, deve consultar um médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos. Durante a administração de brinzolamida, foram observados os seguintes efeitos não desejados. Deve interromper a administração de brinzolamida e procurar imediatamente ajuda médica se ocorrerem quaisquer dos seguintes sintomas:
- manchas vermelhas, planas e redondas ou semelhantes a um alvo, que ocorrem no tronco, frequentemente com bolhas no centro, descamação da pele, úlceras na boca, garganta, nariz, genitálias e olhos. Essas erupções cutâneas graves podem ser precedidas por febre e sintomas semelhantes aos da gripe (síndrome de Stevens-Johnson, necrólise tóxica epidermal).
Efeitos não desejados frequentes (podem ocorrer em até 1 em cada 10 pessoas)
Sintomas relacionados aos olhos:
visão turva, irritação nos olhos, dor nos olhos, secreção nos olhos, coceira nos olhos, olhos secos, sensações anormais nos olhos, vermelhidão nos olhos.
Sintomas gerais:
sabor desagradável. Efeitos não desejados não muito frequentes (podem ocorrer em até 1 em cada 100 pessoas)
Sintomas relacionados aos olhos:
sensibilidade à luz, inflamação ou conjuntivite, inchaço nos olhos, coceira nas pálpebras, vermelhidão ou inchaço, depósitos nos olhos, efeito de luz cegante, sensação de queimadura, crescimento na superfície do olho, aumento da pigmentação nos olhos, fadiga nos olhos, formação de crostas nas pálpebras, aumento da produção de lágrimas.
Sintomas gerais:
batimento cardíaco lento ou fraco, batimento cardíaco forte que pode ser rápido ou irregular, ritmo cardíaco lento, dificuldade para respirar, falta de ar, tosse, diminuição do número de glóbulos vermelhos no sangue, aumento da concentração de cloreto no sangue, tontura, problemas de memória, depressão, nervosismo, diminuição do envolvimento emocional, pesadelos, fraqueza geral, fadiga, sensação de mal-estar, dor, problemas para se mover, diminuição da libido, disfunção sexual nos homens, sintomas de resfriado, congestão nasal, inflamação da garganta, dor de garganta, sensação anormal na boca, inflamação da mucosa do esôfago, dor abdominal, náuseas, vômitos, dispepsia, diarreia, flatulência, distúrbios digestivos, dor nos rins, dor muscular, cãibras musculares, dor nas costas, sangramento nasal, coriza, congestão nasal, espirros, erupções cutâneas, sensações anormais na pele, coceira, erupção cutânea lisa ou vermelha e elevada, tensão na pele, dor de cabeça, secura na boca, depósitos nos olhos.
Efeitos não desejados raros (podem ocorrer em até 1 em cada 1000 pessoas)
Sintomas relacionados aos olhos:
edema da córnea, visão dupla ou limitada, visão anormal, flashes de luz no campo de visão, sensação de olho seco, inchaço ao redor do olho, aumento da pressão nos olhos, dano ao nervo óptico.
Sintomas gerais:
distúrbios de memória, sonolência, dor no peito, congestão nasal, sinusite, sinusite, secura nasal, zumbido nos ouvidos, perda de cabelo, coceira generalizada, sensação de tremor, irritabilidade, ritmo cardíaco irregular, fraqueza, dificuldade para dormir, respiração ofegante.
Frequência desconhecida (não pode ser estimada a partir dos dados disponíveis)
Sintomas relacionados aos olhos:
anormalidades nas pálpebras, distúrbios da visão, doença da córnea, alergia nos olhos, crescimento reduzido ou número de cílios, vermelhidão nas pálpebras.
Sintomas gerais:
reações alérgicas exacerbadas, sensação reduzida, tremores, perda de paladar, pressão arterial reduzida, pressão arterial aumentada, frequência cardíaca aumentada, dor articular, asma, dor nas extremidades, vermelhidão ou inflamação da pele, coceira, resultados anormais de testes de função hepática, edema nas extremidades, micção frequente, perda de apetite, mal-estar, manchas vermelhas, planas e redondas ou semelhantes a um alvo, que ocorrem no tronco, frequentemente com bolhas no centro, descamação da pele, úlceras na boca, garganta, nariz, genitálias e olhos, que podem ser precedidas por febre e sintomas semelhantes aos da gripe. Essas erupções cutâneas graves podem ser fatais (síndrome de Stevens-Johnson, necrólise tóxica epidermal).
Notificação de efeitos não desejados
Se ocorrerem quaisquer efeitos não desejados, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou farmacêutico, ou enfermeira. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas: Al. Jerozolimskie 181C, 02-222 Varsóvia, telefone: +48 22 49 21 301, fax: +48 22 49 21 309, site: https://smz.ezdrowie.gov.pl. Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização. A notificação de efeitos não desejados pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Brinzolamide Genoptim
O medicamento deve ser conservado em um local seguro e inacessível às crianças. Não deve tomar este medicamento após a data de validade impressa na garrafa e na caixa após "EXP". A data de validade é o último dia do mês indicado. Não há recomendações especiais para a conservação do medicamento. A garrafa deve ser descartada após quatro semanas da primeira abertura, para prevenir infecções. A data de abertura de cada garrafa deve ser registrada no local designado abaixo e no rótulo da garrafa e na caixa. Para embalagens que contenham uma garrafa, deve registrar apenas uma data. Data de abertura (1): Data de abertura (2): Data de abertura (3): Data de abertura (4): Data de abertura (5): Data de abertura (6): Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais utilizados. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Brinzolamide Genoptim
- A substância ativa do medicamento é brinzolamida. Cada mililitro da suspensão contém 10 mg de brinzolamida.
- Os outros componentes são: cloreto de benzalcônio, solução, carboximetilcelulose sódica, edetato dissódico, manitol, água para injeção, cloreto de sódio, poloxâmero 407, hidróxido de sódio 5N.
Como é o medicamento Brinzolamide Genoptim e o que a embalagem contém
O Brinzolamide Genoptim é um líquido leitoso (suspensão), vendido em caixas que contêm 1, 3 ou 6 garrafas de plástico com um dispositivo de gotejamento (tipo "droptainer") e uma tampa, contendo 5 mL de suspensão branca homogênea. Os tamanhos de embalagem disponíveis são: caixas de cartão que contêm 1, 3 ou 6 garrafas de 5 mL. Não todos os tamanhos de embalagem podem estar disponíveis no mercado.
Titular da autorização de comercialização
Synoptis Pharma Sp. z o.o. ul. Krakowiaków 65 02-255 Varsóvia
Fabricante
Pharmathen S.A. 6 Dervenakion 153 51, Pallini Attiki Grécia Famar S.A. 63 Agiou Dimitriou Street 174 56 Alimos, Atenas Grécia Balkanpharma-Razgrad AD 68 Aprilsko vastanie Blvd. 7200 Razgrad Bulgária Heumann Pharma GmbH & Co. Generica KG Südwestpark 50 90449 Nuremberga Alemanha Este medicamento é autorizado para comercialização nos países membros da Área Econômica Europeia sob os seguintes nomes: Países Baixos Brinzolamide Pharmathen 10 mg/ml oogdruppels, suspensie Alemanha Brinzolamid Heumann 10 mg/ml Augentropfensuspension Polônia Brinzolamide Genoptim Lituânia Brinzolamide ELVIM 10 mg/ml akių lašai (suspensija) Letônia Brinzolamide ELVIM 10 mg/ml acu pilieni, suspensija Estônia Brinzolamide ELVIM França Brinzolamide BIOGARAN 10 mg/ml, collyre en suspension Itália BRINZAFLUX Reino Unido Brinzolamide 10 mg/ml eye drops, suspension Grécia Optonium República Tcheca Brinzolamid Apotex 10mg/ml oční kapky, suspenze
Data da última atualização do folheto: julho de 2022
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBalkanpharma-Razgrad AD Famar S.A., Plant A Heumann Pharma GmbH & Co. Generica KG Pharmaten S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Brinzolamide GenoptimForma farmacêutica: Gotas, 10 mg/mlSubstância ativa: brinzolamideNão requer receita médicaForma farmacêutica: Gotas, 10 mg/mlSubstância ativa: brinzolamideFabricante: Lusomedicamenta Sociedade Tecnica Farmaceutica, S.A. Zakłady Farmaceutyczne POLPHARMA S.A.Requer receita médicaForma farmacêutica: Comprimidos, 250 mgSubstância ativa: acetazolamide
Alternativas a Brinzolamide Genoptim noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Brinzolamide Genoptim em Ucrania
Alternativa a Brinzolamide Genoptim em España
Médicos online para Brinzolamide Genoptim
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Brinzolamide Genoptim – sujeita a avaliação médica e regras locais.














