

Ovestin

Zapytaj lekarza o receptę na Ovestin

Jak stosować Ovestin
Ulotka dołączona do opakowania: informacja dla pacjenta
Uwaga! Zachowaj ulotkę! Informacja na opakowaniu bezpośrednim w języku obcym.
Ovestin
1 mg/g, krem dopochwowy
Estriolum
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek Ovestin i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Ovestin
- 3. Jak stosować lek Ovestin
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Ovestin
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Ovestin i w jakim celu się go stosuje
Lek Ovestin należy do grupy leków określanych jako hormonalna terapia zastępcza (HTZ) do
stosowania dopochwowego. Lek zawiera żeński hormon płciowy estriol (estrogen). Ovestin stosowany
jest u kobiet po menopauzie, co najmniej 12 miesięcy po ustaniu naturalnych miesiączek.
Lek Ovestin jest stosowany w celu łagodzenia objawów menopauzy występujących w pochwie, takich
jak suchość lub podrażnienie. W terminologii medycznej zjawisko to określa się jako „zanikowe
zapalenie pochwy”. Jest ono spowodowane zmniejszeniem stężenia estrogenów w organizmie i
występuje naturalnie po menopauzie.
Jeśli przed menopauzą usunięte zostaną operacyjnie jajniki (zabieg zwany owariektomią),
wytwarzanie estrogenów zmniejsza się bardzo szybko.
Niedobór estrogenów może spowodować suchość i zwiększoną wrażliwość ścian pochwy, co jest
przyczyną bolesnych stosunków płciowych i występowania stanów zapalnych i nasilonego świądu
pochwy. Niedobór estrogenów może także wywołać objawy nietrzymania moczu i nawracające
zapalenie pęcherza moczowego. Objawy te często ustępują po zastosowaniu leków zawierających
estrogeny. Zauważalna poprawa występuje zazwyczaj po kilku dniach lub tygodniach od rozpoczęcia
leczenia.
Lek Ovestin działa poprzez zastępowanie estrogenu, który jest normalnie wytwarzany przez jajniki
kobiety. Lek jest podawany dopochwowo, a więc hormon jest uwalniany tam, gdzie jest potrzebny.
Może to łagodzić uczucie dyskomfortu w pochwie.
Poprawa może być zauważalna dopiero po kilku dniach lub nawet tygodniach.
Poza opisanymi powyżej wskazaniami, lek Ovestin może być także stosowany w celu:
- przyspieszenia gojenia ran pooperacyjnych u kobiet poddanych operacjom pochwowym
- dokładnej oceny wymazu szyjkowego u kobiet w okresie pomenopauzalnym.
2. Informacje ważne przed zastosowaniem leku Ovestin
Wywiad lekarski i regularne badania kontrolne
Stosowanie HTZ wiąże się z ryzykiem, które należy rozważyć podejmując decyzję o rozpoczęciu lub
kontynuacji hormonalnej terapii zastępczej.
Doświadczenie związane z leczeniem kobiet, u których stwierdza się przedwczesną menopauzę (w
wyniku niewydolności jajników lub po zabiegu operacyjnym), jest ograniczone. U kobiet z
przedwczesną menopauzą ryzyko związane ze stosowaniem HTZ może być zróżnicowane. Zawsze
należy zasięgnąć porady lekarza.
Przed rozpoczęciem (lub wznowieniem) stosowania HTZ lekarz przeprowadzi wywiad dotyczący
stanu zdrowia pacjentki oraz chorób występujących w rodzinie. Może też podjąć decyzję o
przeprowadzeniu badania fizykalnego z uwzględnieniem, w razie konieczności, badania piersi i (lub)
badania ginekologicznego przez pochwę.
Po rozpoczęciu stosowania leku Ovestin należy regularnie zgłaszać się na wizyty kontrolne do lekarza
(przynajmniej raz w roku). Podczas kontroli należy omówić z lekarzem korzyści i zagrożenia
związane z kontynuacją stosowania leku Ovestin.
Należy regularnie wykonywać badania piersi zgodnie z zaleceniem lekarza.
Kiedy nie stosować leku Ovestin:
Leku Ovestin nie należy stosować, jeśli którakolwiek z wymienionych niżej sytuacji odnosi się do
pacjentki. W przypadku braku pewności, przed zastosowaniem leku Ovestin należy zasięgnąć porady
lekarza.
Kiedy nie stosować leku Ovestin:
- jeśli pacjentka ma uczuleniena estriol lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6 „Zawartość opakowania i inne informacje”).
- jeśli u pacjentki występuje lub występował w przeszłości rak piersialbo jeśli istnieje podejrzenie raka piersi.
- jeśli u pacjentki występuje nowotwór estrogenozależny, na przykład rak endometrium (błona śluzowej macicy), lub istnieje podejrzenie takiego nowotworu.
- jeśli u pacjentki występuje krwawienie z pochwy o nieznanej przyczynie.
- jeśli u pacjentki występuje nieleczone nadmierne pogrubienie błony śluzowej macicy(hiperplazja endometrium).
- jeśli u pacjentki występują lub występowały kiedykolwiek w przeszłości zakrzepy krwi wnaczyniach krwionośnych(zakrzepica żylna), na przykład w naczyniach krwionośnych kończyn dolnych (zakrzepica żył głębokich) lub w naczyniach płucnych (zatorowość płucna).
- jeśli u pacjentki występują zaburzenia krzepnięcia krwi(takie jak: niedobór białka C, niedobór białka S lub antytrombiny).
- jeśli u pacjentki występują obecnie lub niedawno występowały choroby spowodowane obecnością zakrzepów krwi w naczyniach tętniczych, takie jak: zawał mięśnia sercowego, udar mózgu lubdławica piersiowa.
- jeśli u pacjentki występuje lub występowała kiedykolwiek w przeszłości choroba wątroby, a wyniki badań czynnościowych wątroby nie powróciły do normy.
- jeśli u pacjentki występuje rzadka choroba krwi zwana „porfirią”, która jest dziedziczona przez członków rodziny.
Jeśli którykolwiek z podanych wyżej stanów wystąpi po raz pierwszy podczas stosowania leku
Ovestin, należy natychmiast przerwać jego stosowanie i niezwłocznie skontaktować się z lekarzem.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem leczenia należy poinformować lekarza, jeżeli którykolwiek z poniższych stanów
występuje obecnie lub występował kiedykolwiek wcześniej u pacjentki, ponieważ w trakcie
stosowania leku Ovestin objawy te mogą powrócić lub się nasilić. Jeśli to nastąpi, należy
częściej zgłaszać się na kontrole do lekarza:
- mięśniaki macicy (mięśniak gładkokomórkowy)
- wzrost komórek błony wyścielającej jamę macicy (endometrium) poza macicą (endometrioza) lub występujący w przeszłości nadmierny rozrost błony wyścielającej wnętrze jamy macicy (hiperplazja endometrium)
- zwiększone ryzyko powstania zakrzepów krwi [patrz punkt „Zakrzepy krwi w żyłach (zakrzepica żylna)”]
- zwiększone ryzyko rozwoju nowotworu estrogenozależnego (na przykład rak piersi u matki, siostry lub babki)
- nadciśnienie
- zaburzenia wątroby, takie jak łagodny guz wątroby
- cukrzyca z lub bez zmian naczyniowych
- kamica żółciowa
- migrena lub ciężki ból głowy
- choroba układu immunologicznego obejmująca wiele narządów wewnętrznych (toczeń rumieniowaty układowy - ang. SLE; przewlekła choroba tkanki łącznej ze zmianami skórnymi w obrębie całego ciała)
- padaczka
- astma
- choroba atakująca błonę bębenkową i powodująca upośledzenie słuchu (otoskleroza)
- zatrzymanie płynów w organizmie związane z chorobami serca lub nerek
- dziedziczny i nabyty obrzęk naczynioruchowy.
Należy poinformować lekarza, jeśli pacjentka choruje na zapalenie wątroby typu C i stosuje leczenie,
w skład którego wchodzą leki, takie jak: ombitaswir/parytaprewir/rytonawir i dazabuwir podawane z
rybawiryną lub bez. Jednoczesne przyjmowanie tych leków z niektórymi lekami zawierającymi
estrogeny może powodować podwyższenie wyników badań czynności wątroby (zwiększenie
aktywności enzymu wątrobowego ALT); ryzyko, że zdarzy się to po zastosowaniu leku Ovestin, jest
obecnie nieznane.
Należy powiedzieć lekarzowi, jeśli podczas stosowania leku Ovestin pacjentka zauważy jakiekolwiek
zmiany w swoim stanie.
Należy przerwać stosowanie leku Ovestin i niezwłocznie skontaktować się z lekarzem,jeśli
podczas stosowania HTZ wystąpi którykolwiek z poniższych objawów:
- którykolwiek ze stanów wymienionych w punkcie „Kiedy nie stosować leku Ovestin”
- zażółcenie skóry i twardówek oczu (żółtaczka), które może być objawem choroby wątroby
- opuchnięcie twarzy, języka i (lub) gardła i (lub) trudności w przełykaniu czy pokrzywka, w połączeniu z trudnościami w oddychaniu, które sugerują obrzęk naczynioruchowy.
- znaczne zwiększenie ciśnienia tętniczego krwi (możliwe objawy to: ból głowy, zmęczenie, zawroty głowy)
- bóle głowy o charakterze migrenowym występujące po raz pierwszy
- ciąża
- objawy świadczące o powstaniu zakrzepów krwi, takie jak:
- bolesny obrzęk i zaczerwienienie nóg
- nagły ból w klatce piersiowej
- trudności z oddychaniem. Więcej informacji podano w punkcie „Zakrzepy krwi w żyłach (zakrzepica żylna)”.
Uwaga:Lek Ovestin nie jest środkiem antykoncepcyjnym. Jeśli od ostatniej miesiączki minęło mniej
niż 12 miesięcy lub pacjentka ma mniej niż 50 lat, może być konieczne zastosowanie dodatkowej
metody zapobiegania ciąży. Należy skonsultować się z lekarzem.
HTZ a nowotwory
Nadmierne pogrubienie błony śluzowej macicy (hiperplazja endometrium) i rak błony śluzowej macicy (rak endometrium)
Stosowanie wyłącznie estrogenowej HTZ w postaci tabletek przez długi czas może zwiększać ryzyko
rozwoju raka błony śluzowej macicy (endometrium).
Nie ma pewności, czy podobne ryzyko istnieje w przypadku powtarzanego lub długotrwałego
(dłuższego niż jeden rok) stosowania leku Ovestin. Jednakże wykazano, że lek Ovestin w bardzo
małym stopniu wchłania się do krwi i dlatego dodawanie progestagenu nie jest konieczne.
Krwawienie lub plamienie nie jest zwykle powodem do niepokoju, ale należy skonsultować się z
lekarzem. Może to być objaw pogrubienia endometrium.
Aby zapobiec stymulacji endometrium, nie należy przekraczać maksymalnej dawki ani przyjmować
jej dłużej niż kilka tygodni (maksymalnie 4 tygodnie).
Opisane poniżej zagrożenia dotyczą leków stosowanych w hormonalnej terapii zastępczej (HTZ),
które dostają się do krwi. Natomiast lek Ovestin jest stosowany miejscowo w pochwie i wchłania się
do krwi w bardzo małych ilościach. Jest mniej prawdopodobne, że wymienione poniżej stany nasilą
się lub wystąpią ponownie podczas stosowania leku Ovestin, jednak w przypadku jakichkolwiek
wątpliwości należy skonsultować się z lekarzem.
Rak piersi
Dane wskazują, że stosowanie leku Ovestin nie zwiększa ryzyka wystąpienia raka piersi u kobiet,
które nigdy wcześniej na niego nie chorowały. Nie wiadomo, czy lek Ovestin może być bezpiecznie
stosowany u kobiet, które chorowały na raka piersi.
Należy regularnie badać piersi i zgłosić się do lekarza w przypadku zauważenia jakichkolwiek zmian, takich jak:
- zapadanie się skóry
- zmiany brodawek sutka
- jakiekolwiek widoczne lub wyczuwalne guzki.
Dodatkowo, zaleca się wykonywać przesiewowe badania mammograficzne, zgodnie z zaleceniami
lekarza.
Rak jajnika
Rak jajnika występuje rzadko – znacznie rzadziej niż rak piersi. Stosowanie wyłącznie estrogenowej
HTZ wiąże się z nieznacznie zwiększonym ryzykiem raka jajnika.
Ryzyko raka jajnika zależy od wieku. Na przykład, u kobiet w wieku od 50 do 54 lat, które nie stosują
HTZ, rak jajnika zostanie rozpoznany w okresie 5 lat u około 2 na 2000 kobiet. U kobiet, które stosują
HTZ przez 5 lat, rak jajnika zostanie rozpoznany u około 3 kobiet na 2000 stosujących (tj. około 1
dodatkowy przypadek).
Wpływ HTZ na serce lub układ krążenia
Zakrzepy krwi w żyłach (zakrzepica żylna)
Ryzyko powstania zakrzepów krwi w żyłachjest około 1,3 do 3 razy wyższe u kobiet stosujących
HTZ niż u tych, które takiej terapii nie stosują, zwłaszcza w pierwszym roku leczenia.
Powstanie zakrzepów krwi może mieć poważne konsekwencje, a jeśli zakrzep dostanie się do płuc
może spowodować ból w klatce piersiowej, duszność, omdlenie lub nawet śmierć.
Prawdopodobieństwo powstania zakrzepów w żyłach zwiększa się z wiekiem oraz w przypadku
wymienionych niżej sytuacji. Jeśli którakolwiek z wymienionych niżej sytuacji dotyczy pacjentki,
należy poinformować o tym lekarza:
- unieruchomienie przez dłuższy czas z powodu poważnej operacji, urazu lub choroby (patrz także punkt 3 „Konieczność przeprowadzenia operacji”)
- znaczna nadwaga (wskaźnik masy ciała powyżej 30 kg/m )
- zaburzenia krzepnięcia krwi wymagające długotrwałego stosowania leków przeciwzakrzepowych
- zakrzepica naczyń kończyn dolnych, płuc lub innego narządu u bliskiego krewnego
- toczeń rumieniowaty układowy (ang. SLE; przewlekła choroba tkanki łącznej ze zmianami skórnymi w obrębie całego ciała)
- choroba nowotworowa.
Objawy zakrzepicy podano w punkcie „Kiedy należy przerwać stosowanie leku Ovestin i
niezwłocznie skontaktować się z lekarzem”.
Porównanie
U kobiet w wieku ponad 50 lat, które nie stosują HTZ, średnio u 4 do 7 na 1000 kobiet w okresie 5 lat
można spodziewać się wystąpienia zakrzepicy żył.
U kobiet w wieku powyżej 50 lat, które stosowały estrogenową HTZ przez ponad 5 lat, liczba
przypadków wyniesie 5 do 8 na 1000 kobiet (tj. 1 dodatkowy przypadek).
Choroba serca (zawał serca)
U kobiet, które stosują wyłącznie estrogenową HTZ, ryzyko rozwoju choroby serca nie jest
zwiększone.
Udar mózgu
Ryzyko wystąpienia udaru mózgu jest około 1,5-krotnie większe u kobiet stosujących HTZ niż u tych,
które takiej terapii nie stosują. Liczba dodatkowych przypadków udaru mózgu związanych ze
stosowaniem HTZ zwiększa się z wiekiem.
Porównanie
U kobiet w wieku ponad 50 lat niestosujących HTZ, w okresie 5 lat można spodziewać się
wystąpienia udaru mózgu średnio u 8 na 1000 kobiet, a u kobiet w tym samym wieku stosujących
HTZ wskaźnik ten wynosi 11 przypadków na 1000 kobiet w okresie 5 lat (tj. 3 dodatkowe przypadki).
Inne stany
HTZ nie zapobiegnie utracie pamięci. Pewne dowody świadczą o wyższym ryzyku utraty pamięci u
kobiet, które rozpoczynają stosowanie HTZ w wieku powyżej 65 lat. W tej sprawie należy zasięgnąć
porady lekarza.
Lek Ovestin a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować również tych, które
wydawane są bez recepty, lekach ziołowych lub innych produktach naturalnych.
Niektóre leki mogą wpływać na działanie leku Ovestin, co może prowadzić do wystąpienia
nieregularnych krwawień. Dotyczy to następujących leków:
- leki przeciwpadaczkowe(takie jak: fenobarbital, fenytoina i karbamazepina)
- leki stosowane w leczeniu gruźlicy(takie jak: ryfampicyna, ryfabutyna)
- leki stosowane w zakażeniu HIV(takie jak: newirapina, efawirenz, rytonawir i nelfinawir)
- produkty ziołowe zawierające ziele dziurawca zwyczajnego( Hypericum perforatum)
Badania laboratoryjne
Jeśli zaistnieje potrzeba wykonania badań laboratoryjnych krwi, należy poinformować lekarza lub
pracowników laboratorium o stosowaniu leku Ovestin, ponieważ może on wpływać na wyniki
niektórych testów.
Lek Ovestin z jedzeniem i piciem
Jedzenie i picie nie wpływają na działanie leku Ovestin.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży, lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Lek Ovestin jest przeznaczony wyłącznie do stosowania u kobiet po menopauzie.
W przypadku zajścia w ciążę należy przerwać stosowanie leku Ovestin i zgłosić się do lekarza.
Kobiety karmiące piersią przed zastosowaniem leku Ovestin powinny skonsultować się z lekarzem.
Prowadzenie pojazdów i obsługiwanie maszyn
Stosowanie leku Ovestin nie powinno mieć wpływu na zdolność prowadzenia pojazdów i
obsługiwania maszyn. Jednak indywidualna reakcja na lek może być zróżnicowana.
Lek Ovestin zawiera alkohol cetylowy oraz alkohol stearylowy.
Lek może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry).
3. Jak stosować lek Ovestin
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza lub farmaceuty. W razie wątpliwości
należy zwrócić się do lekarza lub farmaceuty.
W przypadku zmian zanikowych dolnego odcinka dróg moczowo–płciowych zalecana dawka to 1
aplikacja na dobę przez pierwsze tygodnie (maksymalnie 4 tygodnie), następnie dawkę zmniejsza się
stopniowo do 1 aplikacji dwa razy w tygodniu.
W celu poprawy gojenia się ran u kobiet po menopauzie, u których wykonywano zabiegi pochwowe,
zalecana dawka to 1 aplikacja na dobę w okresie 2 tygodni przed zabiegiem i 1 aplikacja dwa razy w
tygodniu w okresie 2 tygodni po zabiegu.
W celu ułatwienia interpretacji wyników wymazu z szyjki macicy u kobiet po menopauzie zalecana
dawka to 1 aplikacja co drugi dzień w tygodniu poprzedzającym pobranie wymazu.
Lek Ovestin krem należy stosować dopochwowo za pomocą aplikatora najlepiej przed udaniem się na
spoczynek nocny.
1 aplikacja (aplikator napełniony do znaku w kształcie okręgu) zawiera 0,5 g kremu, co odpowiada 0,5
mg estriolu.
- 1. Należy zdjąć kapturek z tuby, odwrócić i otworzyć tubę ostrym końcem.
- 2. Wkręcić aplikator na tubę. Upewnić się, że tłoczek jest w całości wsunięty do aplikatora.
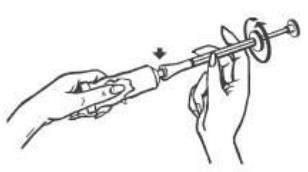
- 3. Powoli wycisnąć krem do aplikatora aż poczujemy opór tłoczka (tłoczek zatrzyma się w miejscu oznaczonym czerwoną obwódką wskazanym przez strzałki na rysunku poniżej).
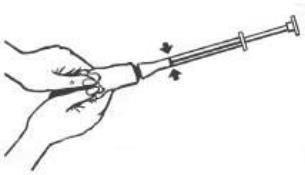
- 4. Odkręcić aplikator z tuby i z powrotem nałożyć kapturek na tubę.
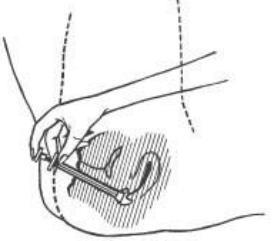
- 5. W pozycji leżącej umieścić końcówkę aplikatora z kremem głęboko w pochwie.
- 6. Powoli wcisnąć całą zawartość kremu do pochwy za pomocą tłoczka.
- 7. Po użyciu należy wyjąć tłoczek z aplikatora pokonując punkt oporu i dokładnie umyć obie części w ciepłej wodzie z mydłem. Nie używać detergentów. Po umyciu obie części należy dobrze wypłukać.
- 8. NIE WKŁADAĆ APLIKATORA DO GORĄCEJ LUB WRZĄCEJ WODY.
- 9. Urządzenie można złożyć ponownie wkładając tłoczek do aplikatora tak, by pokonać punkt oporu.
Po opróżnieniu tuby aplikator należy wyrzucić.
Lekarz prowadzący będzie starał się przepisać możliwie najniższą dawkę, która powinna być
przyjmowana najkrócej, jak to konieczne, w celu złagodzenia występujących objawów.
W przypadku wrażenia, że działanie leku Ovestin jest za mocne lub za słabe, należy zwrócić się do
lekarza.
Zastosowanie większej niż zalecana dawki leku Ovestin
W razie zastosowania większej niż zalecana dawki leku, należy niezwłocznie zwrócić się do lekarza
lub farmaceuty.
W przypadku połknięcia kremu, nie stanowi to zagrożenia dla zdrowia i życia. Niemniej jednak,
należy poinformować o tym lekarza. Objawy przedawkowania to najczęściej nudności i wymioty. U
kobiet po kilku dniach może także wystąpić krwawienie z dróg rodnych.
Pominięcie zastosowania leku Ovestin
Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej dawki.
W przypadku pominięcia dawki, lek należy zastosować jak najszybciej, chyba że pominięcie to
zauważano w dniu następnej aplikacji. Jeżeli pominięcie zostało zauważone w dniu następnej aplikacji
należy pominąć nieprzyjętą dawkę leku i stosować następne według wcześniej ustalonego schematu.
Konieczność przeprowadzenia operacji
Osoby, u których ma być przeprowadzona operacja, powinny powiedzieć chirurgowi, że stosują lek
Ovestin. Może być konieczne przerwanie stosowania leku około 4 do 6 tygodni przed operacją, żeby
zmniejszyć ryzyko powstania zakrzepów krwi (patrz punkt 2 „Zakrzepy krwi w żyłach ”). Należy
zapytać lekarza, kiedy będzie można ponownie zacząć stosować lek Ovestin.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku, należy zwrócić
się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Poniższe choroby są częściej zgłaszane u kobiet stosujących HTZ w postaci leków, które dostają się
do krwi, niż u kobiet niestosujących HTZ. Ryzyka te mniejszym stopniu dotyczą leków stosowanych
dopochwowo, takich jak lek Ovestin:
- rak jajnika
- zakrzepy krwi w żyłach nóg lub płuc (żylna choroba zakrzepowo-zatorowa)
- udar mózgu
- możliwa utrata pamięci, jeśli stosowania HTZ rozpoczyna się po 65. roku życia. Więcej informacji o tych działaniach niepożądanych, patrz punkt 2.
W zależności od stosowanych dawek oraz wrażliwości pacjentki mogą wystąpić następujące działania
niepożądane:
- obrzęk i zwiększona tkliwość piersi
- niewielkie krwawienie z pochwy
- zwiększona ilość wydzieliny z pochwy
- nudności
- zatrzymanie płynu w tkankach, zwykle objawiające się w postaci obrzęków kostek lub stóp
- miejscowe podrażnienie lub świąd
- objawy grypopodobne.
U większości pacjentek objawy te ustąpią po upływie kilku pierwszych tygodni leczenia.
W trakcie stosowania innych leków HTZ zgłaszano następujące działania niepożądane:
- zapalenie pęcherzyka żółciowego
- różne zaburzenia skóry
- odbarwienie skóry, zwłaszcza na twarzy lub szyi określane jako „plamy ciążowe” (ostuda)
- bolesne czerwonawe guzki na skórze (rumień guzowaty)
- wysypka z tarczowatym zaczerwieniem lub owrzodzeniami (rumień wielopostaciowy).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać
bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181 C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309,
strona internetowa: https://smz.ezdrowie.gov.pl.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Ovestin
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na opakowaniu. Termin
ważności oznacza ostatni dzień podanego miesiąca.
Nie przechowywać w temperaturze powyżej 25 C. Nie zamrażać.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Ovestin
- Substancją czynną leku Ovestin jest estriol. Jeden gram kremu zawiera 1 mg estriolu.
- Pozostałe składniki to: oktylododekanol, cetylu palmitynian, glicerol (E 422), alkohol cetylowy, alkohol stearylowy, polisorbat 60, sorbitanu stearynian, kwas mlekowy, chloroheksydyny dichlorowodorek, sodu wodorotlenek, woda oczyszczona.
Jak wygląda lek i co zawiera opakowanie
Lek Ovestin to biała do prawie białej, jednorodna, gładka masa o kremowej konsystencji i słabym,
charakterystycznym zapachu.
Jest dostarczany w tubie aluminiowej z polietylenową zakrętką i aplikatorem z cylindrem styrenowo-
akrylonitrylowym i polietylenowym tłokiem, w tekturowym pudełku.
Wielkość opakowania: 15 g kremu w tubie.
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do podmiotu
odpowiedzialnego lub importera równoległego.
Podmiot odpowiedzialny w Austrii, kraju eksportu:
Aspen Pharma Trading Limited
3016 Lake Drive
Citywest Business Campus
Dublin 24, Irlandia
Wytwórca:
Aspen Bad Oldesloe GmbH
Industriestrasse 32-36
D-23843 Bad Oldesloe
Niemcy
Importer równoległy:
InPharm Sp. z o.o.
ul. Strumykowa 28/11
03-138 Warszawa
Przepakowano w:
InPharm Sp. z o.o. Services sp. k.
ul. Chełmżyńska 249
04-458 Warszawa
Numer pozwolenia w Austrii, kraju eksportu:17453
Numer pozwolenia na import równoległy:128/24
Data zatwierdzenia ulotki: 20.03.2024
[Informacja o zastrzeżonym znaku towarowym]
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Podmiot odpowiedzialny (MAH)Aspen Pharma Trading Limited
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki OvestinPostać farmaceutyczna: Żel, 50 mcg/gSubstancja czynna: estriolProducent: Italfarmaco S.A.Wymaga receptyPostać farmaceutyczna: Globulki, 0,5 mgSubstancja czynna: estriolProducent: Dr. Kade Pharmazeutische Fabrik GmbHWymaga receptyPostać farmaceutyczna: Globulki, 0,5 mgSubstancja czynna: estriolWymaga recepty
Odpowiedniki Ovestin w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Ovestin – Ukraina
Odpowiednik Ovestin – Hiszpania
Lekarze online w sprawie Ovestin
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Ovestin – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.










