
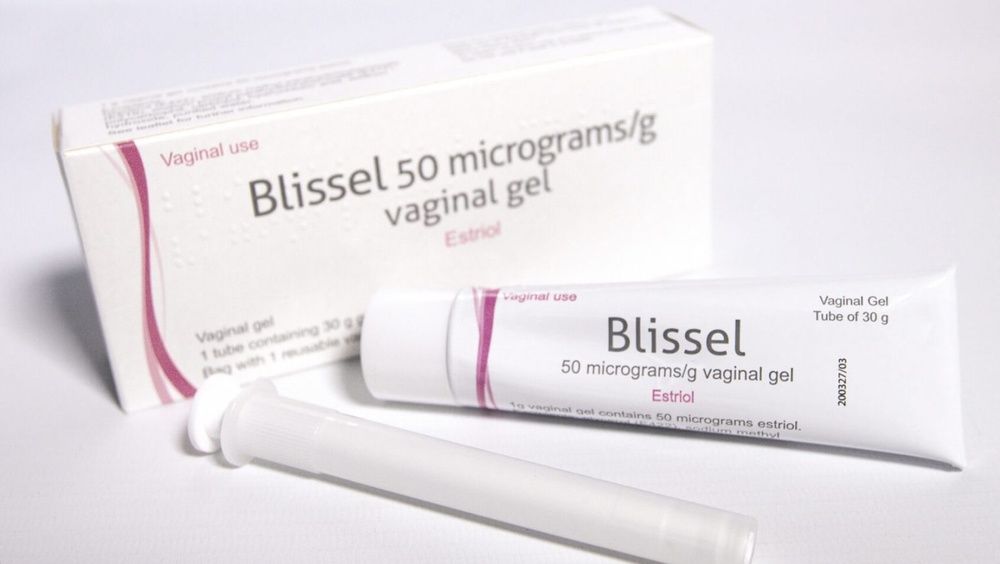
Blissel

Zapytaj lekarza o receptę na Blissel

Jak stosować Blissel
ULOTKA DOŁĄCZONA DO OPAKOWANIA: INFORMACJA DLA UŻYTKOWNIKA
Blissel 50 mikrogramów/g żel dopochwowy
estriol
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjentki.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjentki wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Blissel i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Blissel
- 3. Jak stosować lek Blissel
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Blissel
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Blissel i w jakim celu się go stosuje
Lek Blissel należy do grupy leków określanej jako hormonalna terapia zastępcza (HTZ) do podawania
dopochwowego (miejscowego).
Jest stosowany w celu łagodzenia objawów menopauzy występujących w pochwie, takich jak suchość
lub podrażnienie. W terminologii medycznej zjawisko to nazywa się „atrofią pochwy”. Jest ona
spowodowana zmniejszeniem stężenia estrogenów w organizmie i naturalnie występuje po
menopauzie.
Lek Blissel działa poprzez zastępowanie estrogenu, który jest wytwarzany przez jajniki kobiety. Lek
podawany jest dopochwowo, a więc hormon uwalniany jest tam, gdzie jest potrzebny. Może to
łagodzić odczucie dyskomfortu w pochwie.
2. Informacje ważne przed zastosowaniem leku Blissel
Wywiad lekarski i regularne kontrole
Stosowanie HTZ niesie ze sobą ryzyko, które powinno być rozważone, kiedy pacjentka decyduje się,
czy zastosować hormonalną terapię zastępczą lub kontynuować jej stosowanie.
Przed rozpoczęciem stosowania (lub wznowieniem) HTZ lekarz powinien przeprowadzić wywiad
lekarski, w tym rodzinny. Lekarz może zdecydować o przeprowadzeniu badania przedmiotowego.
Może ono obejmować badanie piersi i (lub) badanie ginekologiczne, jeżeli będą konieczne.
Jeśli pacjentka rozpocznie stosowanie leku Blissel, powinna odbywać regularne wizyty kontrolne
u lekarza (przynajmniej raz w roku). Podczas tych wizyt kontrolnych powinna omówić z lekarzem
korzyści i zagrożenia wynikające z kontynuacji stosowania leku Blissel.
Pacjentki powinny regularnie wykonywać badania przesiewowe piersi zgodnie z zaleceniem lekarza.
Kiedy nie stosować leku Blissel
W przypadku wystąpienia któregokolwiek z wymienionych poniżej schorzeń. Jeśli pacjentka ma
wątpliwości dotyczące któregokolwiek z poniższych punktów, należy skonsultować się z lekarzem
przed rozpoczęciem stosowania leku Blissel.
- Jeśli obecnie lub kiedykolwiek w przeszłości u pacjentki występował rak piersilub jeśli istnieje podejrzenie raka piersi;
- Jeśli u pacjentki występuje nowotwór wrażliwy na estrogeny, taki jak rak błony śluzowej macicy (endometrium), lub jeśli istnieje podejrzenie takiego nowotworu;
- Jeśli u pacjentki występuje krwawienie z pochwy o nieznanej przyczynie;
- Jeśli u pacjentki występuje nieleczone nadmierne pogrubienie błony wyściełającej jamęmacicy(rozrost endometrium);
- Jeśli obecnie lub kiedykolwiek w przeszłości u pacjentki występowały zakrzepy krwi w żyłach(zakrzepica), na przykład w obrębie kończyn dolnych (zakrzepica żył głębokich) lub płuc (zatorowość płucna);
- Jeśli u pacjentki występują zaburzenia krzepnięcia krwi(takie jak niedobór białka C, białka S lub antytrombiny);
- Jeśli u pacjentki występuje obecnie lub niedawno występowała choroba spowodowana obecnością zakrzepów krwi w tętnicach, taka jak zawał serca, udar mózgulub dławicapiersiowa;
- Jeśli u pacjentki występuje obecnie lub kiedykolwiek w przeszłości występowała chorobawątroby, a wyniki badań czynnościowych wątroby nie powróciły do normy;
- Jeśli u pacjentki występuje rzadka choroba krwi zwana porfirią, która przekazywana jest wśród członków rodziny (dziedziczona);
- Jeśli pacjentka ma uczulenie(nadwrażliwość) na estriol lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Jeśli którykolwiek z podanych wyżej stanów wystąpi po raz pierwszy podczas stosowania leku Blissel,
należy natychmiast przerwać jego stosowanie i niezwłocznie skonsultować się z lekarzem.
Ostrzeżenia i środki ostrożności
Lek jest podawany poprzez wprowadzenie aplikatora do pochwy. Może to powodować dyskomfort
lub bolesność u kobiet z ciężką atrofią pochwy (ścieńczenie lub stan zapalny ścian pochwy).
Należy powiedzieć lekarzowi, jeśli u pacjentki występuje lub występowała którakolwiek z poniższych
chorób (lub stanów), które w rzadkich przypadkach mogą powrócić lub nasilić się podczas stosowania
leku Blissel. W takich przypadkach lekarz może stwierdzić potrzebę częstszych kontroli:
- bardzo duże stężenie tłuszczów (triglicerydów) we krwi,
- wzrost komórek błony wyściełającej jamę macicy poza macicą (endometrioza) lub nadmierny rozrost błony (hiperplazja endometrium) w przeszłości,
- mięśniaki w macicy,
- wysokie ciśnienie tętnicze krwi,
- cukrzyca,
- kamica żółciowa,
- migrena lub silny ból głowy,
- rzadka choroba układu immunologicznego zwana toczniem rumieniowatym układowym (ang. systemic lupus erythematosus, SLE),
- padaczka,
- astma,
- choroba wpływająca na błonę bębenkową i słuch (otoskleroza),
- zatrzymanie płynów spowodowane zaburzoną czynnością serca lub nerek,
- zwiększone ryzyko powstawania zakrzepów krwi (patrz „Zakrzepy krwi w żyłach (zakrzepica żył)”),
- zwiększone ryzyko wystąpienia nowotworów zależnych od estrogenów (rak piersi u matki, siostry lub babki),
- choroba wątroby, np. łagodny guz wątroby,
- dziedziczny lub nabyty obrzęk naczynioruchowy.
Należy niezwłocznie skontaktować się z lekarzem w następujących przypadkach
- Jeśli u pacjentki wystąpi żółtaczka (zażółcenie oczu i skóry) lub zaburzenia czynności wątroby;
- nagły wzrost ciśnienia tętniczego krwi;
- migrena lub silny ból głowy, występujące po raz pierwszy;
- zajście w ciążę;
- Jeśli wystąpi jakikolwiek stan wymieniony w akapicie „Kiedy nie stosować leku Blissel”.
- Jeśli u pacjentki wystąpią objawy zakrzepów krwi, takie jak:
- bolesny obrzęk i zaczerwienienie kończyn dolnych,
- nagły ból w klatce piersiowej,
- trudności w oddychaniu.
Więcej informacji, patrz w punkcie „Zakrzepy krwi w żyłach (zakrzepica żył)”.
Jeśli wystąpi którakolwiek z powyższych sytuacji, możliwe, że lekarz będzie musiał przerwać leczenie
i zalecić inny lek.
Uwaga: lek Blissel nie jest środkiem antykoncepcyjnym. Jeżeli minęło mniej niż 12 miesięcy od
momentu wystąpienia ostatniej miesiączki lub pacjentka jest w wieku poniżej 50 lat, może być
konieczne zastosowanie dodatkowej metody zapobiegania ciąży. Należy skonsultować się z lekarzem.
HTZ a nowotwory
Nadmierne pogrubienie błony śluzowej macicy (hiperplazja endometrium) i rak błony śluzowej macicy (rak endometrium)
Stosowanie przez długi czas w HTZ tabletek zawierających wyłącznie estrogen może zwiększyć
ryzyko rozwoju raka błony śluzowej macicy (endometrium).
Nie wiadomo, czy podobne ryzyko istnieje podczas powtarzanego lub przedłużanego (dłuższego niż
jeden rok) stosowania leku Blissel. Jednak lek Blissel w bardzo małym stopniu ulega wchłanianiu do
krwi i dlatego dodawanie progestagenu nie jest konieczne.
Krwawienie bądź plamienie nie jest zwykle powodem do niepokoju, ale należy skonsultować się
z lekarzem. Może być to objaw pogrubienia endometrium.
Opisane niżej zagrożenia dotyczą stosowanych w ramach hormonalnej terapii zastępczej(HTZ)
leków, które krążą we krwi. Natomiast lek Blissel przeznaczony jest do stosowania miejscowo
w pochwie i wchłania się do krwi w bardzo niewielkim stopniu. Pogorszenie lub nawrót
wspomnianych niżej zaburzeń w trakcie stosowania leku Blissel jest mniej prawdopodobne, ale w
razie jakichkolwiek obaw należy zgłosić się do lekarza.
Leczenie produktami zawierającymi większe dawki estrogenów, które mogą zwiększać stężenie
estrogenów we krwi (takimi jak tabletki lub plastry), zwiększa ryzyko nieprawidłowego wzrostu
komórek błony wyściełającej jamę macicy (rozrost endometrium), niektórych typów nowotworów,
takich jak rak piersi i rak endometrium, oraz wystąpienia zakrzepów krwi w żyłach.
Rak piersi
Dane wskazują, że stosowanie leku Blissel nie zwiększa ryzyka wystąpienia raka piersi u kobiet, które
nigdy wcześniej na niego nie chorowały. Nie wiadomo, czy lek Blissel może być bezpiecznie
stosowany u kobiet, które chorowały na raka piersi.
- Należy regularnie badać piersi. Należy skontaktować się z lekarzem w przypadkuzauważenia zmian, takich jak:
- zapadanie się skóry,
- zmiany brodawki sutkowej,
- obecność guzków, które są widoczne lub wyczuwalne.
Dodatkowo, zaleca się wykonywanie przesiewowych badań mammograficznych zgodnie z
zaleceniami lekarza.
Nowotwór jajnika
Nowotwór jajnika występuje rzadko - znacznie rzadziej niż nowotwór piersi. Stosowanie HTZ
obejmującej tylko estrogeny wiąże się z nieznacznie zwiększonym ryzykiem nowotworu jajnika.
Ryzyko nowotworu jajnika zależy od wieku. Na przykład u kobiet w wieku od 50 do 54 lat, które nie
stosują HTZ, nowotwór jajnika zostanie rozpoznany w okresie 5 lat u około 2 na 2 000 kobiet.
U kobiet, które przyjmowały HTZ przez 5 lat, występuje u około 3 kobiet na 2 000 stosujących
(tj. około 1 dodatkowy przypadek).
Wpływ HTZ na serce i krążenie
Zakrzepy krwi w żyłach (zakrzepica żył)
Ryzyko wystąpienia zakrzepów krwi w żyłach jest od 1,3- do 3-krotnie większe u kobiet stosujących
HTZ w porównaniu do niestosujących, zwłaszcza w pierwszym roku stosowania.
Powstanie zakrzepów krwi może mieć poważne konsekwencje, a jeśli przeniosą się do płuc, mogą
spowodować ból w klatce piersiowej, duszność, utratę przytomności, a nawet śmierć.
Ryzyko wystąpienia zakrzepów krwi w żyłachjest większe, jeżeli pacjentka jest w starszym wieku
lub którakolwiek z poniższych sytuacji dotyczy pacjentki. Należy poinformować lekarza, jeżeli
którakolwiek z poniższych sytuacji dotyczy pacjentki:
- jeśli pacjentka nie jest w stanie chodzić przez długi czas z powodu dużej operacji, urazu lub choroby;
- występuje znaczna nadwaga (WMC > 30 kg/m );
- występują zaburzenia zatorowo-zakrzepowe, które wymagają długotrwałego przyjmowania leków zapobiegających powstawaniu zakrzepów krwi;
- u pacjentki lub kogokolwiek z bliskiej rodziny dochodziło w przeszłości do powstawania zakrzepów krwi w kończynach dolnych, płucach lub innych narządach;
- występuje toczeń rumieniowaty układowy;
- zdiagnozowano raka.
Porównanie
U kobiet w wieku od 50 do 59 lat, które nie stosują HTZ, liczbę przypadków zakrzepów krwi w żyłach
w ciągu 5 lat szacuje się na 4 do 7 na 1 000 kobiet.
U kobiet w wieku od 50 do 59 lat stosujących wyłącznie estrogenową HTZ przez ponad 5 lat liczba
przypadków wyniesie od 5 do 8 przypadków na 1 000 (tzn. 1 dodatkowy przypadek).
Choroba serca (zawał serca)
U kobiet stosujących wyłącznie estrogenową HTZ nie występuje zwiększone ryzyko rozwoju choroby
serca.
Udar
Ryzyko wystąpienia udaru jest około 1,5-krotnie większe u kobiet stosujących HTZ w porównaniu
do niestosujących. Liczba dodatkowych przypadków udaru spowodowanych stosowaniem HTZ
zwiększa się wraz z wiekiem.
Porównanie
U kobiet w wieku od 50 do 59 lat, które nie stosują HTZ, liczbę przypadków wystąpienia udaru w
ciągu 5 lat szacuje się średnio na 8 na 1 000 kobiet. Natomiast u kobiet w wieku od 50 do 59 lat, które
stosują HTZ, liczba przypadków w ciągu 5 lat wyniesie 11 na 1 000 kobiet (tzn. 3 dodatkowe
przypadki).
Lek Blissel a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, również tych, które wydawane są bez recepty, lekach roślinnych lub innych
produktach naturalnych.
Lek Blissel zawiera małą dawkę estriolu i jest przeznaczony do stosowania miejscowego, dlatego
nie oczekuje się, by miał wpływ na działanie innych przyjmowanych leków lub by inne przyjmowane
leki miały wpływ na działanie leku Blissel. Niemniej należy uwzględnić interakcje z innymi lekami
stosowanymi miejscowo dopochwowo.
Ciąża, karmienie piersią i wpływ na płodność
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży, lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Leku Blissel nie stosować w okresie ciąży.
Jeśli pacjentka zajdzie w ciążę w trakcie leczenia, należy natychmiast powiedzieć o tym lekarzowi
i przerwać stosowanie leku Blissel.
Lek Blissel nie powinien być stosowany podczas karmienia piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Lek Blissel nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Lek Blissel zawiera metylu parahydroksybenzoesan – sól sodową (E 219) i propylu parahydroksybenzoesan – sól sodową (E 217)
Lek może powodować reakcje alergiczne (możliwe reakcje typu późnego).
Nie stosować tego leku, jeśli pacjentka ma uczulenie na którykolwiek ze składników.
3. Jak stosować lek Blissel
Ten lek należy zawsze stosować zgodnie z opisem zawartym w tej ulotce lub zgodnie z zaleceniami
lekarza lub farmaceuty. W razie wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Zalecana dawka w pierwszych 3 tygodniach leczenia to jedna dawka podana za pomocą aplikatora raz
na dobę, najlepiej przed pójściem spać. Po 3 tygodniach stosowania dyskomfort powinien się
zmniejszyć i dawka powinna zostać zmniejszona. Może wystarczać tylko jedna dawka stosowana dwa
razy na tydzień.
W celu wprowadzenia żelu do pochwy należy stosować aplikator (zalecane jest stosowanie przed
pójściem spać).
Lekarz powinien przepisać pacjentce najmniejszą dawkę zapewniającą leczenie objawów, do
stosowania przez możliwie najkrótszy czas. Jeśli pacjentka uważa, że dawka leku jest zbyt duża lub za
mała, powinna skonsultować się z lekarzem.
Poniższa instrukcja wyjaśnia, jak stosować żel.
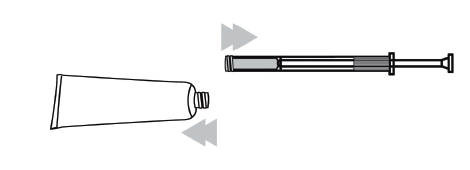
Na obrazku poniżej widoczne są różne elementy tuby i aplikatora (tłok i kaniula).
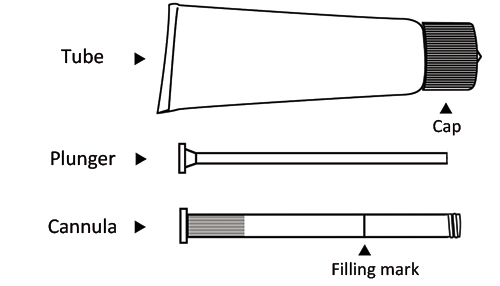
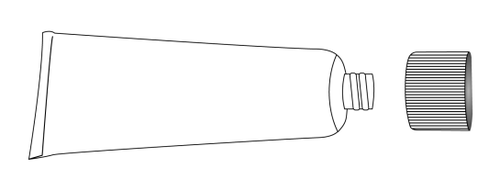
- 1. Odkręcić nakrętkę tuby, odwrócić ją i ostrym końcem przebić membranę zabezpieczającą tuby. Nie stosować, jeśli membrana jest uszkodzona.
- 2. Wyjąć kaniulę i tłok. Wsunąć biały tłok całkowicie do kaniuli. Przykręcić kaniulę do gwintu tuby.
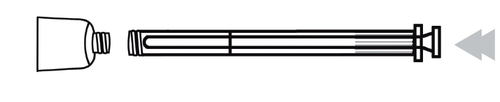
- 3. Ścisnąć tubę, aby napełnić aplikator żelem aż do oznaczenia napełnienia. Tłok zatrzyma sięna oznaczeniu.
- 4. Odkręcić kaniulę od tuby i zakręcić tubę zakrętką.
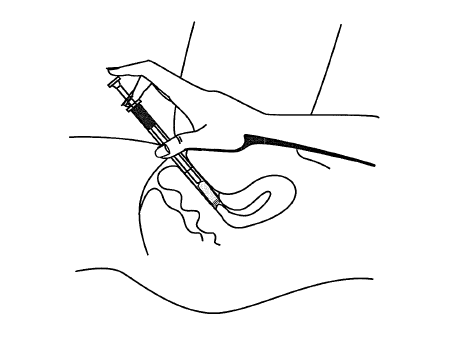
- 5. W celu zaaplikowania żelu należy się położyć, wprowadzić końcówkę aplikatora głęboko do pochwy i powoli wciskać tłok do oporu.
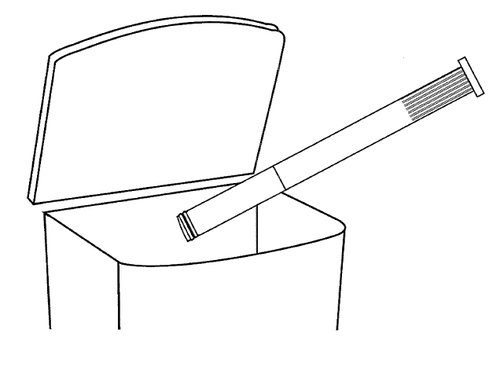
- 6. Po użyciu
Wielkość opakowania 10 g – 1 blister zawierający 10 rurek (kaniul) jednorazowego użytku i tłok
wielokrotnego użytku.
Wielkość opakowania 30 g – 3 blistry zawierające 30 rurek (kaniul) jednorazowego użytku i tłok
wielokrotnego użytku.
Wyjąć tłok z kaniuli, usunąć kaniulę i umyć dobrze tłok ciepłą i czystą wodą, tak aby można było
go ponownie użyć przy następnym podaniu.
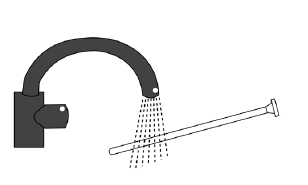
Wielkość opakowania 10 g – worek zawierający 1 rurkę (kaniulę) wielokrotnego użytku i tłok
wielokrotnego użytku.
Wielkość opakowania 30 g – worek zawierający 1 rurkę (kaniulę) wielokrotnego użytku i tłok
wielokrotnego użytku.
Wyjąć tłok z kaniuli. Umyć dobrze zarówno kaniulę, jak i tłok ciepłą i czystą wodą, tak aby można
było je ponownie użyć przy następnym podaniu.
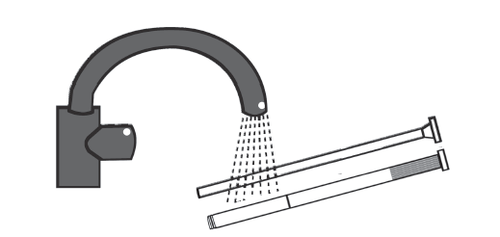
Zastosowanie większej niż zalecana dawki leku Blissel
Jeśli w dowolnym momencie zostanie podana zbyt duża dawka żelu lub jeśli ktoś przypadkowo
połknie pewną ilość żelu, nie ma powodu do niepokoju. Niemniej należy poradzić się lekarza.
Pacjentka może odczuwać nudności lub mogą wystąpić u niej wymioty, a u niektórych pacjentek
może wystąpić krwawienie z pochwy po kilku dniach.
Pominięcie zastosowania leku Blissel
Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej dawki.
Pominiętą dawkę należy podać po przypomnieniu, jeśli nie upłynęło więcej niż 12 godzin. Jeśli minęło
więcej niż 12 godzin, należy pominąć zapomnianą dawkę.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Należy niezwłocznie powiedzieć lekarzowi, jeśli wystąpi którykolwiek ze stanów wymienionych
w punkcie „Informacje ważne przed zastosowaniem leku Blissel”, taki jak krwawienie z pochwy.
Możliwe, że lekarz będzie musiał przerwać leczenie i zalecić inny lek.
Na początku leczenia może wystąpić miejscowe podrażnienie lub świąd. U większości pacjentek
te działania niepożądane ustępują w miarę stosowania leku. Należy powiedzieć lekarzowi, jeśli
wystąpi krwawienie z pochwy lub jeśli którekolwiek z poniższych działań niepożądanych stanie się
uciążliwe lub będzie się utrzymywać.
Częste działania niepożądane (mogą wystąpić u maksymalnie 1 na 10 osób):
Świąd, miejscowe podrażnienie w pochwie lub wokół pochwy
Niezbyt częste działania niepożądane (mogą wystąpić u maksymalnie 1 na 100 osób):
Ból w podbrzuszu, podrażnienie skóry, wysypka na narządach płciowych, ból głowy, kandydoza
(drożdżyca pochwy)
Wymienione niżej schorzenia zgłaszane są częściej u kobiet stosujących w ramach HTZ leki, które
krążą we krwi, niż u kobiet, które nie stosują HTZ. Ryzyko to w mniejszym stopniu dotyczy leków
podawanych dopochwowo, takich jak Blissel:
- zakrzepy krwi w naczyniach żylnych nóg lub płuc (żylna choroba zakrzepowo-zatorowa),
- rak jajnika,
- udar mózgu,
- możliwa utrata pamięci, jeśli rozpoczęto stosowanie HTZ w wieku powyżej 65 lat.
Więcej informacji o tych działaniach niepożądanych, patrz punkt 2.
W trakcie stosowania HTZ zgłaszano następujące działania niepożądane:
- kamica pęcherzyka żółciowego,
- różne zaburzenia skóry:
- odbarwienie skóry zwłaszcza twarzy lub szyi określane jako plamy ciążowe (ostuda),
- bolesne czerwonawe guzki skórne (rumień guzowaty),
- wysypka z charakterystycznym zaczerwienieniem lub bolesnością (rumień wielopostaciowy).
Zgłaszanie działań niepożądanych
Jeśli u pacjentki wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane
niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania
niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań
Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i
Produktów Biobójczych
Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl .
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Blissel
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku i etykiecie. Termin
ważności oznacza ostatni dzień podanego miesiąca.
Przechowywać w temperaturze poniżej 25ºC.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Lek Blissel zawiera
Substancją czynną jest estriol.
Jeden aplikator napełniony do oznaczenia dostarcza dawkę 1 g żelu dopochwowego, który zawiera
50 mikrogramów estriolu.
Pozostałe składniki to: glicerol (E 422), metylu parahydroksybenzoesan sodowy (E 219), propylu
parahydroksybenzoesan sodowy (E 217), polikarbofil, karbomer, sodu wodorotlenek , kwas solny
stężony, woda oczyszczona.
Jak wygląda lek Blissel i co zawiera opakowanie
Ten produkt leczniczy jest dostarczany w postaci bezbarwnego, przezroczystego do lekko
półprzezroczystego żelu dopochwowego, wielkość opakowania to 1 aluminiowa tuba 10 g lub 30 g.
- Wielkość opakowania 10 g - blister zawierający 10 rurek (kaniul) jednorazowego użytku i tłok wielokrotnego użytku. Pudełko tekturowe zawierające 10 g leku Blissel i jeden blister zawierający 10 rurek (kaniul) jednorazowego użytku z oznaczeniem napełnienia i tłok wielokrotnego użytku.
- Wielkość opakowania 10 g - worek zawierający 1 rurkę (kaniulę) wielokrotnego użytku i tłok wielokrotnego użytku. Pudełko tekturowe zawierające 10 g leku Blissel i jeden worek zawierający 1 rurkę (kaniulę) wielokrotnego użytku z oznaczeniem napełnienia i tłok wielokrotnego użytku.
- Wielkość opakowania 30 g - 3 blistry zawierające po 10 rurek (kaniul) jednorazowego użytku i tłok wielokrotnego użytku. Pudełko tekturowe zawierające 30 g leku Blissel i trzy blistry zawierające po 10 rurek (kaniul) jednorazowego użytku z oznaczeniem napełnienia i tłok wielokrotnego użytku.
- Wielkość opakowania 30 g - worek zawierający 1 rurkę (kaniulę) wielokrotnego użytku i tłok wielokrotnego użytku. Pudełko tekturowe zawierające 30 g leku Blissel i jeden worek zawierający 1 rurkę (kaniulę) wielokrotnego użytku z oznaczeniem napełnienia i tłok wielokrotnego użytku.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny
ITALFARMACO S.A.
San Rafael, 3 - 28108 Alcobendas
(Madryt)- Hiszpania
Tel: +34 916572323
Wytwórca
ITALFARMACO S.A.
San Rafael, 3 - 28108 Alcobendas
(Madryt)- Hiszpania
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
AT:
BLISSEL 50 Mikrogramm/g Vaginalgel
BE:
Blissel 50 Mikrogramm/g Vaginalgel
CY:
Blissel 50 μικρογραμμάρια/g κολπική γέλη
DK:
Gelisse 50 mikrogram/g vaginalgel
EL:
Blissel 50 μικρογραμμάρια/g κολπική γέλη
ES:
Blissel 50 microgramos/g gel vaginal
FI:
Blissel 50 mikrog/g emätingeeli
FR:
Blissel 50 microgrammes/g gel vaginal
IE:
Blissel 50 micrograms/g vaginal gel
NL:
Blissel 50 microgram/g gel voor vaginaal gebruik
NO:
Gelisse 50 mikrogram/g vaginalgel
PL:
BLISSEL
PT:
Blissel 50 microgramas/g gel vaginal
SE:
Blissel 50 mikrogram/g vaginal gel
UK (NI):
Blissel 50 micrograms/g vaginal gel
Data ostatniej aktualizacji ulotki:
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterItalfarmaco S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki BlisselPostać farmaceutyczna: Globulki, 0,5 mgSubstancja czynna: estriolProducent: Dr. Kade Pharmazeutische Fabrik GmbHWymaga receptyPostać farmaceutyczna: Globulki, 0,5 mgSubstancja czynna: estriolWymaga receptyPostać farmaceutyczna: Globulki, 0,5 mgSubstancja czynna: estriolWymaga recepty
Odpowiedniki Blissel w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Blissel – Ukraina
Odpowiednik Blissel – Hiszpania
Lekarze online w sprawie Blissel
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Blissel – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.










