
FEMMYN 0.03 mg Vaginal Suppositories

How to use FEMMYN 0.03 mg Vaginal Suppositories
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the User
Femmyn 0.03 mg vaginal tablets
Estriol
Read this package leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this package leaflet, you may need to read it again. If you have any further questions, ask your doctor or pharmacist.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their symptoms are the same as yours.
- If you experience any side effects, talk to your doctor or pharmacist. This includes any possible side effects not listed in this package leaflet. See section 4.
Contents of the package leaflet
- What Femmyn 0.03 mg vaginal tablets are and what they are used for
- What you need to know before you start using Femmyn 0.03 mg vaginal tablets
- How to use Femmyn 0.03 mg vaginal tablets
- Possible side effects
- Storing Femmyn 0.03 mg vaginal tablets
- Contents of the pack and other information
1. What Femmyn 0.03 mg vaginal tablets are and what they are used for
Femmyn belongs to a group of medicines called Hormone Replacement Therapy (HRT) vaginal products.
It is used to relieve menopausal symptoms in the vagina, such as dryness or irritation. In medical terms, this is known as "vaginal atrophy". It is caused by a decrease in estrogen levels in your body. This happens naturally after menopause.
Femmyn works by replacing the estrogens that are normally produced by the ovaries in women. It is inserted into your vagina, so the hormone is released where it is needed. This can relieve discomfort in the vagina.
Femmyn is not a contraceptive, nor does it restore fertility.
2. What you need to know before you start using Femmyn 0.03 mg vaginal tablets
Medical history and check-ups
The use of HRT carries risks that need to be considered when deciding whether to start or continue treatment.
Experience in treating women with premature menopause (due to ovarian failure or surgically induced) is limited. If you have premature menopause, the risks of using HRT may be different. Consult your doctor.
Before starting (or restarting) treatment with this medicine, your doctor will ask you about your personal and family medical history. Your doctor may consider it appropriate to perform a physical examination. This examination may include a breast examination and/or an internal examination, if necessary.
Once you have started treatment with Femmyn, you should see your doctor for regular check-ups (at least once a year). During these check-ups, you can discuss the benefits and risks of continuing treatment with Femmyn.
Have regular breast checks as recommended by your doctor
Do not use Femmyn
If you are in any of the following situations. If you are not sure, consult your doctorbefore using this medicine:
- If you have or have had breast cancer, or if you suspect you may have it.
- If you have estrogen-sensitive cancer, such as cancer of the lining of the uterus (endometrium), or if you suspect you may have it.
- If you have abnormal vaginal bleeding.
- If you have excessive thickening of the lining of the uterus(endometrial hyperplasia) for which you are not receiving treatment.
- If you have or have ever had a blood clot in a vein(thrombosis), such as in the legs (deep vein thrombosis) or lungs (pulmonary embolism).
- If you have a disorder that affects blood clotting(such as lack of protein C, protein S, or antithrombin).
- If you have or have recently had a disease caused by blood clots in the arteries, such as a heart attack, stroke, or angina.
- If you have or have had a severe liver disorderand liver function tests have not returned to normal.
- If you have a rare blood disorder called "porphyria" that is inherited from family members.
- If you are allergicto estriolor any of the other ingredients of this medicine (listed in section 6).
If any of the above conditions appear for the first time while using this medicine, stop taking it immediately and consult your doctor.
Warnings and precautions
Consult your doctor or pharmacist before starting treatment with Femmyn. Inform your doctor if you have or have had any of the following diseases before starting treatment, as they may reappear or worsen during treatment with Femmyn. If this is the case, you should see your doctor more often for check-ups:
- Uterine fibroids.
- Growth of the lining of the uterus outside the uterus (endometriosis) or a history of excessive growth of the lining of the uterus (endometrial hyperplasia).
- Increased risk of blood clots (see "Blood clots in a vein (thrombosis)").
- Increased risk of estrogen-sensitive cancer (such as having a mother, sister, or grandmother who has had breast cancer).
- High blood pressure.
- Liver disorders, such as a benign tumor in the liver.
- Diabetes.
- Gallstones.
- Migraine or severe headache.
- Systemic immune system disease that affects many parts of the body (systemic lupus erythematosus, SLE).
- Epilepsy.
- Asthma.
- Disease affecting the eardrum and ear (otosclerosis).
- Very high levels of fat in the blood (triglycerides).
- Fluid retention due to heart or kidney problems.
- Hereditary and acquired angioedema.
Before starting treatment with this medicine, vaginal infections should be treated with appropriate medications.
Stop using Femmynand contact your doctor immediately
If you experience any of the following symptoms when taking HRT:
- If any of the situations listed in the "Do not use Femmyn" section occur.
- Yellowing of the skin or the white part of the eyes (jaundice). These can be signs of liver disease.
- Significant increase in blood pressure (symptoms may be headache, fatigue, dizziness).
- If you experience migraine or severe headache for the first time.
- Pregnancy.
- If you notice symptoms of thrombosis such as
- pain and swelling in the legs
- sudden chest pain
- or difficulty breathing
For more information, see "Stop using Femmyn and contact your doctor immediately".
If any of the above conditions occur, your doctor may need to ask you to stop treatment and indicate an alternative.
Observation
Femmyn is not a contraceptive. If you are less than 12 months since your last menstrual period or are under 50 years old, you may need to use an additional contraceptive method to avoid pregnancy. Ask your doctor.
HRT and cancer
Excessive growth of the lining of the uterus (endometrial hyperplasia) and cancer of the lining of the uterus (endometrial cancer)
Taking estrogen-only HRT tablets for a long time may increase the risk of developing cancer of the lining of the uterus (the endometrium).
It is not clear if there is a similar risk if Femmyn is used for repeated or long-term treatment (more than one year). However, Femmyn has shown to have very low absorption into the bloodstream, so the addition of a progestogen is not necessary.
Bleeding or spotting may occur, usually it is not a cause for concern, but consult your doctor. It may be a symptom that your endometrium is thickening.
The following risks apply to Hormone Replacement Therapy (HRT) medications that enter the bloodstream. Femmyn is used for local treatment in the vagina and absorption into the blood is very low. It is less likely that the situations described below will worsen or reappear during treatment with Femmyn, but you should visit your doctor if they affect you.
Breast cancer
Data suggest that using Femmyn does not increase the risk of breast cancer in women who have not had breast cancer in the past. It is not known if Femmyn can be used safely in women who have had breast cancer in the past.
Check your breasts regularly. Visit your doctor if you notice any changes such as:
- Dimpling of the skin.
- Changes in the nipple.
- Any lump that you can see or feel.
In addition, you may have mammograms when suggested.
Ovarian cancer
Ovarian cancer is rare - much rarer than breast cancer. The use of estrogen-only HRT has been associated with a slightly higher risk of ovarian cancer.
The risk of ovarian cancer varies with age. For example, in women aged 50-54 who are not taking HRT, about 2 women in 2,000 will be diagnosed with ovarian cancer over a 5-year period. In women taking HRT for 5 years, about 3 cases per 2,000 women have been observed (i.e., about one additional case).
Effect of HRT on the heart and circulation
Blood clots in a vein (thrombosis)
The risk of having blood clots in the veinsis approximately 1.3 to 3 times higher in HRT users than in non-users, especially during the first year of use.
Blood clots can be serious, and if one travels to the lungs, it can cause chest pain, difficulty breathing, fainting (fainting), and even death.
You are more likely to have a blood clot in the veins as you get older and if you have any of the following circumstances. Inform your doctor if you have any of these conditions:
- You are unable to walk for a long time due to major surgery, injury, or illness (see also section 3, If you are going to have surgery).
- You have significant obesity (body mass index > 30 kg/m2).
- You have a blood clotting disorder that requires long-term treatment with a medicine used to prevent blood clots.
- Any of your close relatives have had a blood clot in the leg, lung, or other organ.
- You have systemic lupus erythematosus (SLE).
- You have cancer.
For more information on the symptoms of blood clot formation, see "Stop using Femmyn and contact your doctor immediately".
Comparative data
On average, in a 5-year period, among women in their 50s who are not taking HRT, 4 to 7 out of 1,000 will develop a blood clot in the veins.
Among women in their 50s who have been taking estrogen-only HRT for more than 5 years, there will be 5 to 8 cases per 1,000 users (i.e., 1 additional case).
Heart disease (heart attack)
For women taking estrogen-only therapy, there is no increased risk of developing heart disease.
Stroke
The risk of having a stroke is 1.5 times higher in HRT users than in non-users. The number of additional stroke cases due to HRT use will increase with age.
Comparative data
Among women in their 50s who are not taking HRT, on average, 8 out of 1,000 will have a stroke over a 5-year period. Among women in their 50s who use HRT, there will be 11 cases per 1,000 users over a 5-year period (i.e., 3 additional cases).
Other warnings
HRT will not prevent memory loss. There is some evidence of a higher risk of memory loss in women who start HRT after the age of 65. Ask your doctor for advice.
Using Femmyn 0.03 mg vaginal tablets with other medicines
Tell your doctor or pharmacist if you are taking, have recently taken, or might take any other medicines, including those without a prescription, herbal medicines, or other natural products.
This medicine is used for local treatment in the vagina and interactions with other medicines are not expected after administration of this medicine.
This medicine may affect other treatments applied to the vagina but it is unlikely to affect other medicines.
The simultaneous use of this medicine with latex condoms may reduce the strength of the condoms and affect the safety provided by the condoms.
Pregnancy and breastfeeding
Femmyn is indicated for postmenopausal women. If you become pregnant, stop taking this medicine and contact your doctor.
Driving and using machines
The influence of this medicine on the ability to drive and use machines is nil or insignificant.
Femmyn contains butylhydroxytoluene
This medicine may cause local skin reactions (such as contact dermatitis) or irritation of the eyes and mucous membranes because it contains butylhydroxytoluene.
3. How to use Femmyn 0.03 mg vaginal tablets
Follow the instructions for using this medicine exactly as indicated by your doctor. If you are unsure, consult your doctor or pharmacist again.
The recommended dose is:
The recommended dose is one tablet per day (corresponding to 0.03 mg of estriol per day), vaginally, for the first three weeks of treatment. Then, a maintenance dose of one tablet twice a week is recommended.
Your doctor will try to prescribe the lowest dose to treat your symptoms and for the shortest necessary time. Consult your doctor if you think this dose is too strong or not strong enough for you.
Method and duration of administration
The tablet should be inserted deeply into the vagina, preferably at night before going to bed.
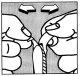
To administer the tablet, separate the two layers to the sides until the tablet can be easily removed.
If you are going to have surgery
If you are going to have surgery, inform the surgeon that you are using Femmyn. You may need to stop using Femmyn for about 4 to 6 weeks before the operation to reduce the risk of blood clot formation (see section 2, "Blood clots in a vein"). Ask your doctor when you can start using Femmyn again.
If you use more Femmyn than you should
You should not be concerned if you accidentally administer more tablets than necessary, however, consult your doctor. Symptoms that may appear are nausea and vomiting, and vaginal bleeding may also occur after a few days.
In case of overdose or accidental ingestion, consult your doctor or pharmacist or call the Toxicology Information Service. Phone 915 620 420, indicating the medicine and the amount used.
If you forget to use Femmyn 0.03 mg vaginal tablets
- During daily treatment for the first three weeks:
If you forget a dose and do not realize it until the next day, do not worry about the missed dose, and continue with the treatment.
- During maintenance treatment twice a week:
If you forgot to use Femmyn on the scheduled day, administer it as soon as possible and continue with your usual schedule.
If you stop treatment with Femmyn 0.03 mg vaginal tablets
Although symptoms improve considerably, you should continue treatment until the end. If you want to interrupt or stop treatment, consult your doctor.
If you have any other questions about the use of this medicine, ask your doctor or pharmacist.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
The following diseases are more common in women using HRT medications that circulate in the blood, compared to women not using HRT. These risks are less related to treatments administered vaginally, such as Femmyn:
- Ovarian cancer
- Blood clots in the veins of the legs or lungs (venous thromboembolism)
- Stroke
- Possible memory loss, if HRT is started after the age of 65
For more information on these side effects, see Section 2.
Local irritation may occur at the start of treatment.
Common side effects (1 to 10 per 100 users)
- Vulvovaginal burning, itching, and pain
- Difficulty urinating (dysuria)
Uncommon side effects (1 to 10 per 1,000 users)
- Vaginal discharge
- Anorectal discomfort
The following side effects have been reported with other HRTs:
- Gallbladder disease
- Various skin conditions:
- Discoloration of the skin, especially on the face or neck, known as "pregnancy patches" (chloasma);
- Painful red skin nodules (erythema nodosum);
- Rash with redness or blisters in a target shape (erythema multiforme).
Reporting side effects:
If you experience any side effects, talk to your doctor or pharmacist, even if it is a possible side effect not listed in this package leaflet. You can also report them directly through the Spanish Pharmacovigilance System for Human Use Medicines: https://www.notificaram.es. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Femmyn 0.03 mg ovules
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiry date which is stated on the carton and on the blister after "EXP". The expiry date is the last day of the month indicated.
Do not store above 25°C.
Medicines should not be disposed of via wastewater or household waste. Place the packaging and any unused medicines in the SIGRE collection point at your pharmacy. If you are unsure, ask your pharmacist how to dispose of the packaging and any unused medicines. This will help protect the environment.
6. Package contents and additional information
Composition of Femmyn 0.03 mg ovules
- The active ingredient is estriol. Each ovule contains 0.03 mg of estriol.
- The other ingredients are butylhydroxytoluene, mono/di-(Z,R)-12-hydroxyoctadeca-9-enoate of glycerol, hard fat, ceto-stearyl ether of macrogol.
Appearance of the product and package contents
Femmyn are white ovules.
Femmyn is available in packs of 10, 15, 20 or 30 ovules.
Only some pack sizes may be marketed.
Marketing authorization holder and manufacturer
Marketing authorization holder:
Kern Pharma, S.L.
Venus, 72 - Pol. Ind. Colón II
08228 Terrassa - Barcelona
Spain
Manufacturer:
Dr. Kade Pharmazeutische Fabrik GmbH
Rigistraße 2
12277 Berlin
Germany
Date of last revision of this leaflet: December 2023
Detailed and up-to-date information on this medicine is available on the website of the Spanish Agency for Medicines and Health Products (AEMPS)
http://www.aemps.gob.es/
- Country of registration
- Availability in pharmacies
Supply issue reported
Data from the Spanish Agency of Medicines (AEMPS) indicates a supply issue affecting this medicine.<br><br>Availability may be limited in some pharmacies.<br><br>For updates or alternatives, consult your pharmacist. - Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to FEMMYN 0.03 mg Vaginal SuppositoriesDosage form: VAGINAL SEMISOLID, 50 micrograms/gActive substance: estriolManufacturer: Italfarmaco S.A.Prescription requiredDosage form: VAGINAL SEMISOLID, 50 micrograms/gActive substance: estriolManufacturer: Italfarmaco S.A.Prescription requiredDosage form: VAGINAL SUPPOSITORY/CAPSULE/TABLET, 0.5 mg estriolActive substance: estriolManufacturer: Aspen Pharma Trading LimitedPrescription required
Online doctors for FEMMYN 0.03 mg Vaginal Suppositories
Discuss questions about FEMMYN 0.03 mg Vaginal Suppositories, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions











