
Lutrate Depot

Zapytaj lekarza o receptę na Lutrate Depot

Jak stosować Lutrate Depot
Ulotka dołączona do opakowania: informacja dla pacjenta
Lutrate Depot, 22,5 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
o przedłużonym uwalnianiu
Leuprorelinum
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek dalszych wątpliwości należy zwrócić się do lekarza lub farmaceuty .
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Lutrate Depot i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Lutrate Depot
- 3. Jak stosować lek Lutrate Depot
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Lutrate Depot
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Lutrate Depot i w jakim celu się go stosuje
Lutrate Depot jest lekiem dostępnym w postaci białego proszku w fiolce, który jest przekształcany
w zawiesinę do wstrzyknięć domięśniowych. Lutrate Depot zawiera substancję czynną – leuprorelinę
(zwaną także leuprolidem), która należy do grupy leków nazywanych agonistami hormonu
uwalniającego hormon o nazwie luteotropina (LHRH). Leki te zmniejszają stężenie hormonu
płciowego – testosteronu.
Lek Lutrate Depot jest przepisywany przez lekarza w paliatywnym leczeniu zaawansowanego raka
gruczołu krokowego.
2. Informacje ważne przed zastosowaniem leku Lutrate Depot
Kiedy nie stosować leku Lutrate Depot
- jeśli pacjent ma uczulenie na LHRH, leki z grupy agonistów LHRH lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6). Reakcje alergiczne mogą powodować: wysypkę, swędzenie skóry, trudności w oddychaniu lub obrzęk twarzy, warg, gardła lub języka.
- jeśli u pacjenta przeprowadzono zabieg usunięcia jąder (orchidektomię)
- u kobiet i dzieci
- jeśli u pacjenta występuje ucisk na rdzeń kręgowy lub przerzuty do kręgosłupa nie należy stosować leku Lutrate Depot w monoterapii (tj. jako jedynego leku) w leczeniu raka gruczołu krokowego
Ostrzeżenia i środki ostrożności
- Przed rozpoczęciem stosowania Lutrate Depot należy zwrócić się do lekarza lub farmaceuty.
- Stan pacjenta może się pogorszyć podczas pierwszych tygodni leczenia, ale powinien ulec poprawie w miarę jego kontynuacji. Objawy przedmiotowe i podmiotowe obejmują: przemijające zwiększenie stężenia testosteronu (męski hormon płciowy), uderzenia gorąca, ból kości, zaburzenia układu nerwowego (w tym depresję) lub trudności w oddawaniu moczu.
- Jeśli pacjent uważa, że wystąpiła u niego reakcja alergiczna (zadyszka, astma, katar, obrzęk twarzy, pokrzywka, wykwity skórne), powinien przestać stosować lek i powiedzieć o tym lekarzowi.
- Należy powiedzieć lekarzowi, jeśli pacjent znajduje się w grupie ryzyka lub aktualnie występuje u niego którekolwiek z wymienionych poniżej schorzeń, gdyż lekarz może wówczas zlecić częstsze wykonywanie badań kontrolnych:
- jeśli u pacjenta występują niewiadomego pochodzenia siniaki lub krwawienie lub pacjent ogólnie nie czuje się dobrze. Choć objawy te występują rzadko, mogą wskazywać na zmianę liczby czerwonych lub białych krwinek.
- jeśli u pacjenta występuje choroba metaboliczna
- jeśli u pacjenta występują problemy z sercem lub kołatanie serca
- jeśli u pacjenta występuje cukrzyca
- Należy poinformować lekarza, jeśli u pacjenta występował wcześniej gruczolak przysadki mózgowej (niezłośliwy guz przysadki). Opisano przypadki występowania udaru przysadki (częściowego zaniku tkanki gruczołu przysadki) po rozpoczęciu stosowania tego typu leków u pacjentów z gruczolakiem przysadki. Objawami udaru przysadki mogą być: nagły ból głowy, zez, zaburzone lub zmienione widzenie, a nawet utrata wzroku oraz sporadycznie zaburzenia świadomości.
- Należy poinformować lekarza, jeśli u pacjenta występują zaburzenia krwawienia, małopłytkowość lub pacjent stosuje leki przeciwzakrzepowe. Może być konieczne częstsze kontrolowanie czynności wątroby u pacjenta, ponieważ podczas leczenia leuproreliną informowano o zaburzeniach czynności wątroby i występowaniu żółtaczki (zażółcenie oczu i skóry).
- Podczas leczenia leuproreliną odnotowano złamania trzonów kręgosłupa, porażenie, zmniejszenie ciśnienia tętniczego krwi i zwiększenie ciśnienia tętniczego krwi.
- U pacjentów otrzymujących Lutrate Depot obserwowano wystąpienie depresji, która może być ciężka. W przypadku wystąpienia nastroju depresyjnego należy poinformować o tym lekarza.
- Raportowano o występowaniu zmniejszonej gęstości kości (kruchości lub ścieńczenia kości) w następstwie stosowania leuproreliny. Lekarz może rozważyć zastosowanie leku z grupy antyandrogenów podczas leczenia lekiem Lutrate Depot. W takim przypadku musi zwrócić szczególną uwagę na wystąpienie zapalenia żył i innych objawów zaburzenia krzepnięcia krwi oraz obrzęków (dłoni, stóp lub stawów), gdyż podczas jednoczesnego stosowania antyandrogenu i leku Lutrate Depot zwiększa się ryzyko ich wystąpienia.
- Jeśli u pacjenta wystąpi ucisk na rdzeń kręgowy i (lub) zaburzenia oddawania moczu i (lub) hematuria (obecność krwi w moczu), lekarz rozpocznie - jeśli to będzie konieczne - dodatkowe postępowanie, aby zapobiec wystąpieniu powikłań neurologicznych (np. mrowienia w dłoniach i stopach, porażenia) lub zablokowania cewki moczowej (rurka odprowadzająca mocz z pęcherza moczowego na zewnątrz ciała). Pacjent powinien mieć zapewnioną stałą opiekę lekarza w pierwszych tygodniach leczenia.
- U pacjentów mogą występować zmiany metaboliczne (np. nietolerancja glukozy lub zaostrzenie przebiegu istniejącej cukrzycy), zmiany masy ciała oraz zaburzenia sercowo- naczyniowe.
- Podczas leczenia leuproreliną należy kontrolować pacjentów z chorobą metaboliczną lub sercowo-naczyniową, szczególnie pacjentów z występującą w przeszłości zastoinową niewydolnością serca (choroba, w której serce nie jest w stanie dostarczać wystarczającej ilości krwi do innych części ciała).
- Przed przyjęciem leku Lutrate Depot należy omówić to z lekarzem, farmaceutą lub pielęgniarką jeśli pacjent ma stłuszczoną wątrobę.
- Podczas leczenia może być konieczne wykonywanie u pacjenta niektórych badań krwi, aby upewnić się o skuteczności leku Lutrate Depot.
- Może wystąpić zmniejszone zainteresowanie seksem, uderzenia gorąca i niekiedy zmniejszenie wielkości jąder oraz osłabienie ich funkcji. Po zakończeniu leczenia lekiem Lutrate Depot pacjent może odzyskać płodność.
- Ponieważ Lutrate Depot może zaburzać wyniki niektórych badań laboratoryjnych, pacjent powinien poinformować lekarza zlecającego badania o przyjmowaniu tego leku.
- U pacjentów, u których występowały w przeszłości drgawki, u pacjentów z padaczką, z zaburzeniami krążenia mózgowego, z anomaliami lub guzami ośrodkowego układu nerwowego oraz u pacjentów otrzymujących leki mogące wywołać drgawki, a także - choć w mniejszym stopniu - u pacjentów nienależących do żadnej z tych grup, mogą podczas leczenia wystąpić drgawki.
- Należy powiedzieć lekarzowi, jeśli u pacjenta występują choroby serca lub naczyń, w tym zaburzenia rytmu serca (arytmia) lub jeśli pacjent przyjmuje leki stosowane w tych chorobach. Stosowanie leku Lutrate Depot może nasilać zaburzenia rytmu serca.
- Jeśli u pacjenta występują silne lub nawracające bóle głowy, trudności związane z widzeniem i dzwonienie lub brzęczenie w uszach, należy niezwłocznie zwrócić się do lekarza.
- W związku ze stosowaniem leuproreliny zgłaszano ciężkie wysypki skórne, w tym zespół Stevensa-Johnsona i toksyczną martwicę rozpływną naskórka (SJS/TEN). W przypadku zauważenia któregokolwiek z objawów związanych z ciężkimi reakcjami skórnymi opisanymi w punkcie 4 stosowanie leuproreliny należy przerwać i natychmiast skontaktować się z lekarzem.
Lutrate Depot a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować. Niewykluczone, że mogą one
być nadal stosowane z lekiem Lutrate Depot, ale decyzję o tym podejmie lekarz.
Lutrate Depot może zakłócać działanie niektórych leków stosowanych w zaburzeniach rytmu serca
(np. chinidyna, prokainamid, amiodaron i sotalol) lub może zwiększać ryzyko wystąpienia zaburzeń
rytmu serca, gdy jest stosowany z niektórymi innymi lekami, np. z metadonem (stosowanym w celu
zmniejszenia bólu lub jako jeden z leków stosowanych w leczeniu uzależnienia od narkotyków),
z moksyfloksacyną (antybiotyk), lekami przeciwpsychotycznymi stosowanymi w ciężkich chorobach
psychicznych.
Ciąża i karmienie piersią
Lek Lutrate Depot nie jest przeznaczony do stosowania u kobiet.
Ten lek jest przeciwwskazany u kobiet w ciąży. Jego stosowanie podczas ciąży może spowodować
wystąpienie poronienia spontanicznego.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie badano wpływu leku Lutrate Depot na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podczas leczenia mogą wystąpić zaburzenia widzenia i zawroty głowy. Jeśli wystąpią u pacjenta, nie
powinien on prowadzić pojazdów ani obsługiwać maszyn.
Lutrate Depot zawiera sód
Lek zawiera mniej niż 1 mmol (23 mg) sodu w 1 fiolce, to znaczy lek uznaje się za „wolny od sodu”.
3. Jak stosować lek Lutrate Depot
Dawka
Lek Lutrate Depot powinien być podawany wyłącznie przez lekarza lub pielęgniarkę, którzy również
zajmą się przygotowaniem roztworu.
Dorośli, w tym pacjenci w podeszłym wieku
Zalecana dawka leku Lutrate Depot to jedno wstrzyknięcie raz na trzy miesiące. Po przekształceniu
proszku w zawiesinę podaje się ją w pojedynczym wstrzyknięciu domięśniowym raz na trzy miesiące.
Miejsce wstrzyknięcia należy zmieniać w regularnych odstępach czasu.
Lutrate Depot należy podawać wyłącznie domięśniowo. Nie należy stosować innej drogi podania.
O intensywności leczenia decyduje lekarz.
Stosowanie u dzieci
Lutrate Depot nie jest wskazany do stosowania u dzieci.
Zastosowanie większej niż zalecana dawki leku Lutrate Depot
Nie jest prawdopodobne, aby lekarz lub pielęgniarka nie znali prawidłowego dawkowania. Jeśli
jednak pacjent podejrzewa, że otrzymał większą dawkę niż powinien, należy o tym niezwłocznie
powiedzieć lekarzowi, aby można było podjąć odpowiednie postępowanie.
Pominięcie zastosowania leku Lutrate Depot
Ważne jest, aby nie pominąć przyjęcia dawki leku Lutrate Depot. Jeśli pacjent zapomniał
o wstrzyknięciu, powinien tak szybko, jak tylko sobie o tym przypomni, skontaktować się z lekarzem,
który wykona następne wstrzyknięcie.
Przerwanie stosowania leku Lutrate Depot
Ponieważ leczenie lekiem Lutrate Depot jest długotrwałe, jego przerwanie może spowodować
nasilenie objawów choroby. Nie należy więc przedwcześnie przerywać leczenia bez zgody lekarza.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Należy natychmiast powiedzieć lekarzowi, jeśli u pacjenta wystąpią: nagły świszczący oddech, trudności w oddychaniu, obrzęk powiek, twarzy lub warg, wysypka lub swędzenie skóry
(zwłaszcza obejmujące całe ciało).
Zgłaszano występowanie następujących działań niepożądanych:
Bardzo często(mogą wystąpić częściej niż u 1 na 10 osób):
uderzenia gorąca i reakcje w miejscu wstrzyknięcia
Często(mogą wystąpić rzadziej niż u 1 na 10 osób):
zimne poty, nadmierna potliwość (zwiększone pocenie się), świąd (swędzenie), zmęczenie,
bezsenność (niemożność zaśnięcia), osłabienie popędu płciowego, zawroty głowy, rumieńce, nudności
(mdłości), biegunka, zmniejszenie apetytu, zaburzenia erekcji, osłabienie (zmniejszenie lub utrata sił),
ból kości, ból stawów i reakcje w miejscu wstrzyknięcia, takie jak: ból, stwardnienie, rumień
(zaczerwienienie skóry), ból w układzie moczowym, zmniejszony przepływ moczu, częsta potrzeba
oddawania moczu, zmiany nastroju i depresja po długotrwałym stosowaniu leuproreliny, zmiany
aktywności enzymów wątrobowych i zwiększenie stężenia triglicerydów we krwi (zwiększone
stężenie lipidów we krwi), zwiększenie stężenia glukozy we krwi
Niezbyt często(mogą wystąpić rzadziej niż u 1 na 100 osób):
duże stężenie cholesterolu we krwi, zaburzenia snu, niepokój, zaburzenia smaku, mrowienie
(zaburzenia odczuwania skórnego), ból głowy, śpiączka (senność), zaburzenia widzenia, zapalenie
opłucnej, dzwonienie w uszach (szumy uszne), ból w nadbrzuszu, zaparcie, grudki, rumień,
uogólniony świąd (swędzenie), nocne poty, ból pleców, ból mięśni, ból szyi, ból sutków, ból w
obrębie miednicy, zanik jąder, zaburzenia dotyczące jąder, uczucie gorąca, zmiany nastroju i depresja
po krótkotrwałym stosowaniu leuproreliny, zmiany wyników badania krwi i zmiany w obrazie EKG
(wydłużenie odstępu QT) oraz reakcje w miejscu wstrzyknięcia, takie jak: pokrzywka, uczucie ciepła
i krwotok
Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych):
zapalenie płuc, choroba płuc, idiopatyczne nadciśnienie wewnątrzczaszkowe (zwiększone ciśnienie
wewnątrzczaszkowe wokół mózgu, charakteryzujące się bólem głowy, podwójnym widzeniem i
innymi objawami dotyczącymi widzenia oraz dzwonieniem lub brzęczeniem w jednym uchu lub obu
uszach), czerwonawe, niewyniesione, tarczowate lub okrągłe plamy na tułowiu, często z pęcherzami
pośrodku, łuszczenie się skóry, owrzodzenia jamy ustnej, gardła, nosa, narządów płciowych i oczu - te
ciężkie wysypki skórne mogą być poprzedzone gorączką i objawami grypopodobnymi (zespół
Stevensa-Johnsona, toksyczna martwica rozpływna naskórka), zaczerwienienie skóry i swędząca
wysypka (toksyczne wykwity skórne), reakcja skórna powodująca wystąpienie czerwonych punktów
lub plam na skórze, które mogą wyglądać jak tarcza strzelnicza z ciemnoczerwonym środkiem
otoczonym jaśniejszymi czerwonymi pierścieniami (rumień wielopostaciowy)
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie możliwe objawy niepożądane
niewymienione w ulotce, należy zwrócić się do lekarza lub farmaceuty. Działania niepożądane można
zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49
21 309, strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi
podmiotu odpowiedzialnego w Polsce.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Lutrate Depot
Lekarz i farmaceuta są poinformowani, jak przechowywać ten lek.
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie przechowywać w temperaturze powyżej 25 C. Nie zamrażać.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku, fiolce i ampułko-
strzykawce po „EXP”. Termin ważności na ampułko-strzykawce jest taki sam jak na fiolce. Termin
ważności oznacza ostatni dzień podanego miesiąca.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Lutrate Depot
Substancją czynną leku jest leuproreliny octan. Każda fiolka zawiera 22,5 mg leuproreliny octanu.
Stężenie odtworzonego leku wynosi 11,25 mg/ml.
Pozostałe składniki to:
proszek (fiolka): poli(kwas mlekowy) (PLA), trietylu cytrynian, mannitol, karmeloza sodowa,
polisorbat 80
rozpuszczalnik (w ampułko-strzykawce): mannitol, kwas solny (do ustalenia pH), sodu wodorotlenek
(do ustalenia pH), woda do wstrzykiwań
Jak wygląda lek Lutrate Depot i co zawiera opakowanie
Każde opakowanie zawiera fiolkę zawierającą 22,5 mg leuproreliny octanu, 1 ampułko-strzykawkę
zawierającą 2 ml rozpuszczalnika, 1 element łącznikowy i jedną jałową igłę o średnicy 20 G.
Podmiot odpowiedzialny
+pharma arzneimittel gmbh
Hafnerstrasse 211
8054 Graz
Austria
Wytwórca
GP-Pharm S.A.
Poligono Industrial Els Vinyets - Els Fogars, Sector 2
Carretera Comarcal C -244, Km. 22
08777 Sant Quintí de Mediona (Barcelona)
Hiszpania
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
Austria
Lutrate Depot 22.5 mg Pulver und Lösungsmittel zur Herstellung einer Depot-
Injektionssuspension
Bułgaria
Лутрат Депо 22,5 mg прах и разтворител за инжекционна суспензия с
удължено освобождаване
Czechy
Lutrate Depot 22.5 mg
Grecja
Lutrate Depot 22.5 mg Κόνις και διαλύτης για παρασκευή ενεσίμου
εναιωρήματος παρατεταμένης αποδέσμευσης
Hiszpania
Leuprorelina GP-Pharm Depot Trimestral 22.5 mg polvo y disolvente para
suspensión de liberación prolongada inyectable
Niemcy
Lutrate Depot 22.5 mg Pulver und Lösungsmittel zur Herstellung einer Depot-
Injektionssuspension
Polska
Lutrate Depot
Portugalia
Lutrate Depot 22.5 mg / 2 ml pó e veículo para suspensão injectável de
libertação prolongada
Węgry
Politrate Depot 22.5 mg
Włochy
Politrate
W celu uzyskania bardziej szczegółowych informacji na temat tego leku należy zwrócić się
do przedstawiciela podmiotu odpowiedzialnego w Polsce:
+pharma Polska sp. z o.o.
ul. Podgórska 34
31-536 Kraków, Polska
tel.: +48 12 262 32 36
e-mail: [email protected]
Data ostatniej aktualizacji ulotki:maj 2025
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego
Przygotowanie leku do wstrzyknięcia
WAŻNE: Przeczytać uważnie przed podaniem produktu (“Instrukcja użycia” jest również
uwzględniona na tacce zawierającej składniki zestawu produktowego). Podczas procedury
przygotowywania leku należy stosować zasady aseptyki.
Używać wyłącznie substancji rozcieńczającej dołączonej do zestawu.
Po zmieszaniu należy go natychmiast wstrzyknąć w postaci pojedynczego zastrzyku domięśniowego.
Lek jest przeznaczony wyłącznie do podania jednorazowego. Wszelką pozostałą zawiesinę należy
zutylizować.
Należy sprawdzić zawartość zestawu i upewnić się, że zawiera wszystkie części wymienione w ulotce.
Opakowanie zawiera:
- 1 (jedną) fiolkę leku Lutrate Depot zawierającą 22,5 mg leuproreliny octanu w postaci proszku do sporządzania zawiesiny do wstrzykiwań
- 1 (jedną) ampułko-strzykawkę zawierającą rozpuszczalnik do sporządzenia zawiesiny (0,8% roztwór mannitolu do wstrzykiwań)
- 1 (jeden) element łącznikowy potrzebny do odtworzenia leku łącznie z 1 (jedną) jałową igłą jednorazowego użytku.
1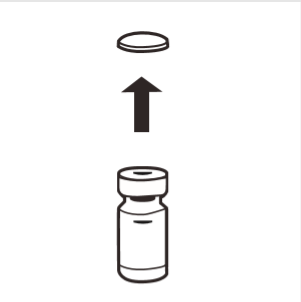 | Całkowicie usunąć zrywalne wieczko z górnej części fiolki odsłaniając gumowy korek. Upewnić się, że żadne części zrywalnego wieczka nie pozostały na fiolce. |
2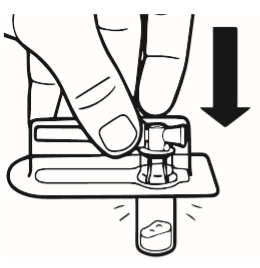 | Umieścić fiolkę na stole, w pozycji pionowej. Oderwać osłonkę z blistra zawierającego łącznik fiolki (MIXJECT). Nie wyjmować łącznika fiolki z blistra. Umieścić blister z łącznikiem fiolki mocno na górnej części fiolki, przekłuwając fiolkę znajdującą się w całkowicie pionowej pozycji. Delikatnie docisnąć, aż poczuje się, że łącznik wskoczył na swoje miejsce. |
3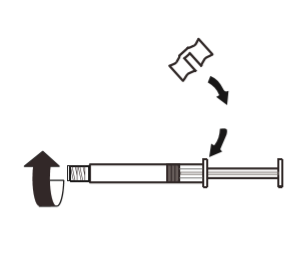 | Przymocować biały uchwyt do strzykawki tak, aby go zatrzasnąć. Odkręcić gumową nasadkę strzykawki w kierunku przeciwnym do ruchu wskazówek zegara. Następnie zdjąć opakowanie blistrowe z systemu MIXJECT. |
4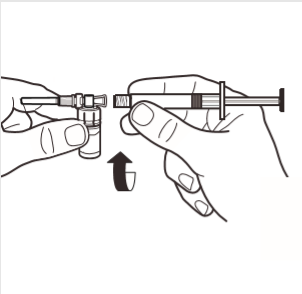 | Podłączyć strzykawkę do adaptera ampułki wkręcając ją zgodnie z ruchem wskazówek zegara w otwór z boku adaptera. Ostrożnie dokręcać strzykawkę do momentu w którym przestanie się obracać, aby zapewnić szczelne połączenie. |
5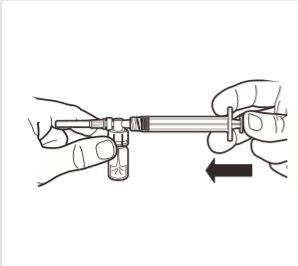 | Utrzymując strzykawkę i ampułkę w pozycji pionowej powoli naciskać tłok, aby przenieść całość substancji rozcieńczającej do ampułki. |
6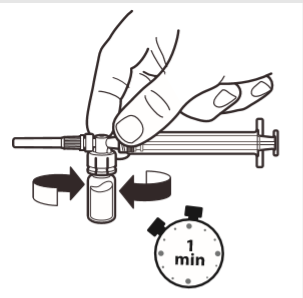 | Gdy strzykawka wciąż jest połączona z ampułką delikatnie wstrząsać ampułką przez około jedną minutę aż do uzyskania jednolitej mlecznobiałej zawiesiny. Aby uniknąć rozdzielenia zawiesiny należy niezwłocznie przejść do następnych kroków. |
7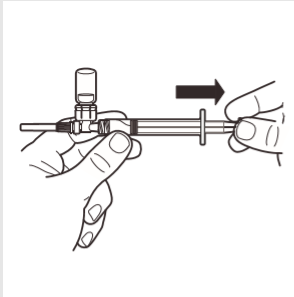 | Odwrócić system MIXJECT tak, aby ampułka znajdowała się na górze. Mocno chwycić system MIXJECT za strzykawkę i powoli odciągać tłok, aby wprowadzić przygotowany produkt do strzykawki. Część produktu może ulec zbryleniu lub przykleić się do ścianek ampułki. Jest to normalne zjawisko. |
8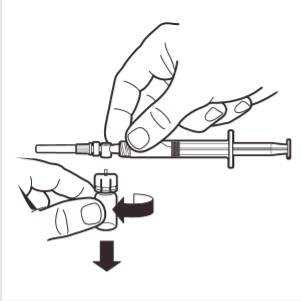 | Odłączyć adapter ampułki od systemu MIXJECT połączonego ze strzykawką: mocno chwycić strzykawkę i obrócić ampułkę (trzymając za plastikową nasadkę adaptera) w kierunku zgodnym z ruchem wskazówek zegara. |
9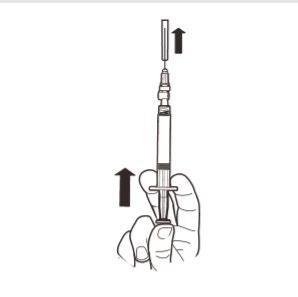 | Trzymać strzykawkę PIONOWO. Drugą ręką pociągnąć nasadkę igły do góry. Nacisnąć tłok tak, aby usunąć powietrze ze strzykawki. Strzykawka zawierająca produkt jest gotowa do natychmiastowego podania. |
10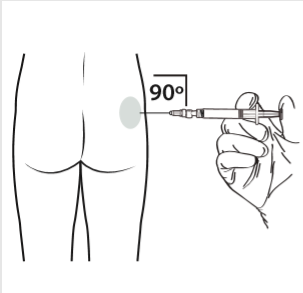 | Wykonać zastrzyk domięśniowy wprowadzając igłę pod kątem 90 stopni w okolice pośladka. Upewnić się, że wstrzyknięta została cała ilość produktu. Miejsca wstrzyknięcia powinny być zmieniane. |
Instrukcja użycia
Lutrate ® Depot - instrukcja użycia
Przeczytać uważnie przed podaniem produktu.
Przygotować do użycia bezpośrednio przed podaniem w postaci pojedynczego zastrzyku
domięśniowego.
Używać wyłącznie substancji rozcieńczającej dołączonej do zestawu.
Produkt jest przeznaczony do jednorazowego wstrzyknięcia.
Wszelką pozostałą zawiesinę należy zutylizować.
1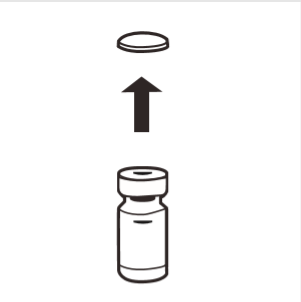 | Całkowicie usunąć zrywalne wieczko z górnej części fiolki odsłaniając gumowy korek. Upewnić się, że żadne części zrywalnego wieczka nie pozostały na fiolce. |
2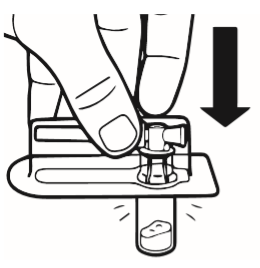 | Umieścić fiolkę na stole, w pozycji pionowej. Oderwać osłonkę z blistra zawierającego łącznik fiolki (MIXJECT). Nie wyjmować łącznika fiolki z blistra. Umieścić blister z łącznikiem fiolki mocno na górnej części fiolki, przekłuwając fiolkę znajdującą się w całkowicie pionowej pozycji. Delikatnie docisnąć, aż poczuje się, że łącznik wskoczył na swoje miejsce. |
3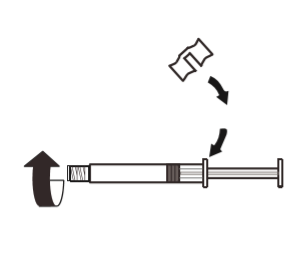 | Przymocować biały uchwyt do strzykawki tak, aby go zatrzasnąć. Odkręcić gumową nasadkę strzykawki w kierunku przeciwnym do ruchu wskazówek zegara. Następnie zdjąć opakowanie blistrowe z systemu MIXJECT. |
4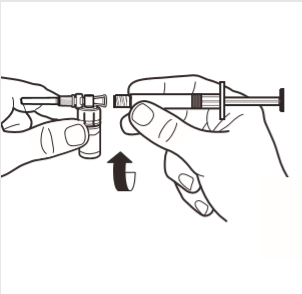 | Podłączyć strzykawkę do adaptera ampułki wkręcając ją zgodnie z ruchem wskazówek zegara w otwór z boku adaptera. Ostrożnie dokręcać strzykawkę do momentu w którym przestanie się obracać, aby zapewnić szczelne połączenie. |
5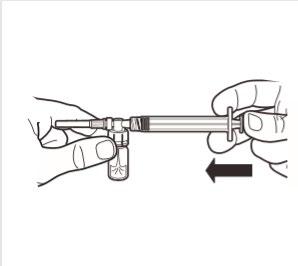 | Utrzymując strzykawkę i ampułkę w pozycji pionowej powoli naciskać tłok, aby przenieść całość substancji rozcieńczającej do ampułki. |
6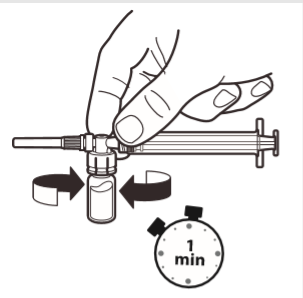 | Gdy strzykawka wciąż jest połączona z ampułką delikatnie wstrząsać ampułką przez około jedną minutę aż do uzyskania jednolitej mlecznobiałej zawiesiny. Aby uniknąć rozdzielenia zawiesiny należy niezwłocznie przejść do następnych kroków. |
7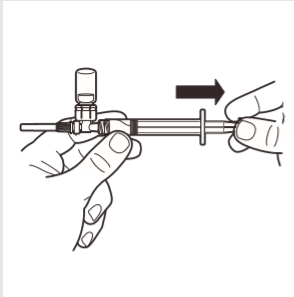 | Odwrócić system MIXJECT tak, aby ampułka znajdowała się na górze. Mocno chwycić system MIXJECT za strzykawkę i powoli odciągać tłok, aby wprowadzić przygotowany produkt do strzykawki. Część produktu może ulec zbryleniu lub przykleić się do ścianek ampułki. Jest to normalne zjawisko. |
8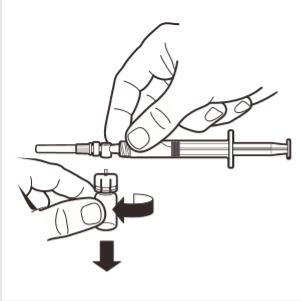 | Odłączyć adapter ampułki od systemu MIXJECT połączonego ze strzykawką: mocno chwycić strzykawkę i obrócić ampułkę (trzymając za plastikową nasadkę adaptera) w kierunku zgodnym z ruchem wskazówek zegara. |
9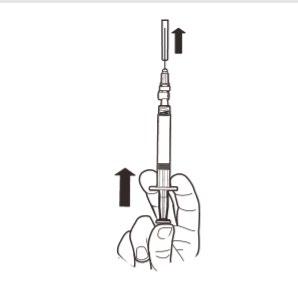 | Trzymać strzykawkę PIONOWO. Drugą ręką pociągnąć nasadkę igły do góry. Nacisnąć tłok tak, aby usunąć powietrze ze strzykawki. Strzykawka zawierająca produkt jest gotowa do natychmiastowego podania. |
10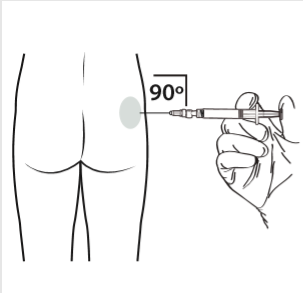 | Wykonać zastrzyk domięśniowy wprowadzając igłę pod kątem 90 stopni w okolice pośladka. Upewnić się, że wstrzyknięta została cała ilość produktu. Miejsca wstrzyknięcia powinny być zmieniane. |
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- ImporterGP-PHARM S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Lutrate DepotPostać farmaceutyczna: Proszek, 22,5 mgSubstancja czynna: leuprorelinWymaga receptyPostać farmaceutyczna: Proszek, 45 mgSubstancja czynna: leuprorelinWymaga receptyPostać farmaceutyczna: Proszek, 7,5 mgSubstancja czynna: leuprorelinWymaga recepty
Odpowiedniki Lutrate Depot w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Lutrate Depot – Hiszpania
Odpowiednik Lutrate Depot – Ukraina
Lekarze online w sprawie Lutrate Depot
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Lutrate Depot – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.











