
Librexa
Zapytaj lekarza o receptę na Librexa

Jak stosować Librexa
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla pacjenta
LIBREXA, 11,25 mg, implant w ampułko-strzykawce
Leuprorelinum
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty lub pielęgniarki.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek LIBREXA i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku LIBREXA
- 3. Jak stosować lek LIBREXA
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek LIBREXA
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek LIBREXA i w jakim celu się go stosuje
Substancja czynna leku LIBREXA (octan leuproreliny) należy do grupy leków zmniejszających
poziom niektórych hormonów płciowych.
LIBREXA działa na przysadkę mózgową, pobudzając na krótko, a następnie hamując wytwarzanie
hormonów, które regulują powstawanie męskich hormonów płciowych w jądrach.
Oznacza to, że stężenie hormonów płciowych zmniejsza się i podczas leczenia utrzymuje na tym
samym poziomie. Po przerwaniu stosowania leku LIBREXA stężenia hormonów wydzielanych przez
przysadkę oraz hormonów płciowych powracają do wartości prawidłowych.
Lek LIBREXA jest stosowany u mężczyzn:
- w objawowym leczeniu zaawansowanego raka gruczołu krokowego, zależnego od działania hormonów (rak prostaty);
- jako leczenie uzupełniające w trakcie i po radioterapii, w leczeniu miejscowo zaawansowanego, hormonozależnego raka gruczołu krokowego.
2. Informacje ważne przed zastosowaniem leku LIBREXA
Kiedy nie stosować leku LIBREXA:
- jeśli pacjent ma uczulenie na leuprorelinę lub na którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6);
- jeśli rozpoznany u pacjenta rak nie jest zależny od działania hormonów;
- produkt leczniczy nie jest wskazany do stosowania u kobiet, a w szczególności w ciąży i karmiących piersią.
Ostrzeżenia i środki ostrożności
W związku ze stosowaniem leuproreliny zgłaszano ciężkie wysypki skórne, w tym zespół
StevensaJohnsona i toksyczną nekrolizę naskórka (SJS/TEN). W przypadku zauważenia
któregokolwiek z objawów związanych z poważnymi reakcjami skórnymi opisanymi w punkcie 4
stosowanie leuproreliny należy przerwać i natychmiast skontaktować się z lekarzem.
Przed rozpoczęciem stosowania leku LIBREXA należy omówić to z lekarzem:
- jeśli u pacjenta stwierdzono wysokie ciśnienie tętnicze krwi. W takim wypadku lekarz będzie kontrolował uważnie stan pacjenta.
- jeśli pacjent ma stłuszczoną wątrobę
Istnieją doniesienia o występowaniu depresji u pacjentów przyjmujących leuprorelinę. Jeśli
w trakcie przyjmowania leku LIBREXA wystąpią nastroje depresyjne, należy poinformować o
tym lekarza.
jeśli występuje którykolwiek z następujących przypadków: jakiekolwiek choroby serca lub
naczyń krwionośnych, w tym zaburzenia rytmu serca (arytmia) lub pacjent stosuje leki na te
choroby, należy poinformować o tym lekarza. Ryzyko zaburzeń rytmu serca może się
zwiększyć podczas stosowania leku LIBREXA.
jeśli pacjent przebył zabieg usunięcia obu jąder. W takim wypadku lek LIBREXA nie
powoduje dalszego zmniejszenia stężenia męskiego hormonu płciowego we krwi.
jeśli jeszcze przed rozpoczęciem leczenia pacjent ma objawy neurologiczne (ucisk na rdzeń
kręgowy, przerzuty do kręgosłupa) lub odczuwa dyskomfort podczas oddawania moczu na
skutek zmian w drogach moczowych. Należy niezwłocznie powiedzieć o tym lekarzowi, który
będzie uważnie kontrolował stan pacjenta w pierwszych tygodniach leczenia w warunkach
szpitalnych, jeśli to możliwe.
jeśli objawy choroby nawracają (tj. ból, trudności w oddawaniu moczu lub osłabienie mięśni
nóg podczas długotrwałego stosowania leku LIBREXA). W takim wypadku lekarz będzie
regularnie sprawdzał skuteczność leczenia wykonując odpowiednie badania (badanie
palpacyjne gruczołu krokowego przez odbyt, badania obrazowe) i kontrolując wskaźniki we
krwi (aktywność fosfataz i stężenie swoistego antygenu sterczowego (PSA) oraz stężenie
męskiego hormonu płciowego (testosteronu).
jeśli u pacjenta istnieje zwiększone ryzyko zmniejszenia masy kostnej (osteoporoza).
jeśli pacjent choruje na cukrzycę. W takim wypadku lekarz będzie bardzo uważnie
kontrolował stan pacjenta.
jeśli u pacjenta występują silne lub nawracające bóle głowy, trudności z związane widzeniem
i dzwonienie lub brzęczenie w uszach, należy niezwłocznie zwrócić się do lekarza.
Skutki niewłaściwego użycia w celach dopingowych
Zastosowanie leku LIBREXA może dać pozytywne wyniki w testach antydopingowych.
LIBREXA a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować.
Lek LIBREXA może oddziaływać z niektórymi lekami stosowanymi w leczeniu zaburzeń rytmu serca
(takimi jak chinidyna, prokainamid, amiodaron i sotalol) lub zwiększać ryzyko zaburzeń rytmu serca,
gdy stosowany jest jednocześnie z niektórymi innymi lekami, tj. metadon (stosowany jako lek
przeciwbólowy i w ramach detoksykacji osób uzależnionych od narkotyków), moksyfloksacyna
(antybiotyk), leki przeciwpsychotyczne (stosowane w leczeniu ciężkich zaburzeń psychicznych).
Ciąża, karmienie piersią i wpływ na płodność
Lek LIBREXA nie jest wskazany do stosowania u kobiet i nie należy stosować go u kobiet w ciąży i
karmiących piersią (patrz punkt 2 „Kiedy nie stosować leku LIBREXA”).
Prowadzenie pojazdów i obsługiwanie maszyn
Zmęczenie jest częstym działaniem niepożądanym, które pojawia się zwłaszcza na początku leczenia
i może być również związane z chorobą nowotworową. Do czasu uzyskania dodatkowych informacji
należy zatem rozważyć następujące środki ostrożności: Lek, nawet stosowany zgodnie z zaleceniami,
może zmieniać reakcje pacjenta w sposób zaburzający zdolność prowadzenia pojazdów lub
obsługiwania maszyn. Dotyczy to w większym stopniu sytuacji, gdy podczas stosowania leku
spożywa się alkohol.
3. Jak stosować lek LIBREXA
Lek LIBREXA powinien być podawany wyłącznie przez lekarza lub pielęgniarkę.
Zalecana dawka to:
Lek LIBREXA wstrzykuje się pod skórę brzucha raz na trzy miesiące.
Leczenie zaawansowanych, hormonozależnych nowotworów prostaty za pomocą leku LIBREXA jest
zwykle długotrwałym leczeniem.
Lek LIBREXA nie może być podany dotętniczo (do naczyń krwionośnych przenoszących krew bogatą
w tlen).
Nie należy przerywać leczenia bez uprzedniej konsultacji z lekarzem.
Zastosowanie większej niż zalecana dawki leku LIBREXA
Lek jest podawany przez lekarza, nie wydaje się zatem prawdopodobne podanie większej dawki leku.
Nawet w przypadku zastosowania dawki 20 mg octanu leuproreliny dziennie przez dwa lata nie
stwierdzono objawów zatrucia.
W razie jakichkolwiek wątpliwości związanych ze stosowaniem tego leku, należy zwrócić się do
lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych):
Jeśli zauważysz którykolwiek z poniższych objawów, natychmiast skontaktuj się z lekarzem:
- Czerwonawe, niewyniesione, tarczowate lub okrągłe plamy na tułowiu, często z pęcherzami pośrodku, łuszczenie się skóry, owrzodzenia jamy ustnej, gardła, nosa, narządów płciowych i oczu. Te ciężkie wysypki skórne mogą być poprzedzone gorączką i objawami grypopodobnymi (zespół Stevensa-Johnsona, toksyczna martwica rozpływna naskórka)
- Zaczerwienienie skóry i swędząca wysypka (toksyczne wykwity skórne)
- Reakcja skórna powodująca wystąpienie czerwonych punktów lub plam na skórze, które mogą wyglądać jak tarcza strzelnicza z ciemnoczerwonym środkiem otoczonym jaśniejszymi czerwonymi pierścieniami (rumień wielopostaciowy)
Inne działania niepożądane
Początkowo u pacjentów zwykle obserwuje się zwiększenie poziomu męskiego hormonu płciowego
(testosteronu) we krwi, co może spowodować przemijające nasilenie objawów związanych z chorobą,
takich jak:
wystąpienie lub nasilenie bólu kości
trudności w oddawaniu moczu na skutek zwężenia dróg moczowych
ucisk na rdzeń kręgowy
osłabienie mięśni nóg
obrzęk tkanek w wyniku zastoju płynu (chłonki), tzw. obrzęk limfatyczny
Nasilenie tych objawów zazwyczaj ustępuje samoistnie bez konieczności przerwania stosowania leku
LIBREXA.
Na początku terapii lekarz może zalecić przyjmowanie odpowiedniego antagonisty hormonów
płciowych (tzw. antyandrogenu) w celu złagodzenia możliwych zaburzeń związanych z początkowym
zwiększeniem stężenia męskiego hormonu płciowego.
W trakcie leczenia stężenie testosteronu zmniejsza się do bardzo małych wartości. W wyniku tego u
niektórych pacjentów występują następujące działania niepożądane:
Bardzo często(mogą występować częściej niż u 1 na 10 osób):
- Uderzenia gorąca
- Osłabienie lub utrata popędu płciowego i potencji
- Zmniejszenie wielkości jąder
- Ból kości
- Nadmierna potliwość
- Reakcje w miejscu wstrzyknięcia, takie jak zaczerwienienie, ból, obrzęk, świąd, które zwykle ustępowały w trakcie leczenia
- Zwiększenie masy ciała
Często(mogą występować rzadziej niż u 1 na 10 osób):
- Powiększenie piersi u mężczyzn
- Zwiększenie apetytu
- Zmniejszenie apetytu
- Wahania nastroju
- Depresja
- Zaburzenia snu
- Ból głowy
- Nietypowe odczucia (parestezje) / drętwienia
- Nudności, wymioty
- Ból stawów i ( lub) pleców
- Osłabienie mięśni
- Zwiększenie częstości oddawania moczu w nocy
- Problemy z oddawaniem moczu
- Częsta potrzeba oddwania małej ilości moczu
- Zmęczenie
- Nagromadzenie wody w tkankach (obrzęk)
- Utrata masy ciała
- Zwiększenie aktywności enzymów wątrobowych (AlAT, AspAT, gamma-GT) i innych enzymów (LDH, fosfatazy zasadowej), które mogą być również związane z chorobą.
Niezbyt często(mogą występować rzadziej niż u 1 na 100 osób):
- Uogólnione reakcje alergiczne (gorączka, świąd, zwiększenie liczby pewnych krwinek białych [eozynofilia], wysypka skórna)
- Biegunka
- Suchość skóry i ( lub) błon śluzowych
- Nasilone pocenie się w nocy
- Niemożność całkowitego opróżnienia pęcherza moczowego
- Ból jąder
Rzadko(mogą występować rzadziej niż u 1 na 1000 osób):
- Zmniejszenie lub zwiększenie poziomu cukru we krwi
- Zawroty głowy
- Przemijające zaburzenia smaku
- Zmiany ciśnienia krwi (obniżenie lub zwiększenie ciśnienia krwi)
- Wypadanie włosów
Bardzo rzadko(mogą występować rzadziej niż u 1 na 10 000 osób):
- Ciężkie reakcje nadwrażliwości (reakcje anafilaktyczne)
Należy natychmiast skontaktować się z lekarzem, w przypadku wystąpienia któregokolwiek
z poniższych objawów ciężkiej reakcji nadwrażliwości, która może bardzo rzadko wystąpić
w przypadku stosowania leku LIBREXA i wymaga natychmiastowej pomocy medycznej:
zaczerwienienia z obrzękiem skóry i błon śluzowych, trudności w oddychaniu z powodu
zwężenia dróg oddechowych, spadek ciśnienia krwi, przyspieszone bicia serca, drgawki,
w ciężkich przypadkach: zagrażająca życiu niewydolność krążenia.
- Tak, jak w przypadku innych leków z tej grupy: zawał przysadki mózgowej po pierwszym podaniu leku u pacjentów z gruczolakiem przysadki .
Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych):
- Zapalenie płuc, choroby płuc
- Zmiany w EKG (wydłużenie odstępu QT)
- Drgawki
- Idiopatyczne nadciśnienie wewnątrzczaszkowe (zwiększone ciśnienie wewnątrzczaszkowe wokół mózgu, charakteryzujące się bólem głowy, podwójnym widzeniem i innymi objawami dotyczącymi widzenia oraz dzwonieniem lub brzęczeniem w jednym uchu lub obu uszach)
Szczególne informacje:
Odpowiedź na leczenie produktem LIBREXA powinna być kontrolowana poprzez oznaczenie we krwi
stężenia męskiego hormonu płciowego (testosteronu) po 28 dniach po każdym wstrzyknięciu i przed
każdym ponownym podaniem leku LIBREXA oraz dodatkowo na podstawie innych badań
laboratoryjnych, takich jak pomiar aktywności fosfatazy kwaśnej i stężenia PSA. Dla przykładu,
w początkowej fazie leczenia stężenie testosteronu najpierw zwiększa się, po czym zmniejsza w czasie
2 tygodni. Po upływie 2 do 4 tygodni stężenia testosteronu są porównywalne do obserwowanych po
obustronnym usunięciu jąder i pozostają stałe przez cały okres leczenia.
W początkowej fazie leczenia może wystąpić przemijające zwiększenie aktywności fosfatazy kwaśnej
(stwierdzone w badaniu laboratoryjnym). Powrót do fizjologicznych lub prawie fizjologicznych
wartości następuje po kilku tygodniach.
Zmniejszenie stężenia hormonu płciowego (testosteronu), jakie ma miejsce po usunięciu jąder lub
w wyniku stosowania leków hamujących hormony płciowe (takich jak LIBREXA) może spowodować
zmniejszenie gęstości kości z większym ryzykiem wystąpienia złamań (patrz punkt 2 „Ostrzeżenia i
środki ostrożności”). Zmniejszenie gęstości kości jest bardziej zauważalne po usunięciu jąder niż po
podaniu leku LIBREXA.
Ropień w miejscu wstrzyknięcia jest rzadkim powikłaniem. Odnotowano przypadek wystąpienia
ropnia w miejscu wstrzyknięcia, który był związany ze zmniejszonym wchłanianiem się leuproreliny.
W takich przypadkach zaleca się oznaczenie poziomu testosteronu.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych:
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek LIBREXA
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku kartonowym
i jałowej torebce po EXP.
Ampułko-strzykawkę należy zużyć natychmiast po wyjęciu z jałowej torebki.
Nie przechowywać w temperaturze powyżej 30°C.
Przechowywać ampułko-strzykawkę w zamkniętym oryginalnym opakowaniu w celu ochrony przed
wilgocią.
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek LIBREXA:
Substancją czynną leku jest leuproreliny octan.
1 implant zawiera: 10,72 mg leuproreliny ( Leuprorelinum), co odpowiada 11,25 mg leuproreliny
octanu
Pozostałe składniki to: kopolimer DL-laktydu i glikolidu (1:1) i polimer DL-laktydu.
Jak wygląda lek LIBREXA i co zawiera opakowanie
Ampułko-strzykawka z polimeru MMBS (Methyl Methacrylate Butadiene Styrene), z tłokiem i igłą ze
stali nierdzewnej, umieszczona w torebce z folii PETP/Aluminium/PE, zawierającej środek
pochłaniający wilgoć, w tekturowym pudełku.
Opakowanie zawiera:
1 ampułko-strzykawka z 1 implantem do wstrzyknięcia podskórnego.
Podmiot odpowiedzialny
Przedsiębiorstwo Farmaceutyczne LEK-AM Sp. z o.o.
ul. Ostrzykowizna 14A
05-170 Zakroczym
Polska
Wytwórca
AMW GmbH
Birkerfeld 11
83627 Warngau,
Niemcy
Data ostatniej aktualizacji ulotki: 31.12.2024
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Instrukcja użycia
Obraz 1
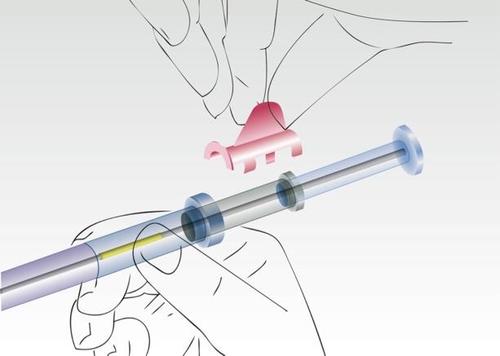
Wyjąć aplikator ze sterylnego opakowania
Sprawdzić, czy wewnątrz widoczny implant znajduje się we właściwej pozycji w aplikatorze
Usunąć pierścień zabezpieczający.
Obraz 2
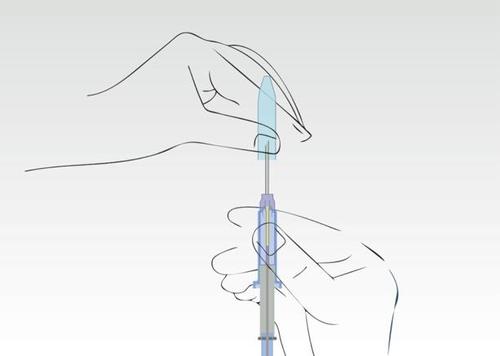
Ująć aplikator, znajdujący się na cylindrze strzykawki i zdjąć nasadkę.
Obraz 3
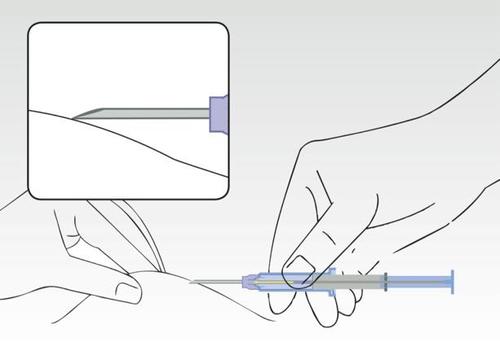
Jednocześnie ścisnąć skórę pacjenta i trzymając cylinder strzykawki, wsunąć igłę ukośnie (prawie
równolegle do skóry) z ostrzem igły skierowanym do góry.
Wprowadzić igłę do tkanki podskórnej (nie do mięśni lub do jamy brzusznej) przedniej ściany jamy
brzusznej pod linią pępkową, aż cylinder strzykawki dotknie skóry pacjenta.
Cylinder strzykawki musi pozostać w kontakcie ze skórą podczas całego procesu aplikacji!
Obraz 4
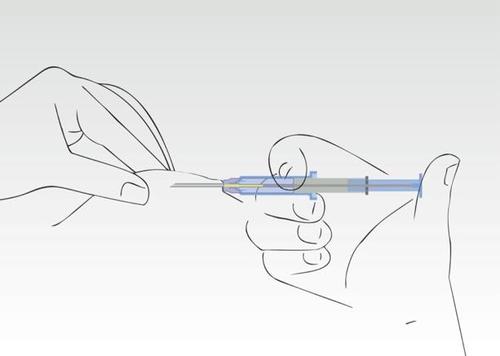
Nacisnąć tłok strzykawki. Implant przemieszcza się do końca igły.
Nie należy wyciągać strzykawki z powrotem. Podczas procesu aplikacji cylinder strzykawki musi
dotykać skóry pacjenta.
Obraz 5
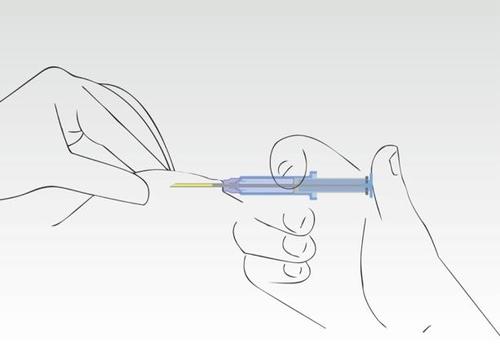
Gdy tłok jest wciśnięty, igła cofa się automatycznie.
Obraz 6
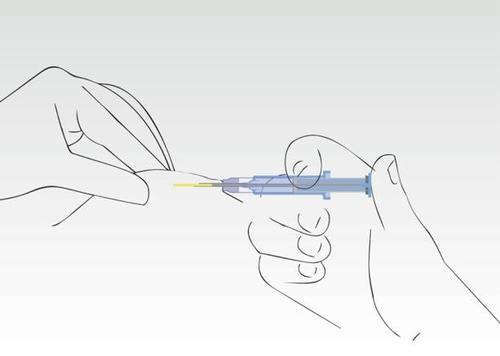
Igła wycofuje się z tkanki do cylindra strzykawki. Cylinder strzykawki musi pozostać w kontakcie
ze skórą pacjenta.Zazwyczaj wciśnięcie tłoka i cofanie się igły odbywa się jednym płynnym ruchem.
Obraz 7
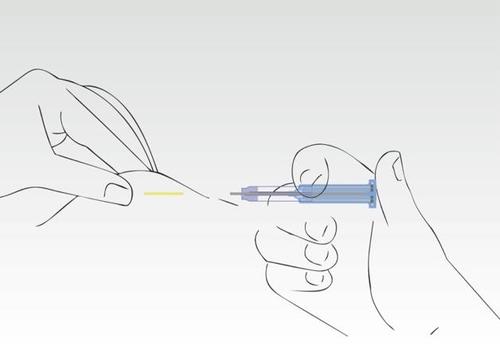
Proces aplikacji został zakończony. Igła została całkowicie wsunięta do cylindra strzykawki.
Trzon z supernatantem chroni przed urazami zakończeniem igły.
Obraz 8
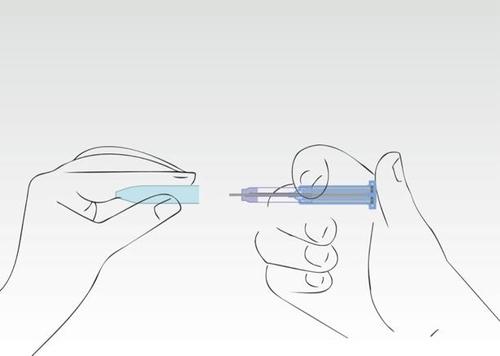
Ponownie nałożyć nasadkę.
Strzykawkę należy wyrzucić do wyznaczonego pojemnika.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterAMW GmbH
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki LibrexaPostać farmaceutyczna: Proszek, 22,5 mgSubstancja czynna: leuprorelinWymaga receptyPostać farmaceutyczna: Proszek, 45 mgSubstancja czynna: leuprorelinWymaga receptyPostać farmaceutyczna: Proszek, 7,5 mgSubstancja czynna: leuprorelinWymaga recepty
Odpowiedniki Librexa w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Librexa – Hiszpania
Odpowiednik Librexa – Ukraina
Lekarze online w sprawie Librexa
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Librexa – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.











