
IDELVION 3.500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar IDELVION 3.500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
IDELVION 250 UI, polvo y disolvente para solución inyectable
IDELVION 500 UI, polvo y disolvente para solución inyectable
IDELVION 1.000 UI, polvo y disolvente para solución inyectable
IDELVION 2.000 UI, polvo y disolvente para solución inyectable
IDELVION 3.500UI, polvo y disolvente para solución inyectable
albutrepenonacog alfa (factor de coagulación IX recombinante)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es IDELVION y para qué se utiliza
- Qué necesita saber antes de empezar a usar IDELVION
- Cómo usar IDELVION
- Posibles efectos adversos
- Conservación de IDELVION
- Contenido del envase e información adicional
1. Qué es IDELVION y para qué se utiliza
¿Qué es IDELVION?
IDELVION es un medicamento para el tratamiento de la hemofilia que reemplaza el factor IX natural de la coagulación. El principio activo de IDELVION es albutrepenonacog alfa (proteína de fusión recombinante que une el factor IX de coagulación con la albúmina [rIX-FP]).
El factor IX interviene en la coagulación sanguínea. Los pacientes con hemofilia B no tienen este factor, lo que significa que la sangre no se coagula tan rápidamente como debería, por lo que hay una mayor tendencia a sangrar. IDELVION actúa reemplazando al factor IX en los pacientes con hemofilia B para hacer que su sangre pueda coagularse.
¿Para qué se utiliza IDELVION?
IDELVION se utiliza para prevenir o detener el sangrado causado por la falta de suficiente factor IX en los pacientes de todas las edades con hemofilia B (también denominada deficiencia congénita de factor IXo enfermedad de Christmas).
2. Qué necesita saber antes de empezar a usar IDELVION
No use IDELVION
- si es alérgico al principio activo (albutrepenonacog alfa) o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a las proteinas de hamster.
Advertencias y precauciones
Se recomienda encarecidamente que cada vez que utilice IDELVION, registre el nombre y el número de lote del producto para realizar un seguimiento de los productos y los lotes del producto que ha utilizado.
Trazabilidad
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar IDELVION.
- Es posible que se produzcan reacciones alérgicas (hipersensibilidad). El producto contiene restos de proteínas de hámster (véase también "No use IDELVION"). Si se manifiestansíntomas de reacciones alérgicas, debe interrumpir el tratamiento inmediatamente y contactar con su médico o centro de tratamiento donde le realizan el seguimiento. Su médico debe informarle de los primeros signos de las reacciones de hipersensibilidad.Estos incluyen urticaria, erupción cutánea generalizada, presión en el pecho, dificultad para respirar, caída de la presión arterial (hipotensión) y anafilaxia (una reacción alérgica grave que causa dificultades respiratorias graves o mareos).
- Debido al riesgo de reacciones alérgicas con el factor IX, la administración inicial de IDELVION se debe realizar bajo supervisión médica para garantizar el acceso a una atención médica adecuada en caso de reacciones alérgicas.
- La formación de inhibidores(anticuerpos neutralizantes) es una complicación conocida de la cual se ha informado durante el tratamiento con IDELVION. Los inhibidores impiden que el tratamiento funcione correctamente. Si con IDELVION no se controlan sus hemorragias, informe a su médico inmediatamente. Debe ser controlado regularmente por si desarrolla inhibidores.
- Si usted sufre de enfermedad hepática o cardiaca o si ha tenido recientemente una cirugía mayor, por favor informe a su médico, ya que existe un mayor riesgo de complicaciones de coagulación de la sangre.
- Si para la administración de IDELVION se necesitara un dispositivo de acceso venoso central (DAVC), su médico tendrá en cuenta el riesgo de complicaciones relacionadas con el DAVC, como infecciones locales, bacterias en la sangre (bacteriemia) y la formación de un coágulo sanguíneo en los vasos sanguíneos (trombosis) en el lugar de inserción del catéter.
Uso de IDELVION con otros medicamentos
- Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
- Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
- Durante el embarazo y el periodo de lactancia, IDELVION solo se debe administrar si es claramente necesario.
Conducción y uso de máquinas
IDELVION no afecta a su capacidad para conducir o usar máquinas.
IDELVION contiene sodio
Este medicamento contiene hasta 8,6 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada vial. Esto equivale al 0,4% de la ingesta diaria máxima de sodio recomendada para un adulto.
3. Cómo usar IDELVION
Su tratamiento debe ser iniciado y supervisado por un médico con experiencia en el tratamiento de trastornos de coagulación de la sangre. Siga exactamente las indicaciones de su médico para el uso de este medicamento. Consulte con su médico si tiene dudas.
Su médico calculará la dosis de IDELVION que necesita. La cantidad de IDELVION que usted necesita y la duración del tratamiento dependen:
- de la gravedad de su enfermedad
- del lugar y de la intensidad de la hemorragia
- de su estado clínico y su respuesta clínica
- de su peso corporal
IDELVION se administra como una inyección en una vena (intravenosa, IV) después de la reconstitución del polvo con el disolvente proporcionado por su médico o enfermero. Usted u otra persona también podría administrar IDELVION como una inyección intravenosa, pero únicamente después de recibir la formación adecuada.
Si usa más IDELVION del que debe
Póngase en contacto inmediatamente con su médico si se inyecta más IDELVION del que le ha recomendado su médico.
Si interrumpe el tratamiento con IDELVION
No deje de usar IDELVION sin consultar antes con su médico.
Reconstitución y administración
Instrucciones generales
- El polvo se debe mezclar con el disolvente (líquido) y extraerse del vial manteniendo el medicamento estéril (libre de gérmenes). Su médico le mostrará cómo preparar la solución y cómo extraer la solución del vial correctamente.
- IDELVION no se debe mezclar con otros medicamentos, disolventes, excepto los mencionados en la sección 6.
- La solución debe ser transparente o ligeramente opalescente, entre amarilla e incolora, es decir, puede brillar cuando se expone a la luz pero no debe contener ninguna partícula visible. Después de extraer o filtrar la solución (véase más adelante) se debe revisar visualmente antes de su uso. No utilice la solución si está turbia o si contiene flóculos o partículas.
- La eliminación del producto no utilizado y de todos los materiales residuales se realizará de acuerdo con la normativa local y las indicaciones de su médico.
Reconstitución
Sin abrir ninguno de los viales, caliente el polvo de IDELVION y el líquido hasta que estén a temperatura ambiente o corporal. Esto se puede hacer dejando los viales a temperatura ambiente durante una hora aproximadamente o sujetándolos con las manos durante unos minutos.
NO exponga los viales al calor directo. Los viales no deben calentarse por encima de la temperatura corporal (37 ºC).
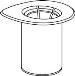
Retire con cuidado las cápsulas protectoras de los viales y, a continuación, limpie la parte al descubierto de los tapones de goma con una toallita impregnada de alcohol. Deje secar los viales antes de abrir el envase del Mix2Vial (el cual contiene el trasvasador con filtro) y, a continuación, siga las instrucciones que se indican a continuación.
|
|
|
|
|
|
|
|
|
Deseche el vial del disolvente con el adaptador del Mix2Vial azul acoplado. |
|
|
|
|
Trasvase y administración
|
|
9 |
|
Utilice el kit de venopunción suministrado con el producto e inserte la aguja en una vena. Deje que la sangre fluya hasta el final del tubo. Acople la jeringa al extremo de bloqueo roscado del kit de venopunción. Inyecte lentamente la solución reconstituida (a una velocidad que le resulteconfortable, hasta un máximo de 5 ml/min) en la venasegún las instrucciones que le haya dado su médico. Intente que no entre sangre en la jeringa que contiene el producto.
Compruebe si experimenta efectos adversos justo después de la inyección. Si experimenta algún efecto adverso que pueda estar relacionado con la administración de IDELVION, la inyección debe interrumpirse (ver también las secciones 2 y 4).
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Póngase en contacto con su médico:
- si nota síntomas de reacciones alérgicas (ver a continuación);
- si nota que el medicamento deja de funcionar correctamente.
Se han observado los siguientes efectos adversos con los medicamentos con factor IX:
- Es posible que se produzcan reacciones de hipersensibilidad de tipo alérgico (frecuente) que incluyan los síntomas siguientes: eritema, picores en la piel (urticaria generalizada), presión en el pecho, dificultad para respirar, presión sanguínea baja (hipotensión) y anafilaxia (una reacción grave que causa una grave dificultad para respirar y mareos). Si esto sucede, debe interrumpir la administración del medicamento inmediatamente y ponerse en contacto con su médico.
- Inhibidores: el medicamento deja de funcionar correctamente (sangrado continuo). Puede desarrollar un inhibidor (anticuerpo neutralizante) del factor IX (frecuencia desconocida), lo que implica que el factor IX ya no funcionará correctamente. Si esto sucede, debe interrumpir la administración del medicamento inmediatamente y ponerse en contacto con su médico.
Se han observado de manera frecuentelos siguientes efectos adversos con IDELVION (pueden afectar hasta 1 de cada 10 personas):
- Dolor de cabeza
- Reacciones en la zona de inyección
- Mareo
- Erupción cutánea
Se han observado los efectos adversos siguientes de manera poco frecuente(pueden afectar hasta 1 de cada 100 personas):
- Eccema
Efectos adversos en niños y adolescentes
Se espera que los efectos adversos en niños sean los mismos que en adultos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de IDELVION
- Mantener este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja.
- No conservar a temperatura superior a 25 ºC.
- No congelar.
- Conserve el vial dentro de su caja para protegerlo de la luz.
- Una vez reconstituido el producto se debe utilizar preferentemente de inmediato.
Si el producto reconstituido no se administra inmediatamente, los tiempos y las condiciones de conservación antes de su uso son responsabilidad del usuario.
6. Contenido del envase e información adicional
Composición de IDELVION
El principio activo es:
250 UI por vial; tras la reconstitución con 2,5 ml de agua para preparaciones inyectables, la solución contiene 100 UI/ml de albutrepenonacog alfa.
500 UI por vial; tras la reconstitución con 2,5 ml de agua para preparaciones inyectables, la solución contiene 200 UI/ml de albutrepenonacog alfa.
1.000 UI por vial; tras la reconstitución con 2,5 ml de agua para preparaciones inyectables, la solución contiene 400 UI/ml de albutrepenonacog alfa.
2.000 UI por vial; tras la reconstitución con 5 ml de agua para preparaciones inyectables, la solución contiene 400 UI/ml de albutrepenonacog alfa.
3.500 UI por vial; tras la reconstitución con 5 ml de agua para preparaciones inyectables, la solución contiene 700 UI/ml de albutrepenonacog alfa.
Los demás componentes son:
Citrato sódico, polisorbato 80, manitol, sacarosa y ácido clorhídrico (para el ajuste del pH).
Ver el último párrafo de la sección 2.
Disolvente: agua para preparaciones inyectables
Aspecto de IDELVION y contenido del envase
IDELVION se presenta como un polvo entre amarillo y blanco y se suministra con un disolvente en forma de agua para preparaciones inyectables.
La solución reconstituida debe ser transparente o ligeramente opalescente, entre amarilla e incolora, es decir, puede brillar cuando se expone a la luz pero no debe contener ninguna partícula visible.
Presentaciones
Un envase con 250, 500 o 1.000 UI que contiene:
1 vial con polvo
1 vial con 2,5 ml de agua para preparaciones inyectables
1 trasvasador con filtro 20/20
Equipo de administración (caja interior):
1 jeringa de 5 ml desechable
1 equipo de venopunción
2 toallitas impregnadas de alcohol
1 apósito no estéril
Un envase con 2.000 o 3.500 UI que contiene:
1 vial con polvo
1 vial con 5 ml de agua para preparaciones inyectables
1 trasvasador con filtro 20/20
Equipo de administración (caja interior):
1 jeringa de 10 ml desechable
1 equipo de venopunción
2 toallitas impregnadas de alcohol
1 apósito no estéril
Puede que solamente estén comercializados algunos tamaños de envase.
Titular de la autorización de comercialización y responsable de la fabricación
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien CSL Behring NV Tél/Tel: +32 15 28 89 20 | Lietuva CentralPharma Communications UAB Tel: +370 5 243 0444 |
| Luxembourg/Luxemburg CSL Behring NV Tél/Tel: +32 15 28 89 20 |
Ceská republika CSL Behring s.r.o. Tel: + 420 702 137 233 | Magyarország CSL Behring Kft. Tel.: +36 1 213 4290 |
Danmark CSL Behring AB Tlf: +46 8 544 966 70 | Malta AM Mangion Ltd. Tel: +356 2397 6333 |
Deutschland CSL Behring GmbH Tel: +49 6190 75 84810 | Nederland CSL Behring BV Tel: + 31 85 111 96 00 |
Eesti CentralPharma Communications OÜ Tel: +3726015540 | Norge CSL Behring AB Tlf: +46 8 544 966 70 |
Ελλáδα CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Österreich CSL Behring GmbH Tel: +43 1 80101 1040 |
España CSL Behring S.A. Tel: +34 933 67 1870 | Polska CSL Behring Sp.z o.o. Tel: +48 22 213 22 65 |
France CSL Behring S.A. Tél: + 33 –(0)-1 53 58 54 00 | Portugal CSL Behring Lda Tel: +351 21 782 62 30 |
Hrvatska Marti Farm d.o.o. Tel: +385 1 5588297 | România Prisum Healthcare S.R.L. Tel: +40 21 322 0171 |
Ireland CSL Behring GmbH Tel: +49 6190 75 84700 Ísland CSL Behring AB Sími: +46 8 544 966 70 | Slovenija Emmes Biopharma Global s.r.o. podružnica v Sloveniji Tel:+ 386 41 42 0002 Slovenská republika CSL Behring Slovakia s.r.o. Tel: +421 911 653 862 |
Italia CSL Behring S.p.A. Tel: +39 02 34964 200 | Suomi/Finland CSL Behring AB Puh/Tel: +46 8 544 966 70 |
Κúπρος CSL Behring ΕΠΕ Τηλ: +30 210 7255 660 | Sverige CSL Behring AB Tel: +46 8 544 966 70 |
Latvija CentralPharma Communications SIA Tel: +371 6 7450497 | |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu, y en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/).
---------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales del sector sanitario:
Posología
La dosis y la duración del tratamiento de sustitución dependen de la gravedad de la deficiencia de factor IX, de la localización y gravedad de la hemorragia y del estado clínico del paciente.
El número de unidades de factor IX administradas se expresa en Unidades Internacionales (UI), en relación con el estándar actual de la OMS para productos que contienen factor IX. La actividad plasmática del factor IX se expresa como un porcentaje (en relación con el plasma humano normal) o en Unidades Internacionales (en relación con un estándar internacional para el factor IX plasmático).
Una Unidad Internacional (UI) de actividad del factor IX equivale a la cantidad de factor IX presente en 1 ml de plasma humano normal.
Tratamiento a demanda
El cálculo de la dosis necesaria de factor IX se basa en el hallazgo empírico de que 1 UI de factor IX por kg de peso corporal aumenta la actividad del factor IX plasmático en 1,3 UI/dl de media (1,3% de la actividad normal) en pacientes ≥ 12 años y en 1,0 UI/dl (1,0% de la actividad normal) en pacientes < 12 años. La dosis necesaria se determina mediante la fórmula siguiente:
Dosis necesaria (UI) = peso corporal (kg) x aumento deseado del factor IX (% del nivel normal o UI/dl) x {recuperación recíproca observada (UI/kg por UI/dl)}
Aumento previsto del factor IX (UI/dl o % del nivel normal) = dosis (UI) x recuperación (UI/dl por UI/kg)/peso corporal (kg)
La dosis y la frecuencia de administración se establecerán siempre en función de la eficacia clínica observada en cada caso.
Pacientes < 12 años de edad
En caso de una recuperación incremental de 1 UI/dl por 1 UI/kg, la dosis se calcula de la manera siguiente:
Dosis necesaria (UI) = peso corporal (kg) x aumento deseado del factor IX (UI/dl) x 1 dl/kg
Ejemplo:
- Se requiere un nivel máximo del 50% del nivel normal en un paciente de 20 kg con hemofilia B grave. La dosis adecuada sería de 20 kg x 50 UI/dl x 1 dl/kg = 1.000 UI.
- Se debe esperar que una dosis de 1.000 UI de IDELVION, administrada a un paciente de 25 kg, cause un aumento máximo del factor IX tras la inyección de 1.000 UI/25 kg x 1,0 (UI/dl por UI/kg) = 40 UI/dl (40% del nivel normal).
Pacientes ≥ 12 años de edad
En caso de una recuperación incremental de 1,3 UI/dl por 1 UI/kg, la dosis se calcula de la manera siguiente:
Dosis necesaria (UI) = peso corporal (kg) x aumento deseado del factor IX (UI/dl) x 0,77 dl/kg
Ejemplo:
- Se requiere un nivel máximo del 50% del nivel normal en un paciente de 80 kg con hemofilia B grave. La dosis adecuada sería de 80 kg x 50 UI/dl x 0,77 dl/kg = 3.080 UI.
- Se debe esperar que una dosis de 2.000 UI de IDELVION, administrada a un paciente de 80 kg, cause un aumento máximo del factor IX tras la inyección de 2.000 UI x 1,3 (UI/dl por UI/kg)/80 kg = 32,5 UI/dl (32,5% del nivel normal).
En el caso de los acontecimientos hemorrágicos siguientes, la actividad del factor IX no debe ser inferior al nivel de actividad plasmática establecido (en % del nivel normal o en UI/dl) durante el período correspondiente. La tabla siguiente puede usarse como guía posológica en episodios hemorrágicos y cirugía:
Grado de hemorragia/ tipo de procedimiento quirúrgico | Nivel de factor IX requerido (% o UI/dl) | Frecuencia de dosificación (horas)/duración del tratamiento (días) |
Hemorragia Hemartrosis leve o moderada, sangrado muscular (excepto en el iliopsoas) o sangrado de la cavidad oral | 30-60 | Una dosis única debería ser suficiente en la mayoría de las hemorragias. Se debe administrar una dosis de mantenimiento al cabo de 24 - 72 horas si se observa evidencia adicional de hemorragia. |
Hemorragia mayor Hemorragias potencialmente mortales, sangrado muscular profundo, incluido el iliopsoas | 60-100 | Se debe repetir cada 24 - 72 horas durante la primera semana y después administrar una dosis de mantenimiento cada semana hasta que se detenga la hemorragia y cicatrice la herida. |
Cirugía menor Por ejemplo, (incluidas extracciones dentales no complicadas) | 50-80 (pre- y posoperatorio) | Una dosis única debería ser suficiente en la mayoría de las intervenciones menores. Si es necesario, se puede administrar una dosis de mantenimiento al cabo de 24 - 72 horas hasta que se detenga la hemorragia y cicatrice la herida. |
Cirugía mayor | 60-100 (pre- y posoperatorio) | Se debe repetir cada 24 - 72 horas durante la primera semana y después administrar una dosis de mantenimiento 1 - 2 veces a la semana hasta que se detenga la hemorragia y cicatrice la herida. |
Tratamiento profiláctico
Para la profilaxis a largo plazo para prevenir el sangrado en pacientes con hemofilia B grave, la dosis habitual es de 35 a 50 UI/kg una vez por semana. Pacientes bien controlados con un régimen de una vez por semana pueden tratarse con hasta 75 UI/kg cada 10 o 14 días. En pacientes > 18 años se puede considerar una mayor extensión del intervalo de tratamiento.
En algunos casos, especialmente en pacientes jóvenes, es posible que sea necesario acortar los intervalos de administración o usar dosis más elevadas.
Después de un episodio de sangrado durante la profilaxis, los pacientes deben mantener su régimen de profilaxis en la mayor medida posible, con la administración de 2 dosis de IDELVION con 24 horas de diferencia como mínimo, pero más tiempo cuando se considere apropiado para el paciente.
Población pediátrica
En el tratamiento profiláctico a largo plazo, la pauta de dosificación recomendada es de 35 a 50 UI/kg una vez por semana. Para los adolescentes de 12 años o más, las recomendaciones de dosis son las mismas que para los adultos (ver arriba).
Advertencias y precauciones especiales de empleo
Inhibidores
Tras el tratamiento repetido con productos con factor IX de coagulación humano, se debe realizar un seguimiento de los pacientes por si desarrollan anticuerpos neutralizantes (inhibidores) que se deban cuantificar en Unidades Bethesda (UB) mediante pruebas biológicas adecuadas.
En la bibliografía se han notificado casos que demuestran una correlación entre la aparición de un inhibidor del factor IX y reacciones alérgicas. Por lo tanto, los pacientes que experimentan reacciones alérgicas deben ser evaluados para detectar la presencia de un inhibidor. Se debe tener en cuenta que es posible que los pacientes con inhibidores del factor IX presenten un mayor riesgo de anafilaxia, con la posterior exposición al factor IX.
Supervisión del tratamiento
Durante el transcurso del tratamiento, se recomienda controlar adecuadamente los niveles de factor IX para determinar la dosis que se debe administrar y la frecuencia de las perfusiones. Las respuestas de los pacientes al factor IX pueden variar, lo cual demuestra que posee distintas semividas y recuperaciones. Puede que la dosis basada en el peso corporal se deba ajustar en pacientes con peso insuficiente o sobrepeso. En el caso especial de las intervenciones de cirugía mayor, es indispensable controlar con precisión el tratamiento de sustitución mediante pruebas de la coagulación (actividad del factor IX plasmático).
Al utilizar un ensayo de coagulación de una etapa basado en el tiempo de tromboplastina parcial activada (TTPa) in vitropara determinar la actividad del factor IX en las muestras de sangre de los pacientes, los resultados de la actividad del factor IX plasmático pueden verse significativamente afectados por reactivo de TTP y el estándar de referencia utilizados en el ensayo. Es probable que la medición realizada con un ensayo de coagulación de una etapa utilizando el reactivo de TTPa basado en caolín o el reactivo de TTPa con Actin FS dé como resultado una infraestimación del nivel de actividad. Esto resulta especialmente importante cuando se cambia el laboratorio o los reactivos que se utilizan en el ensayo.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a IDELVION 3.500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 1.000 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere recetaForma farmacéutica: INYECTABLE, 2.000 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere recetaForma farmacéutica: INYECTABLE, 250 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere receta
Médicos online para IDELVION 3.500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de IDELVION 3.500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes




 1
1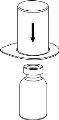 2
2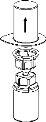 3
3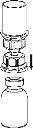 4
4 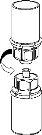 5
5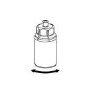 6
6 7
7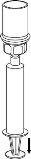 8
8











