
АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ

Запитайте лікаря про рецепт на АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ

Інструкція із застосування АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ
Введення
Особливості препарату: інформація для користувача
AFSTYLA 250 ОД, порошок і розчинник для ін'єкційного розчину
AFSTYLA 500 ОД, порошок і розчинник для ін'єкційного розчину
AFSTYLA 1.000 ОД, порошок і розчинник для ін'єкційного розчину
AFSTYLA 1.500 ОД, порошок і розчинник для ін'єкційного розчину
AFSTYLA 2.000 ОД, порошок і розчинник для ін'єкційного розчину
AFSTYLA 2.500 ОД, порошок і розчинник для ін'єкційного розчину
AFSTYLA 3.000 ОД, порошок і розчинник для ін'єкційного розчину
лONOCTOCOG альфа (рекомбінантний фактор згортання крові VIII одноланцюговий)
Прочитайте уважно весь листок перед тим, як ви або ваша дитина почне використовувати цей лікарський засіб, оскільки він містить важливу інформацію для вас.
- Збережіть цей листок, оскільки вам може знадобитися знову його прочитати.
- Якщо у вас є якісь питання, проконсультуйтеся з вашим лікарем, фармацевтом або медсестрою.
- Цей лікарський засіб призначений тільки вам або вашій дитині, і його не слід давати іншим людям, навіть якщо вони мають такі самі симптоми, як у вас, оскільки це може їм нашкодити.
- Якщо ви відчуваєте побічні ефекти, проконсультуйтеся з вашим лікарем, фармацевтом або медсестрою, навіть якщо це можливі побічні ефекти, які не вказані в цьому листку. Див. розділ 4.
Зміст листка:
- Що таке AFSTYLA і для чого він використовується
- Що потрібно знати перед тим, як ви або ваша дитина почне використовувати AFSTYLA
- Як використовувати AFSTYLA
- Можливі побічні ефекти
- Збереження AFSTYLA
- Зміст упаковки та додаткова інформація
1. Що таке AFSTYLA і для чого він використовується
AFSTYLA - це препарат з фактором згортання крові VIII людини, який виробляється за допомогою технології рекомбінантної ДНК. Активний інгредієнт AFSTYLA - лONOCTOCOG альфа.
AFSTYLA використовується для лікування та профілактики геморагічних епізодів у пацієнтів з гемофілією А (вродженою недостатністю фактору VIII). Фактор VIII - це білок, необхідний для згортання крові. У пацієнтів з гемофілією А відсутній цей фактор, тому кров не згортається так швидко, як повинно бути, і є більша схильність до кровотечі. AFSTYLA діє шляхом заміни відсутнього фактору VIII у пацієнтів з гемофілією А, що дозволяє крові згортатися нормально.
AFSTYLA можна використовувати у всіх вікових групах.
2. Що потрібно знати перед тим, як почати використовувати AFSTYLA
Не використовуйте AFSTYLA
- Якщо пацієнт AFSTYLA мав потенційно смертельну алергічну реакцію на AFSTYLA або будь-який з його компонентів (перелічених у розділі 6).
- Якщо пацієнт AFSTYLA алергічний на білки хом'яків.
Попередження та застереження
Відстежуваність
Важливо вести реєстр номера партії AFSTYLA.
Отже, кожен раз, коли ви використовуєте новий пакет AFSTYLA, запишіть дату та номер партії (який знаходиться на коробці після "Партія") і збережіть цю інформацію в безпеці.
Проконсультуйтеся з вашим лікарем, фармацевтом або медсестрою перед тим, як почати використовувати AFSTYLA.
- Можливі алергічні реакції (гіперчутливість). Препарат містить залишки білків хом'яків (див. також "Не використовуйте AFSTYLA"). Якщо з'являються симптоми алергії, припиніть лікування негайно і зверніться до вашого лікаря.Ваш лікар повинен повідомити вас про перші ознаки алергічних реакцій. До них належать кропив'янка, загальна висипка, тиснення на грудній клітці, труднощі з диханням, низький тиск і анафілаксія (важка алергічна реакція, яка викликає серйозні труднощі з диханням і головокружіння).
- Формування інгібіторів(антитіл) - це відома ускладнення, яке може виникнути під час лікування всіма препаратами, що містять фактор VIII. Ці інгібітори, особливо у великих кількостях, перешкоджають правильній дії лікування. Ви або ваша дитина будете піддаватися ретельному спостереженню на предмет розвитку інгібіторів. Якщо у вас або вашої дитини геморагія не контролюється AFSTYLA, зверніться до вашого лікаря негайно.
- Якщо вам сказали, що у вас або вашої дитини є захворювання серця або є ризик його розвитку, повідомте про це вашому лікареві або фармацевту.
- Якщо використовується пристрій центрального венозного доступу (ЦВД) для ін'єкції AFSTYLA, ваш лікар повинен розглянути та обговорити з вами ризик ускладнень, таких як місцеві інфекції, бактерії в крові (бактеріємія) та утворення згустків (тромбоз) у кровоносних судинах у місці введення.
Інші лікарські засоби та AFSTYLA
Повідомте вашому лікареві або фармацевту, якщо ви використовуєте, нещодавно використовували або можете використовувати будь-який інший лікарський засіб.
Вагітність та лактація
- Якщо ви вагітні або годуєте грудьми, вважаєте, що можете бути вагітною або плануєте вагітність, проконсультуйтеся з вашим лікарем або фармацевтом перед тим, як використовувати цей лікарський засіб.
- Під час вагітності та лактації AFSTYLA повинен застосовуватися тільки за явної необхідності.
Водіння транспортних засобів та використання машин
AFSTYLA не впливає на вашу здатність водити транспортні засоби або використовувати машини.
AFSTYLA містить натрій
Цей лікарський засіб містить 35 мг натрію (основного компонента кухонної солі) у кожній флаконі. Це відповідає 1,8% від максимальної добової норми споживання натрію, рекомендованої для дорослих.
3. Як використовувати AFSTYLA
Ваше лікування повинно перебувати під наглядом лікаря, який має досвід лікування порушень згортання крові.
Слідуйте точно інструкціям щодо застосування цього лікарського засобу, вказаним вашим лікарем. У разі сумнівів проконсультуйтеся з вашим лікарем знову.
Доза
Кількість AFSTYLA, яку вам або вашій дитині потрібно, і тривалість лікування залежать:
- від тяжкості вашого захворювання
- від місця та інтенсивності кровотечі
- від вашого клінічного стану та клінічної реакції
- від вашої ваги
Слідуйте інструкціям, вказаним вашим лікарем.
Перевірка та введення
Загальні інструкції
- Порошок повинен бути змішаний з розчинником (рідиною) та витягнутий з флакону в асептичних умовах.
- AFSTYLA не повинен бути змішаний з іншими лікарськими засобами або розчинниками, крім тих, що вказані у розділі 6.
- Розчин повинен бути прозорим або легенько опалесцентним, між жовтим та безколірним, тобто він може блищати при освітленні, але не повинен містити жодних видимих частинок. Після фільтрації або витягування розчину (див. нижче) його слід знову перевірити перед застосуванням. Не використовуйте розчин, якщо він є явно мутним або містить флокули чи частинки.
- Видалення невикористаного продукту та всіх залишкових матеріалів повинно здійснюватися згідно з місцевими правилами та інструкціями вашого лікаря.
Перевірка та введення
Не відкриваючи жодного з флаконів, переконайтесь, що порошок AFSTYLA та рідина мають кімнатну температуру або температуру тіла. Це можна зробити, залишивши флакони при кімнатній температурі протягом приблизно однієї години або тримаючи їх у руках протягом кількох хвилин. Не піддавайте флакони прямому теплу. Флакони не повинні нагріватися вище температури тіла (37 °C).
Акуратно зніміть захисні ковпачки з флаконів, а потім очистіть відкриту частину гумових пробок ватним тампоном, змоченим спиртом. Дайте флаконам висохнути перед відкриттям упаковки Mix2Vial (яка містить перелівач з фільтром) та подальшим слідуванням інструкціям.
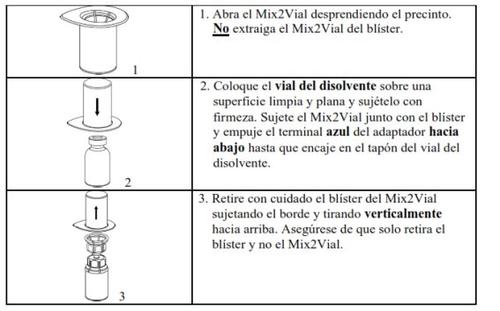

Використовуйте набір для венепункції, який постачається з продуктом, та вставте голку у вену. Дайте крові протікати до кінця трубки. Підключіть шприц до гвинтового кінця набору для венепункції. Введіть повільно реконституїд розчин (зі швидкістю, яка вам зручна, до максимальної - 10 мл/хв) у венузгідно з інструкціями, які дав ваш лікар. Спробуйте не допустити потрапляння крові у шприц, який містить препарат.
Перевірте, чи відчуваєте ви побічні ефекти одразу після введення. Якщо ви відчуваєте будь-який побічний ефект, який може бути пов'язаний з введенням AFSTYLA, введення повинно бути припинено (див. також розділ 2).
Використання у дітей та підлітків
AFSTYLA можна використовувати у дітей та підлітків усіх вікових груп. У разі дітей молодших 12 років можуть знадобитися вищі дози або частіші ін'єкції. У дітей старших 12 років можна використовувати таку саму дозу, як і у дорослих.
Якщо ви використали більше AFSTYLA, ніж потрібно
Якщо ви ввели більше AFSTYLA, ніж потрібно, повідомте про це вашому лікареві.
Якщо ви забули використати AFSTYLA
Не вводьте подвійну дозу для компенсації забутої дози. Введіть наступну дозу негайно та слідуйте інструкціям вашого лікаря.
Якщо ви припините лікування AFSTYLA
Якщо ви припините використання AFSTYLA, ви можете перестати бути захищеними від кровотечі або можете продовжувати кровоточити, якщо у вас є активна кровотеча. Не припиняйте використання AFSTYLA без попередньої консультації з вашим лікарем.
Якщо у вас є будь-які інші питання щодо використання цього лікарського засобу, проконсультуйтеся з вашим лікарем, фармацевтом або медсестрою.
4. Можливі побічні ефекти
Як і всі лікарські засоби, AFSTYLA може викликати побічні ефекти, хоча не всі люди їх відчувають.
Негайно припиніть використання лікарського засобу та зверніться до вашого лікаря:
- якщо ви відчуваєте симптоми алергічних реакцій
- Можливі алергічні реакції, які включають такі симптоми: кропив'янка, загальна висипка, тиснення на грудній клітці, труднощі з диханням, низький тиск та анафілаксія (важка алергічна реакція, яка викликає серйозні труднощі з диханням та головокружіння). Якщо це відбувається, лікарський засіб повинен бути негайно припинений та звернутися до вашого лікаря.
- якщо ви відчуваєте, що лікарський засіб перестав діяти правильно(кровотеча не припиняється) Для дітей, які не були раніше лікувані препаратами фактору VIII, утворення інгібіторів (антитіл) (див. розділ 2) може відбуватися дуже часто (більше 1 з 10 пацієнтів); однак у пацієнтів, які раніше лікувалися фактором VIII (більше 150 днів лікування), ризик є рідкісним (менше 1 з 100 пацієнтів). Якщо у вас або вашої дитини розвинувся інгібітор через лікарський засіб, можуть виникнути тривалі кровотечі. Якщо це відбувається, зверніться до вашого лікаря негайно.
Часті побічні ефекти (можуть виникнути у до 1 з 10 осіб)
- Парестезія ( оніміння чи поколювання).
- Висипка на шкірі.
- Гіпертермія.
Рідкісні побічні ефекти (можуть виникнути у до 1 з 100 осіб)
- Свербіж.
- Червоність шкіри.
- Біль у місці ін'єкції.
- Озноб.
- Чувство жару.
Побічні ефекти у дітей та підлітків
Не спостерігалися особливі вікові відмінності у побічних реакціях між дітьми, підлітками та дорослими.
Звітність про побічні ефекти
Якщо ви відчуваєте будь-який побічний ефект, проконсультуйтеся з вашим лікарем, фармацевтом або медсестрою, навіть якщо це можливі побічні ефекти, які не вказані в цьому листку. Ви також можете повідомити про них безпосередньо через національну систему повідомлення, включену до додатка V. Надсилаючи повідомлення про побічні ефекти, ви можете допомогти надати більше інформації про безпеку цього лікарського засобу.
5. Збереження AFSTYLA
- Тримайте цей лікарський засіб поза зоною досяжності дітей.
- Не використовуйте цей лікарський засіб після закінчення терміну придатності, вказаного на етикетці та коробці.
- Тримайте у холодильнику (між 2 °C та 8 °C).
- Перед реконституцією порошку AFSTYLA його можна зберігати при кімнатній температурі (нижче 25 °C) протягом одного періоду, не довше 3 місяців, у межах терміну придатності, вказаного на коробках та флаконах. Запишіть дату, з якої ви починаєте зберігати AFSTYLA при кімнатній температурі, на коробці лікарського засобу.
- Як тільки ви вийняли лікарський засіб з холодильника, не повертайте його назад.
- Не заморожуйте.
- Тримайте флакон у коробці, щоб захистити його від світла.
- Після реконституції лікарського засобу його слід використати якнайшвидше.
- Якщо реконституїд продукт не вводиться негайно, час та умови зберігання перед його використанням є відповідальністю користувача.
6. Зміст упаковки та додаткова інформація
Склад AFSTYLA
Активний інгредієнт:
250 МЕ на флакон; після реконституції з 2,5 мл води для ін'єкційних препаратів, розчин містить 100 МЕ/мл лONOCTOCOG альфа.
500 МЕ на флакон; після реконституції з 2,5 мл води для ін'єкційних препаратів, розчин містить 200 МЕ/мл лONOCTOCOG альфа.
1 000 МЕ на флакон; після реконституції з 2,5 мл води для ін'єкційних препаратів, розчин містить 400 МЕ/мл лONOCTOCOG альфа.
1 500 МЕ на флакон; після реконституції з 5 мл води для ін'єкційних препаратів, розчин містить 300 МЕ/мл лONOCTOCOG альфа.
2 000 МЕ на флакон; після реконституції з 5 мл води для ін'єкційних препаратів, розчин містить 400 МЕ/мл лONOCTOCOG альфа.
2 500 МЕ на флакон; після реконституції з 5 мл води для ін'єкційних препаратів, розчин містить 500 МЕ/мл лONOCTOCOG альфа.
3 000 МЕ на флакон; після реконституції з 5 мл води для ін'єкційних препаратів, розчин містить 600 МЕ/мл лONOCTOCOG альфа.
Інші компоненти:
Л-гістидин, полісорбат 80, дигідрат хлориду кальцію, хлорид натрію (див. останній розділ розділу 2), сукроза.
Розчинник: вода для ін'єкційних препаратів.
Вигляд AFSTYLA та вміст упаковки
AFSTYLA представлений у вигляді білого або легкого жовтого порошку або маси та прозорого безбарвного розчинника для ін'єкційних препаратів.
Розчин після реконституції повинен бути прозорим або легкою опалесценцією, між жовтим та безбарвним, тобто може блищати при освітленні, але не повинен містити жодних видимих частинок.
Упаковки
Одна упаковка з 250, 500 або 1 000 МЕ, що містить:
1 флакон з порошком
1 флакон з 2,5 мл води для ін'єкційних препаратів
1 трансфер з фільтром 20/20
Внутрішня коробка, що містить:
1 одноразову ін'єкційну шприц 5 мл
1 набір для венепункції
2 ватні тампони, змочені спиртом
1 нестерильна пов'язка
Одна упаковка з 1 500, 2 000, 2 500 або 3 000 МЕ, що містить:
1 флакон з порошком
1 флакон з 5 мл води для ін'єкційних препаратів
1 трансфер з фільтром 20/20
Внутрішня коробка, що містить:
1 одноразову ін'єкційну шприц 10 мл
1 набір для венепункції
2 ватні тампони, змочені спиртом
1 нестерильна пов'язка
Можливо, що тільки деякі розміри упаковок будуть продаватися.
Первинне упаковування
250 МЕ | Склянка з скла з гумовою пробкою, оранжевим пластиковим диском та алюмінієвою кришкою з зеленими смугами |
500 МЕ | Склянка з скла з гумовою пробкою, синім пластиковим диском та алюмінієвою кришкою з зеленими смугами |
1 000 МЕ | Склянка з скла з гумовою пробкою, зеленим пластиковим диском та алюмінієвою кришкою з зеленими смугами |
1 500 МЕ | Склянка з скла з гумовою пробкою, бірюзовим пластиковим диском та алюмінієвою кришкою з зеленими смугами |
2 000 МЕ | Склянка з скла з гумовою пробкою, фіолетовим пластиковим диском та алюмінієвою кришкою з зеленими смугами |
2 500 МЕ | Склянка з скла з гумовою пробкою, світло-сірим пластиковим диском та алюмінієвою кришкою з зеленими смугами |
3 000 МЕ | Склянка з скла з гумовою пробкою, жовтим пластиковим диском та алюмінієвою кришкою з зеленими смугами |
Власник дозволу на маркетинг та відповідальна особа за виробництво
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Марбург
Німеччина
Для отримання додаткової інформації щодо цього лікарського засобу зверніться до місцевого представника власника дозволу на маркетинг:
Бельгія CSL Behring NV Тел: +32 15 28 89 20 | Литва CentralPharma Communications UAB Тел: +370 5 243 0444 |
| Люксембург CSL Behring NV Тел: +32 15 28 89 20 |
Чехія CSL Behring s.r.o. Тел: + 420 702 137 233 | Угорщина CSL Behring Kft. Тел: +36 1 213 4290 |
Данія CSL Behring AB Тел: +46 8 544 966 70 | Мальта AM Mangion Ltd. Тел: +356 2397 6333 |
Німеччина CSL Behring GmbH Тел: +49 6190 75 84810 | Нідерланди CSL Behring BV Тел: + 31 85 111 96 00 |
Естонія CentralPharma Communications OÜ Тел: +3726015540 | Норвегія CSL Behring AB Тел: +46 8 544 966 70 |
Греція CSL Behring ΕΠΕ Тел: +30 210 7255 660 | Австрія CSL Behring GmbH Тел: +43 1 80101 1040 |
Іспанія CSL Behring S.A. Тел: +34 933 67 1870 | Польща CSL Behring Sp.z o.o. Тел: +48 22 213 22 65 |
Франція CSL Behring S.A. Тел: + 33 –(0)-1 53 58 54 00 | Португалія CSL Behring Lda Тел: +351 21 782 62 30 |
Хорватія Marti Farm d.o.o. Тел: +385 1 5588297 | Румунія Prisum Healthcare S.R.L. Тел: +40 21 322 0171 |
Ірландія CSL Behring GmbH Тел: +49 6190 75 84700 Ісландія CSL Behring AB Тел: +46 8 544 966 70 | Словенія Emmes Biopharma Global s.r.o. подружнниця в Словенії Тел:+ 386 41 42 0002 Словаччина CSL Behring Slovakia s.r.o. Тел: +421 911 653 862 |
Італія CSL Behring S.p.A. Тел: +39 02 34964 200 | Фінляндія CSL Behring AB Тел: +46 8 544 966 70 |
Кіпр CSL Behring ΕΠΕ Тел: +30 210 7255 660 | Швеція CSL Behring AB Тел: +46 8 544 966 70 |
Латвія CentralPharma Communications SIA Тел: +371 6 7450497 | |
Дата останнього перегляду цієї інструкції: {12/2024}.
Детальна інформація про цей лікарський засіб доступна на сайті Європейського агентства з лікарських засобів: http://www.ema.europa.eu.
----------------------------------------------------------------------------------------------------------
Ця інформація призначена лише для медичних працівників:
Моніторинг лікування
Під час лікування рекомендується контролювати рівень фактору VIII для визначення дози, яку потрібно вводити, та частоти ін'єкцій. Реакції пацієнтів на фактор VIII можуть відрізнятися, що свідчить про те, що вони мають різні періоди напіврозпаду та відновлення. Можливо, що доза, заснована на масі тіла, повинна бути коригована у пацієнтів з недостатньою або надлишковою масою тіла. У разі великих хірургічних втручань необхідно точно контролювати заміщення терапії за допомогою аналізу згортання крові (активність фактору VIII плазми).
При використанні одностадійного коагуляційного тесту на основі часу активованого часткового тромбопластину (TTPa) in vitroдля визначення активності фактору VIII у зразках крові пацієнтів результати активності фактору VIII плазми можуть суттєво змінюватися залежно від типу реактиву TTPa та стандарту посилання, використаного у тесті. Також можуть виникати суттєві розбіжності між результатами, отриманими у тесті коагуляції одностадійного типу на основі TTPa, та результатами, отриманими у хромогенному тесті згідно з Європейською фармакопеєю. Це особливо важливо, коли змінюється лабораторія або реактиви, які використовуються у тесті.
Активність фактору VIII плазми у пацієнтів, які приймають AFSTYLA з хромогенним або одностадійним коагуляційним тестом, повинна контролюватися для визначення дози, яку потрібно вводити, та частоти повторних ін'єкцій. Результат хромогенному тесту більш точно відображає клінічний гемостатичний потенціал AFSTYLA, тому це метод вибору. Результат одностадійного коагуляційного тесту недооцінює рівень активності фактору VIII порівняно з результатом хромогенному тесту приблизно на 45%. Якщо використовується одностадійний коагуляційний тест, результат множиться на коефіцієнт перетворення 2 для визначення рівня активності фактору VIII пацієнта.
Посологія
Доза та тривалість заміщення терапії залежать від тяжкості дефіциту фактору VIII, місця та ступеня кровотечі та клінічного стану пацієнта.
Кількість введених одиниць фактору VIII виражається в Міжнародних одиницях (МЕ), які відповідають сучасному концентрованому стандарту ВООЗ для лікарських засобів з фактором VIII. Активність фактору VIII у плазмі виражається як відсоток (у порівнянні з нормальною людською плазмою) або, бажано, у Міжнародних одиницях (у порівнянні зі стандартом для фактору VIII у плазмі).
Одна Міжнародна одиниця (МЕ) активності фактору VIII відповідає кількості фактору VIII, присутній у 1 мл нормальної людської плазми.
Назначення потужності визначається за допомогою хромогенних субстратних тестів.
Рівні плазматичного фактору VIII можна контролювати за допомогою хромогенних субстратних тестів або одностадійного коагуляційного тесту.
Лікування за запитом
Розрахунок необхідної дози фактору VIII базується на емпіричному висновку, що 1 Міжнародна одиниця (МЕ) фактору VIII на кг маси тіла підвищує активність плазматичного фактору VIII на 2 МЕ/дл.
Потрібна доза визначається за допомогою наступної формули: Доза (МЕ) = маса тіла (кг) x бажане підвищення фактору VIII (МЕ/дл або % від нормального рівня) x 0,5 (МЕ/кг на МЕ/дл)
Доза та частота введення завжди встановлюються залежно від клінічної ефективності, спостережуваної у кожному випадку.
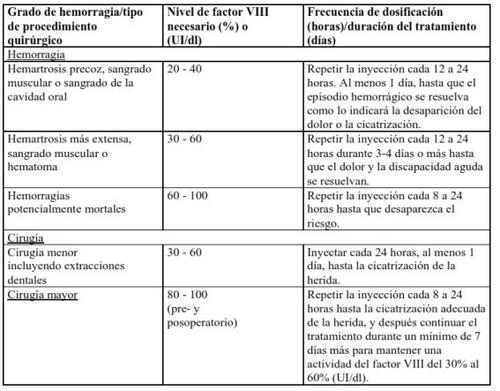
У разі наступних геморагічних подій активність фактору VIII не повинна бути нижчою за встановлений рівень активності плазми (у % від нормального рівня або МЕ/дл) протягом відповідного періоду. Наступна таблиця може бути використана як керівництво з дозування у геморагічних епізодах та хірургії:
Профілактичне лікування
Рекомендована початкова схема лікування - 20-50 МЕ/кг AFSTYLA, введених 2-3 рази на тиждень. Схему можна коригувати залежно від реакції пацієнта.
Педіатричне населення
Рекомендована початкова схема лікування для дітей (від 0 до <12 років) - 30-50 МЕ кг afstyla, введених 2-3 рази на тиждень. Можливо, що у дітей <12 років будуть потрібні частіші або вищі дози через більшу швидкість видалення цій віковій групі.< p>
У підлітків віком 12 років і старших рекомендується така ж доза, як і для дорослих.
Популяція похилого віку
У клінічних дослідженнях AFSTYLA не брали участь особи віком понад 65 років
- Країна реєстрації
- Діючі речовини
- Потрібен рецептТак
- Виробник
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУФорма випуску: РОЗЧИН ДЛЯ ІН'ЄКЦІЙ, 1000 МОДіючі речовини: coagulation factor VIIIВиробник: Takeda Manufacturing Austria AgПотрібен рецептФорма випуску: РОЗЧИН ДЛЯ ІН'ЄКЦІЙ, 1500 МОДіючі речовини: coagulation factor VIIIВиробник: Takeda Manufacturing Austria AgПотрібен рецептФорма випуску: РОЗЧИН ДЛЯ ІН'ЄКЦІЙ, 1000 МО - після відновлення в 2 мл води для ін'єкцій доза становить 500 МО/млДіючі речовини: coagulation factor VIIIВиробник: Takeda Manufacturing Austria AgПотрібен рецепт
Аналоги АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ у Poland
Аналог АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ у Ukraine
Лікарі онлайн щодо АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на АФСТИЛА 1500 МО ПОРОШОК І РОЗЧИННИК ДЛЯ ПРИГОТУВАННЯ ІН'ЄКЦІЙНОГО РОЗЧИНУ – за рішенням лікаря та згідно з місцевими правилами.















