

Смофкабівен екстра Нітроген Еф

Запитайте лікаря про рецепт на Смофкабівен екстра Нітроген Еф

Інструкція із застосування Смофкабівен екстра Нітроген Еф
Укладена інструкція до упаковки: інформація для користувача
SmofKabiven extra Nitrogen EF, емульсія для інфузії
Перш ніж використовувати препарат, уважно ознайомтеся з вмістом інструкції, оскільки вона містить
важливу інформацію для пацієнта.
- Збережіть цю інструкцію, щоб у разі потреби знову її прочитати.
- Якщо у вас виникли будь-які сумніви, зверніться до лікаря, фармацевта або медсестри.
- Якщо в пацієнта виникли будь-які побічні ефекти, включаючи ті, що не наведені в цій інструкції, повідомте про це лікаря, фармацевта або медсестру. Див. пункт 4.
Зміст інструкції
- 1. Що таке SmofKabiven extra Nitrogen EF і для чого він використовується
- 2. Інформація, яку потрібно знати перед використанням препарату SmofKabiven extra Nitrogen EF
- 3. Як використовувати SmofKabiven extra Nitrogen EF
- 4. Можливі побічні ефекти
- 5. Як зберігати SmofKabiven extra Nitrogen EF
- 6. Зміст упаковки і інші відомості
1. Що таке SmofKabiven extra Nitrogen EF і для чого він використовується
SmofKabiven extra Nitrogen EF - це емульсія для інфузії, яка вводиться пацієнту через капельницю (інфузію вену). Упаковка препарату являє собою пластиковий мішок, який містить амінокислоти (компоненти, необхідні для створення білків), глюкозу (вуглеводи) і жири (ліпіди). Препарат може бути використаний у дорослих пацієнтів і дітей віком від 2 років і старше.
Професійний медичний персонал вводить SmofKabiven extra Nitrogen EF, якщо інші методи харчування недостатні або неможливі.
2. Інформація, яку потрібно знати перед використанням препарату SmofKabiven extra Nitrogen EF
Не використовувати препарат SmofKabiven extra Nitrogen EF, якщо в пацієнта є:
- чутливість до активних речовин або будь-якого з інших компонентів цього препарату (перелічених у пункті 6);
- алергія на риб'ячий білок або яйця;
- алергія на арахіс або сою (SmofKabiven extra Nitrogen EF містить соєвий олій);
- занадто висока концентрація жирів у крові (гіперліпідемія);
- важкі порушення функції печінки;
- проблеми з згортанням крові (забурення згортання);
- вада обміну амінокислот;
- важка хвороба нирок, без можливості проведення діалізу;
- гострий шок;
- неkontrolоване підвищення рівня глюкози у крові (гіперглікемія);
- рідини у легенях (гострий набряк легенів);
- занадто багато рідини в організмі (перегідратування);
- не лікована ниркова недостатність;
- забурення в системі згортання крові (гемофагоцитарний синдром);
- нестабільний стан загального здоров'я, наприклад, важка травма, не компенсована цукровий діабет, гострий інфаркт міокарда, інсульт, тромбоз, метаболічний ацидоз (розлад, який полягає у надмірній кількості речовин з кислотними властивостями у крові), важка інфекція (важка сепсис), кома, дефіцит рідини (гіпотонічний дефіцит рідини).
Не слід використовувати препарат SmofKabiven extra Nitrogen EF у новонароджених і дітей віком до 2 років.
Осторожності та заходи обережності
Перш ніж почати використовувати препарат SmofKabiven extra Nitrogen EF, обговоріть це з лікарем, якщо в пацієнта є:
- хвороба нирок;
- цукровий діабет;
- панкреатит;
- хвороба печінки;
- гіпотиреоз (розлади щитоподібної залози);
- сепсис (важка інфекція).
Якщо під час інфузії виникла гарячка, висип, набряк, труднощі з диханням, озноб, потіння, нудота або блювота, негайно повідомте про це професіональний медичний персонал, оскільки ці симптоми можуть бути спричинені алергічною реакцією або введенням надмірної дози препарату.
Лікар може призначити регулярне обстеження крові для визначення функціональних проб печінки та інших показників.
Діти та підлітки
SmofKabiven extra Nitrogen EF не призначений для введення новонародженим або дітям віком до 2 років. SmofKabiven extra Nitrogen EF можна вводити дітям віком від 2 до 16/18 років.
SmofKabiven extra Nitrogen EF та інші препарати
Повідомте лікаря про всі препарати, які пацієнт зараз приймає або приймав раніше, а також про препарати, які пацієнт планує приймати, включаючи ті, які видаються без рецепта.
Вагітність і годування грудьми
Немає даних про використання препарату SmofKabiven extra Nitrogen EF під час вагітності або годування грудьми. SmofKabiven extra Nitrogen EF вводиться вагітним жінкам або під час годування грудьми лише у тому випадку, якщо лікар вважає це необхідним. SmofKabiven extra Nitrogen EF під час вагітності та годування грудьми може бути введений за призначенням лікаря.
Відповідальність за керування транспортними засобами та обслуговування машин
Не застосовується, оскільки цей препарат використовується в лікарні.
3. Як використовувати SmofKabiven extra Nitrogen EF
Цей препарат завжди повинен бути використаний згідно з рекомендаціями лікаря. У разі сумнівів зверніться до лікаря.
Лікар вибирає індивідуальну дозу залежно від маси тіла та клінічного стану пацієнта. SmofKabiven extra Nitrogen EF вводиться лише професіональним медичним персоналом.
Введення більшої, ніж рекомендована, дози препарату SmofKabiven extra Nitrogen EF
Мало ймовірно, щоб пацієнт отримав надмірну дозу препарату SmofKabiven extra Nitrogen EF, оскільки цей препарат вводиться професіональним медичним персоналом.
4. Можливі побічні ефекти
Як і будь-який препарат, цей препарат може викликати побічні ефекти, хоча вони не виникають у кожного пацієнта.
Часто виникають побічні ефекти(можуть виникати не частіше ніж у 1 з 10 пацієнтів):
незначне підвищення температури тіла.
Не дуже часто виникають побічні ефекти(можуть виникати не частіше ніж у 1 з 100 пацієнтів): велика концентрація ферментів печінки у крові, відсутність апетиту, нудота, блювота, озноб, головокружіння та головний біль.
Рідко виникають побічні ефекти(можуть виникати не частіше ніж у 1 з 1000 пацієнтів): низьке або високе артеріальне кров'яний тиск, труднощі з диханням, прискорене серцебиття (тахікардія).
Алергічні реакції (які можуть проявлятися симптомами, такими як набряк, гарячка, зниження артеріального кров'яного тиску, висип на шкірі, пухирці, червоність, головний біль). Чувство жару та холоду. Блідість. Легке синіння губ та шкіри (пов'язане з недостатньою оксигенацією крові). Біль у шиї, спині, кістках, грудній клітці та попереку.
Звітність про побічні ефекти
Якщо виникли будь-які побічні ефекти, включаючи ті, що не наведені в цій інструкції, повідомте про це лікаря, фармацевта або медсестру. Побічні ефекти можна повідомляти безпосередньо до Департаменту моніторингу небажаних дій лікарських засобів Управління реєстрації лікарських засобів, медичних виробів та біоцидів
Ал. Єрусалимські 181С, 02-222 Варшава
тел.: +48 22 49 21 301, факс: +48 22 49 21 309
веб-сайт: https://smz.ezdrowie.gov.pl
Побічні ефекти також можна повідомляти відповідальному суб'єкту.
Звітність про побічні ефекти дозволить зібрати більше інформації про безпеку використання препарату.
5. Як зберігати SmofKabiven extra Nitrogen EF
Препарат повинен бути зберігався в місці, недоступному для дітей.
Не зберігати при температурі вище 25°C. Не заморожувати. Зберігати у зовнішньому мішку.
Не використовувати цей препарат після закінчення терміну придатності, вказаного на мішку та картонній коробці.
Термін придатності означає останній день вказаного місяця.
6. Зміст упаковки і інші відомості
Що містить SmofKabiven extra Nitrogen EF
Активними речовинами препарату є:
г на 1000 мл
аланіна
9,2
аргініна
7,9
гліцина
7,2
гістидина
2,0
ізолейцина
3,3
лейцина
4,8
лізина (у вигляді оцту)
4,3
метіоніна
2,8
фенілаланіна
3,3
проліна
7,3
серина
4,3
таурина
0,65
треоніна
2,9
триптофана
1,3
тіrozина
0,26
валіна
4,1
глюкоза (у вигляді моногідрату)
85
очищений соєвий олій
8,7
тригліцериди насичених жирних кислот середньої довжини
8,7
очищений оливковий олій
7,2
риб'ячий олій, багаті на омега-3 кислоти
4,3
Інші компоненти (допоміжні речовини) - гліцерол, очищені фосфоліпіди з курячого яйця, all-rac-α-токоферол, гідроксид натрію (для встановлення pH), олеїнат натрію, оцтовий льодяний кислот (для встановлення pH), соляна кислота (для встановлення pH) та вода для ін'єкцій.
Як виглядає SmofKabiven extra Nitrogen EF і що містить упаковка
Розчини глюкози та амінокислот прозорі, безбарвні до легкого жовтого кольору, без твердих частинок. Жирова емульсія біла та однорідна.
Величини упаковки:
1 × 506 мл, 6 × 506 мл
1 × 1012 мл, 4 × 1012 мл
1 × 1518 мл, 4 × 1518 мл
1 × 2025 мл, 4 × 2025 мл
1 × 2531 мл, 3 × 2531 мл
Не всі величини упаковки повинні бути в обігу.
Відповідальний суб'єкт і виробник
Fresenius Kabi AB
Рапсгатан 7
751 74 Уппсала
Швеція
Для отримання більш детальної інформації зверніться до представника відповідального суб'єкта:
Fresenius Kabi Польща Сп. з о.о.
Ал. Єрусалимські 134
02-305 Варшава
тел.: +48 22 345 67 89
Дата останньої актуалізації інструкції:09.06.2023 р.
---------------------------------------------------------------------------------------------------------------------------
Інформація, призначена лише для професіонального медичного персоналу:
Осторожності та заходи обережності при використанні
Для уникнення загроз, пов'язаних з інфузією зі швидкістю більша, ніж рекомендована, рекомендується її проведення у спосіб безперервний і належно контрольований, за можливості з використанням об'ємної помпи.
Оскільки використання центральної вени для інфузії пов'язане з підвищеним ризиком інфекції, під час встановлення та обслуговування катетера рекомендується суворо дотримуватися правил асептичного поведінки, щоб уникнути будь-якої інфекції.
Рекомендується контролювати рівень глюкози та електролітів у сироватці, осмолярність, а також баланс рідини та кислотно-лужну рівновагу, а також проводити ферментативні проби печінки.
У разі виникнення будь-яких ознак або симптомів анафілактичної реакції (таких як гарячка, озноб, висип, або задуха) необхідно негайно припинити інфузію.
Не слід вводити препарат SmofKabiven extra Nitrogen EF одночасно з кров'ю в тому ж інфузійному наборі, через ризик виникнення псевдоаглютинації.
Спосіб введення
Внутрішньовенне введення, інфузія в центральну вену.
Для забезпечення повного парентерального харчування необхідно додавати до препарату SmofKabiven extra Nitrogen EF мікроелементи, електроліти та вітаміни, відповідно до потреб пацієнта.
Дозування
Дорослі пацієнти
Рекомендоване дозування
Діапазон дози становить від 13 до 31 мл препарату SmofKabiven extra Nitrogen EF/кг маси тіла/добу, що забезпечує введення від 0,14 до 0,32 г азоту/кг маси тіла/добу (від 0,85 до 2,0 г амінокислот/кг маси тіла/добу) і від 12 до 28 ккал/кг маси тіла/добу загальної енергії (від 8 до 19 ккал/кг маси тіла/добу позабілкової енергії).
Швидкість інфузії
Максимальна швидкість інфузії глюкози зазвичай становить 0,25 г/кг маси тіла/годину, амінокислот - 0,1 г/кг маси тіла/годину, а жирів - 0,15 г/кг маси тіла/годину.
Швидкість інфузії не повинна бути більшою ніж 1,5 мл/кг маси тіла/годину (що відповідає 0,13 г глюкози, 0,10 г амінокислот і 0,04 г жирів/кг маси тіла/годину). Рекомендований час тривалості інфузії становить від 14 до 24 годин.
Інфузійне парентеральне харчування під час діалізу (IDPN, англ. intradialytic parenteral nutrition)
У клінічно стабільних дорослих пацієнтів, які проходять регулярну терапію заміщення нирок, максимальна швидкість інфузії під час інфузійного парентерального харчування (IDPN) становить 3,0 мл/кг маси тіла/годину (що відповідає 0,20 г/кг маси тіла/годину амінокислот, 0,25 г/кг маси тіла/годину глюкози і 0,09 г/кг маси тіла/годину жирів). Об'єм інфузії під час IDPN повинен бути залежно від різниці між пероральним прийомом харчування та рекомендованим споживанням харчових речовин, неминучих втрат харчових речовин, спричинених лікуванням заміщення нирок, а також від індивідуальної метаболічної толерантності пацієнта. Час тривалості інфузії під час IDPN зазвичай становить від 3 до 5 годин, залежно від потреб пацієнта та запланованого часу тривалості сеансу лікування заміщення нирок. Максимальна рекомендована добова доза залишається незмінною
Максимальна добова доза
Максимальна добова доза залежить від клінічного стану пацієнта і може змінюватися навіть з дня в день.
Рекомендована максимальна добова доза становить 31 мл/кг маси тіла/добу.
Діти та підлітки
Діти віком 2-11 років
Рекомендоване дозування
Доза до 31 мл/кг маси тіла/добу повинна бути регулярно коригована залежно від потреб пацієнта в дитячому віці, які відрізняються значно більше, ніж у дорослих пацієнтів.
Швидкість інфузії
Рекомендована максимальна швидкість інфузії становить 1,8 мл/кг маси тіла/годину (що відповідає 0,12 г амінокислот/кг маси тіла/годину, 0,15 г глюкози/кг маси тіла/годину і 0,05 г жирів/кг маси тіла/годину).
Поза особливими ситуаціями, які вимагають ретельного моніторингу, при застосуванні рекомендованої максимальної швидкості інфузії час тривалості інфузії не повинен перевищувати 17 годин.
Рекомендований час тривалості інфузії становить від 12 до 24 годин.
Максимальна добова доза
Максимальна добова доза є змінною залежно від клінічного стану пацієнта і може змінюватися навіть з дня в день. Рекомендована максимальна добова доза становить 31 мл/кг маси тіла/добу.
Підлітки віком 12-16/18 років
У підлітків SmofKabiven extra Nitrogen EF можна дозувати як у дорослих пацієнтів.
Спеціальні заходи обережності при видаленні та підготовці препарату до використання
Не використовувати, якщо упаковка пошкоджена.
Використовувати лише у тому випадку, якщо розчини амінокислот і глюкози прозорі, безбарвні до легкого жовтого кольору, а жирова емульсія біла та однорідна .Зміст трьох окремих камер необхідно перемішати перед використанням, а також перед можливим додаванням інших речовин через призначений для цього порт.
Після видалення захисних засобів кілька разів переверніть мішок, щоб точно перемішати всі компоненти препарату та отримати однорідну суміш, в якій не повинні бути видимі ознаки розшарування фаз.
Призначено лише для одноразового використання. Будь-які невикористані залишки препарату, які залишилися після інфузії, повинні бути знищені.
Згодність
Дані про згодність доступні для препаратів Dipeptiven, Addamel N/Supliven, Glycophos, Addiphos, Vitalipid N Adult/Infant і Soluvit N у певних кількостях та з певною концентрацією електролітів.
Під час додавання електролітів необхідно враховувати їх кількість, яка вже присутня у мішку, для задоволення клінічних потреб пацієнта. Доступні дані підтверджують можливість додавання зазначених препаратів до активованого мішка згідно з нижчезазначеною таблицею:
Діапазон згодності: стабільний протягом 7 днів, тобто 6 днів зберігання при температурі 2-8 °C, а потім 24 години при температурі 20-25 °C.
| Одиниця | Максимальна загальна кількість | |||||
| Величина мішка SmofKabiven extra Nitrogen EF | мл | 506 | 1012 | 1518 | 2025 | 2531 |
| Додаток | Об'єм | |||||
| Dipeptiven | мл |
|
|
|
|
|
| Supliven/Addamel N | мл |
|
|
|
|
|
| Soluvit N | флакон(и) |
|
|
|
|
|
| Vitalipid N Adult/Infant | мл |
|
|
|
|
|
| Ліміти електролітів1 | Концентрація | |||||
| Натрій | ммоль/л | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 |
| Калій | ммоль/л | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 | ≤ 150 |
| Кальцій | ммоль/л | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 |
| Магній | ммоль/л | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 | ≤ 5 |
| Нейорганічний фосфат (Addiphos) або органічний фосфат (Glycophos) | ммоль/л | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 | ≤ 15 ≤ 30 |
| Цинк | ммоль/л | ≤ 0,2 | ≤ 0,2 | ≤ 0,2 | ≤ 0,2 | ≤ 0,2 |
| Селен | мкмоль/л | ≤ 2 | ≤ 2 | ≤ 2 | ≤ 2 | ≤ 2 |
Примітка: ця таблиця призначена для демонстрації згодності. Вона не містить рекомендацій щодо дозування.
Перш ніж призначити зазначені препарати, необхідно ознайомитися з затвердженими інструкціями.
Інформація про згодність з іншими додатками та часи зберігання різних сумішей буде доступна на запит.
Будь-які додатки повинні бути змішані з препаратом у умовах асептики.
Термін придатності після змішування вмісту камер мішка
Показано стабільність фізичну та хімічну змішаного вмісту мішка з трьома камерами протягом 48 годин при температурі 20-25 °C. З мікробіологічної точки зору препарат повинен бути використаний негайно.
В іншому разі, за термін зберігання під час використання та за умови зберігання перед використанням відповідає користувач. Цей термін не повинен перевищувати 24 години при температурі 2-8 °C, якщо тільки змішування не відбулося в контрольованих та валідованих умовах асептики.
Термін придатності після змішування з додатковими речовинами
Показано стабільність фізико-хімічну змішаного вмісту мішка з трьома камерами з додатковими речовинами протягом періоду до 7 днів, тобто 6 днів при температурі 2-8 °C, а потім 24 години при температурі 20-25 °C, включаючи час тривалості інфузії. З мікробіологічної точки зору препарат повинен бути використаний негайно після додавання інших компонентів. В іншому разі, за термін зберігання під час використання та за умови зберігання перед використанням відповідає користувач. Цей термін не повинен перевищувати 24 години при температурі 2-8 °C, якщо тільки змішування не відбулося в контрольованих та валідованих умовах асептики.
SmofKabiven extra Nitrogen EF Інструкція підготовки мішка до використання
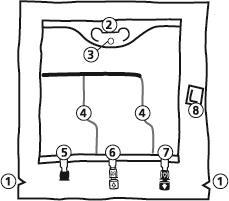
- 1. Надріз на зовнішньому мішку
- 2. Ручка мішка
- 3. Отвір для підвішування мішка
- 4. Зварювання, що відокремлює окремі камери мішка
- 5. Сліпий порт (використовується лише у виробництві)
- 6. Порт для введення додаткових речовин
- 7. Порт для інфузії
- 8. Поглинач кисню
| |
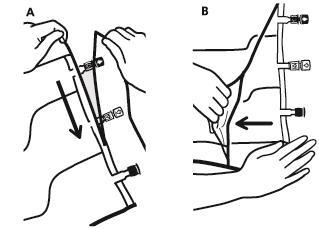 | |
- Для видалення зовнішнього мішка необхідно розмістити його горизонтально та почати розрив біля надрізу, розташованого біля портів, та розірвати зверху (А).
- Потім розірвати зовнішній мішок уздовж довгого краю, зняти його та викинути разом з поглиначем кисню (Б).
2. Перемішування
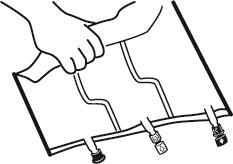
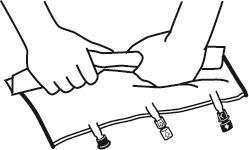
- Розмістити мішок на рівній поверхні.
- Почати з боку ручки міцно скрутити мішок у напрямку портів, спочатку правою рукою, а потім, прикладаючи постійний тиск лівою рукою, поки не піде злам зварювання. Зварювання відкриваються під дією тиску рідини. Зварювання можна також відкрити до видалення зовнішнього мішка. Примітка:рідини перемішуються легко, хоча злам по горизонталі залишається цілим.
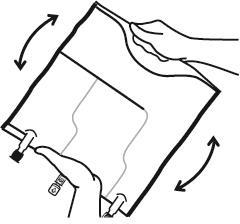
- Перемішати вміст трьох камер, перевернувши мішок тричі, що повинно забезпечити точне перемішування компонентів.
| |
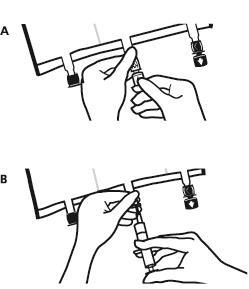 | |
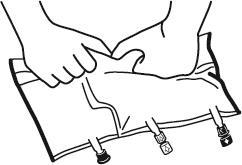
- Поновно розмістити мішок на рівній поверхні. Безпосередньо перед введенням додаткових речовин зняти позначену стрілкою затичку одноразового використання, яка закриває білий порт для введення додаткових речовин (А).
Примітка:мембрана порту для введення додаткових речовин стерильна.
- Утримувати основу порту для введення додаткових речовин. Ввести голку, ввести додаткові речовини (із відомою згодністю) через центр місця для введення (Б).
- Перемішати вміст мішка точно після додавання кожного компонента, обертаючи мішок тричі після кожного додавання. Використовувати шприци з голками діаметром 18-23 Г та довжиною не більше 40 мм.
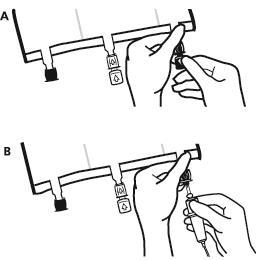
- Безпосередньо перед підключенням інфузійного набору зняти затичку одноразового використання, яка закриває синій порт для інфузії (А). Примітка:мембрана порту для інфузії стерильна.
- Використовувати інфузійні набори без повітряного клапана або закрити повітряний клапан.
- Утримувати основу порту для інфузії.
- Ввести голку інфузійного набору в порт для інфузії. Для забезпечення хорошої фіксації голки необхідно ввести всю її довжину. Примітка:внутрішня поверхня порту для інфузії стерильна.
4. Підвішування мішка
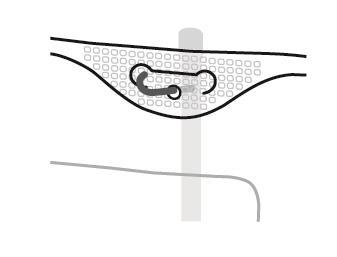
- Підвішувати мішок, використовуючи отвір, розташований під ручкою.
- Країна реєстрації
- Діючі речовини
- Потрібен рецептТак
- Виробник
- ІмпортерFresenius Kabi AB
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до Смофкабівен екстра Нітроген ЕфФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецептФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецептФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецепт
Аналоги Смофкабівен екстра Нітроген Еф в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Смофкабівен екстра Нітроген Еф у Hiszpania
Аналог Смофкабівен екстра Нітроген Еф у Ukraina
Лікарі онлайн щодо Смофкабівен екстра Нітроген Еф
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Смофкабівен екстра Нітроген Еф – за рішенням лікаря та згідно з місцевими правилами.














