
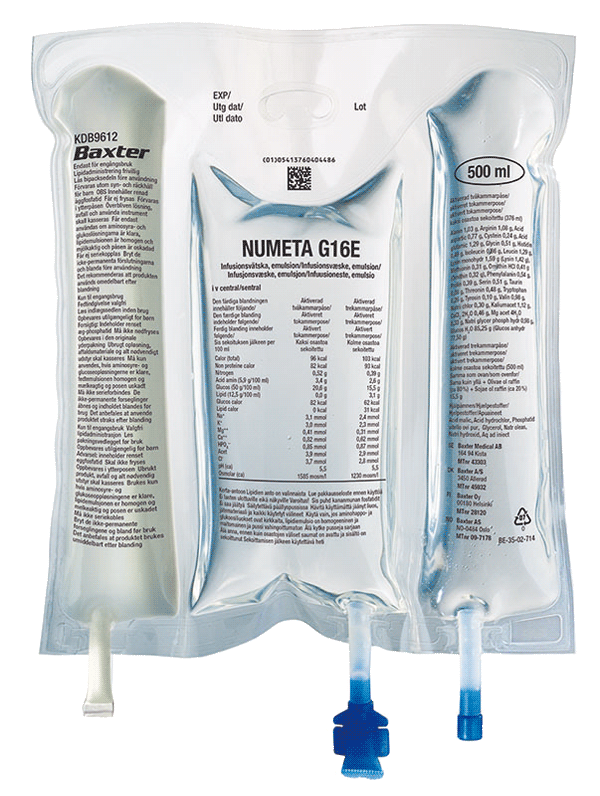
Нумета Г16%е

Запитайте лікаря про рецепт на Нумета Г16%е

Інструкція із застосування Нумета Г16%е
Укладення до пакування: інформація для користувача
NUMETA G16%E, емульсія для інфузії
Перш ніж використовувати препарат, уважно ознайомтеся з вмістом цієї брошури, оскільки вона містить
важливу інформацію для пацієнта.
- Збережіть цю брошуру, щоб у разі потреби ви могли її знову прочитати.
- Якщо у вас виникли будь-які сумніви, зверніться до лікаря вашої дитини, фармацевта або медсестри.
- Якщо у дитини з'являються будь-які неприємні симптоми, включаючи будь-які неприємні симптоми, не перелічені в цій брошурі, повідомте про це лікарю або медсестрі. Див. пункт 4.
Зміст брошури
- 1. Що таке препарат NUMETA G16%E і для чого він призначений
- 2. Інформація, яку потрібно знати до введення препарату NUMETA G16%E дитині
- 3. Як застосовувати препарат NUMETA G16%E
- 4. Можливі неприємні реакції
- 5. Як зберігати препарат NUMETA G16%E
- 6. Зміст пакування та інші відомості
1. Що таке препарат NUMETA G16%E і для чого він призначений
Препарат NUMETA G16%E є спеціалізованою емульсією для харчування, призначеною для новонароджених, народжених у строк, та дітей до 2 років. Його вводять через трубку, введену в вену дитини, у разі, якщо дитина не може приймати всі харчові компоненти через рот.
Препарат NUMETA випускається у вигляді трикамерного мішка, де окремі камери містять:
розчин глюкози 50%;
педіатричний розчин амінокислот з електролітами 5,9%;
жирову емульсію 12,5%.
У залежності від потреб дитини, два або три з цих розчинів змішуються в мішку перед введенням їх дитині.
Препарат NUMETA G16%E можна застосовувати лише під контролем лікаря.
2. Інформація, яку потрібно знати до введення препарату NUMETA G16%E дитині
Коли препарат NUMETA G16%E не повинен бути введений дитині:
У разі змішання 2 розчинів у мішку («2 у 1»):
- якщо у дитини виявлена алергія на білки курячого яйця, сою, арахіс або будь-який з компонентів, що входять до складу камери з глюкозою або амінокислотами (перелічених у пункті 6);
- якщо організм дитини не може використовувати білкові компоненти;
- якщо у крові дитини високий рівень будь-якого з електролітів, що входять до складу препарату NUMETA G16%E;
- у разі новонароджених (до 28 дня життя), препарат NUMETA G16%E (або інші розчини, що містять кальцій) не можна вводити одночасно з цефтріаксоном (антібіотиком), навіть якщо використовуються окремі лінії для інфузії. Існує ризик утворення частинок у крові новонародженого, які можуть призвести до смерті.
- якщо у дитини гіперглікемія (особливо високий рівень цукру у крові).
У разі змішання 3 розчинів у мішку («3 у 1»):
- у всіх випадках, перелічених вище для препарату «2 у 1», а також додатково:
- якщо у дитини високий рівень жиру у крові.
У всіх випадках лікар приймає рішення про введення препарату, враховуючи вік, масу тіла та клінічний стан дитини. Лікар також враховуватиме результати всіх проведених досліджень.
Попередження та обережність
Перш ніж почати введення препарату NUMETA G16%E, потрібно обговорити це з лікарем або медсестрою.
У разі застосування у новонароджених та дітей до 2 років розчин (у мішках та наборах для введення) потрібно захистити від світла до закінчення введення. Вплив світла на препарат NUMETA G16%E, особливо після змішання з мікроелементами та (або) вітамінами, може призвести до утворення пероксидів та інших продуктів розкладу, що можна зменшити захистом від світла.
Алергічні реакції:
Якщо з'являються будь-які ознаки або симптоми алергічної реакції (такі як гарячка, потіння, озноб, головний біль, висипка на шкірі або труднощі з диханням), інфузію потрібно негайно припинити.
Цей препарат містить соєвий олій, який рідко може призвести до реакцій надчутливості. У деяких осіб, алергічних на білки арахісу, також спостерігалося рідке алергічне реакції на соєві білки.
Препарат NUMETA G16%E містить глюкозу, вироблену з кукурудзяного крохмалю. Тому препарат NUMETA G16%E потрібно застосовувати з обережністю у пацієнтів з алергією на кукурудзу або продукти, що містять кукурудзу.
Ризик утворення осаду з цефтріаксоном (антібіотиком):
Антібіотик цефтріаксон не можна змішувати або вводити одночасно з будь-якими розчинами, що містять кальцій (у тому числі з препаратом NUMETA G16%E), які вводяться через вену.
Лікар знає про це і не вводить їх пацієнту одночасно, навіть через окремі лінії для інфузії або інші місця інфузії.
Однак лікар може вводити кальцій і цефтріаксон послідовно один за одним, якщо лінії для інфузії введені в різні місця або змінені чи докладно промиті фізіологічним розчином між інфузіями, щоб уникнути утворення осаду.
Утворення малих частинок у кровоносних судинах у легенях:
Труднощі з диханням також можуть бути ознакою утворення малих частинок, які блокують кровоносні судини у легенях (осад у легеневих судинах). Якщо у дитини з'являються будь-які труднощі з диханням, потрібно повідомити про це лікарю або медсестрі. Вони вирішать, які заходи потрібно вжити.
Інфекція та сепсис:
Лікар буде уважно спостерігати за дитиною, щоб виявити ознаки інфекції. Застосування правил асептики (заходи, що захищають від мікроорганізмів) при введенні та утриманні катетера, а також під час підготовки харчової суміші, може зменшити ризик інфекції.
Іноді, якщо в вену введено трубку (центральний венозний катетер), у дитини може розвинутися інфекція та сепсис (присутність бактерій у крові). Деякі препарати та захворювання можуть збільшувати ризик інфекції або сепсису. Пацієнти, які потребують парентерального харчування (введення харчових речовин через трубку, введену в вену), через стан здоров'я можуть бути більш схильні до розвитку інфекції.
Синдром переантаження жирами:
Під час застосування подібних препаратів описувалося утворення синдрому переантаження жирами.
Зниження або обмеження здатності організму до виведення жиру, що міститься у препараті NUMETA G16%E, або передозування, може призвести до так званого синдрому переантаження жирами (див. пункти 3 і 4).
Зміни рівня хімічних речовин у крові:
Лікар буде контролювати стан рідини у організмі дитини, хімічний склад крові та рівень інших речовин, оскільки іноді харчування осіб з тяжкою недоїданням може призвести до змін хімічного складу крові. Також може з'явитися додаткова рідина у тканинах та набухання. Рекомендується повільне та обережне початок парентерального харчування.
Збільшення рівня магнію у крові:
Кількість магнію, що міститься у препараті NUMETA G16%E, може призвести до збільшення рівня магнію у крові. У цьому випадку можуть з'явитися такі симптоми: слабкість, сповільнення рефлексів, нудота, блювота, низький рівень кальцію у крові, проблеми з диханням, низький тиск крові та нерегулярне серцебиття. Симптоми можуть бути важкими для виявлення, тому лікар може контролювати рівень магнію у крові дитини, особливо у дітей, у яких є фактори ризику підвищеного рівня магнію у крові, до яких належить порушення функції нирок. Якщо рівень магнію у крові підвищений, інфузію потрібно припинити або зменшити швидкість введення препарату.
Моніторинг та корекція:
Лікар буде уважно спостерігати та коригувати введення препарату NUMETA у залежності від індивідуальних потреб дитини у наступних випадках:
- важкі травматичні стани;
- важкий цукровий діабет;
- шок;
- інфаркт міокарда;
- важка інфекція;
- певні види коми.
Застосування з обережністю:
Препарат NUMETA потрібно застосовувати з обережністю, якщо у дитини:
- пульмонічний набухання (рідини у легенях) або серцева недостатність;
- важкі порушення функції печінки;
- порушення абсорбції харчових речовин;
- високий рівень цукру у крові;
- хвороби нирок;
- важкі порушення метаболізму (коли процес розкладу речовин не проходить нормально);
- порушення згортання крові.
Буде докладно контролюватися рівень рідини у організмі дитини, результати досліджень печінки та (або) крові.
Препарат NUMETA G16%E та інші препарати
Повідомте лікаря про всі препарати, які зараз приймає дитина, а також про препарати, які дитина буде приймати.
Препарат NUMETA не можна вводити одночасно з:
- цефтріаксоном(антібіотиком), навіть через окремі лінії для інфузії, через ризик утворення твердих частинок;
- кров'ючерез той самий набір для інфузії, через ризик псевдоаглютинації (червоні кров'яні тіла злипаються);
- ампіциліном, фосфенітоїном або фуросемідомчерез ту саму лінію для інфузії, через ризик утворення твердих частинок.
Кумарин і варфарин (антикоагулянти):
Лікар буде уважно спостерігати за дитиною, якщо вона приймає кумарин або варфарин.
Вітамін К1 є природним компонентом оливкової олії та соєвої олії. Вітамін К1 може взаємодіяти з препаратами, такими як кумарин і варфарин. Ці препарати є антикоагулянтами, які застосовуються для профілактики згортання крові.
Лабораторні дослідження:
Ліпіди, що входять до складу цієї емульсії, можуть впливати на результати деяких лабораторних досліджень.
Лабораторні дослідження потрібно проводити через 5-6 годин після останнього введення ліпідів.
Взаємодія препарату NUMETA G16%E з препаратами, які можуть впливати на рівень калію/метаболізм:
Препарат NUMETA містить калій. Високі рівні калію у крові можуть призвести до порушення серцевого ритму. Пацієнтів, які приймають діуретики (препарати, які зменшують заторювання рідини) або інгібітори АПФ (препарати, які застосовуються при високому тиску крові) або антагоністи рецепторів ангіотензину II (препарати, які застосовуються при високому тиску крові) або імунодепресивні препарати (препарати, які можуть зменшувати нормальну імунну відповідь організму), потрібно обережно спостерігати. Ці препарати можуть збільшувати рівень калію.
3. Як застосовувати препарат NUMETA G16%E
Препарат NUMETA G16%E потрібно завжди вводити дитині згідно з рекомендаціями лікаря. У разі сумнівів потрібно звернутися до лікаря.
Вікова група
Препарат NUMETA G16%E призначений для задоволення харчових потреб новонароджених, народжених у строк, та дітей до 2 років.
Лікар дитини вирішить, чи підходить цей препарат для нього.
Введення
Цей препарат є емульсією для інфузії. Його вводять через пластикову трубку у вену на руці або у велику вену у грудній клітці дитини.
Лікар може вирішити не вводити дитині жири. Мішок препарату NUMETA G16%E призначений так, що якщо це необхідно, можна розірвати перегородки лише між камерою з амінокислотами/електролітами та камерою, що містить глюкозу. У цьому випадку перегородка між камерою з амінокислотами та жирами залишається цілою. Таким чином, вміст мішка можна вводити без жиру.
У разі застосування у новонароджених та дітей до 2 років розчин (у мішках та наборах для введення) потрібно захистити від світла до закінчення введення (див. пункт 2).
Доза та тривалість лікування
Лікар вирішить, яку дозу препарату та як довго його потрібно вводити. Доза залежить від харчових потреб дитини. Доза буде встановлена на основі маси тіла дитини, клінічного стану та здатності її організму до розкладу та використання компонентів препарату NUMETA G16%E. Додаткові харчові компоненти або білки, що вводяться через рот/шлунок, також можуть бути введені.
Застосування у дитини більшої, ніж рекомендованої, дози препарату NUMETA G16%E
Симптоми
Занадто велика доза препарату або надто швидке введення може призвести до:
- нудоти (мдлої);
- блювоти;
- конвульсій;
- порушень електролітного балансу (неправильних рівнів електролітів у крові);
- симптомів гіперволемії (збільшеної об'єму циркулюючої крові);
- кислотного стану (збільшеної кислотності крові).
У таких випадках потрібно негайно припинити інфузію. Лікар вирішить, чи потрібні додаткові заходи.
Передозування жиру, що міститься у препараті NUMETA G16%E, може призвести до утворення «синдрому переантаження жирами», який зазвичай проходить після припинення інфузії. У новонароджених (немовлят) та малих дітей (дітей до 2 років) синдром переантаження жирами пов'язаний з порушеннями дихання, які призводять до зменшення кількості кисню в організмі (дихальна недостатність) та станами, які призводять до збільшення кислотності крові (кислотний стан).
Щоб уникнути таких ситуацій, лікар буде систематично контролювати стан дитини та проводити у неї дослідження крові під час лікування.
4. Можливі неприємні реакції
Як і будь-який препарат, цей препарат може призвести до неприємних реакцій, хоча вони не з'являються у кожного дитини.
У разі спостереження у дитини будь-яких змін самопочуття під час лікування або після його закінчення, потрібно негайно повідомити лікаря або медсестру.
Дослідження, які проводить лікар під час застосування препарату дитиною, повинні мінімалізувати ризик неприємних реакцій.
Якщо з'являються симптоми алергічної реакції, інфузію потрібно припинити та негайно звернутися до лікаря. Це може бути серйозно, а симптоми можуть включати:
- потіння
- озноб
- головний біль
- висипка на шкірі
- труднощі з диханням
Інші спостережувані неприємні реакції:
Часті: можуть стосуватися 1 з 10 осіб
- Низький рівень фосфатів у крові (гіпофосфатемія)
- Високий рівень цукру у крові (гіперглікемія)
- Високий рівень кальцію у крові (гіперкальціємія)
- Високий рівень тригліцеридів у крові (гіпертригліцеридемія)
- Порушення електролітного балансу (гіпонатріємія)
Не дуже часті: можуть стосуватися 1 з 100 осіб
- Високий рівень ліпідів у крові (гіперліпідемія)
- Стан, при якому жовч не може протікати з печінки у дванадцятипалу кишку (холестаз). Дванадцятипала кишка є частиною кишечника.
Невідома: частота не може бути встановлена на основі доступних даних(Ці неприємні реакції були повідомлені лише після периферійного введення препарату NUMETA G13%E Preterm та NUMETA G16%E при недостатньому розведенні).
- Мертвіння шкіри
- Ушкодження м'яких тканин
- Виникнення кровоносних судин
Наступні неприємні реакції були повідомлені для інших препаратів парентерального харчування:
Зниження або обмеження здатності до виведення ліпідів, що містяться у препараті NUMETA, може призвести до утворення синдрому переантаження жирами. Наступні ознаки та симптоми цього синдрому зазвичай проходять після припинення інфузії жирової емульсії:
- Раптове та гостре погіршення стану дитини
- Високий рівень жиру у крові (гіперліпідемія)
- Гарячка
- Збільшення печінки (гепатомегалія)
- Погіршення функції печінки
- Зниження кількості червоних кров'яних тілець, яке може призвести до блідості шкіри та бути причиною слабкості або задухи (анемія)
- Зниження кількості білих кров'яних тілець, яке може збільшити ризик інфекції (лейкопенія)
- Зниження кількості кров'яних пластинок, яке може збільшити ризик утворення синяків та (або) кровотеч (тромбоцитопенія)
- Порушення згортання крові, яке впливає на здатність крові до утворення згустку
- Порушення дихання, яке призводить до зменшення кількості кисню в організмі (дихальна недостатність)
- Стани, які призводять до збільшення кислотності крові (кислотний стан)
- Кома, яка потребує госпіталізації
Утворення малих частинок, які можуть призвести до блокування кровоносних судин у легенях (осад у легеневих судинах) або труднощі з диханням.
Повідомлення про неприємні реакції
Якщо у дитини з'являються будь-які неприємні симптоми, потрібно звернутися до лікаря або медсестри.
Це стосується також усіх неприємних симптомів, не перелічених у цій брошурі.
Неприємні реакції можна повідомляти безпосередньо до Департаменту моніторингу неприємних реакцій лікарських засобів Міністерства охорони здоров'я України
вул. Миколи Амосова, 7
04053, м. Київ
Телефон: +38 (044) 206-20-44
Факс: +38 (044) 206-20-44
Адреса електронної пошти: [[email protected]](mailto:[email protected])
Неприємні реакції можна повідомляти також відповідальній особі.
Повідомлення про неприємні реакції дозволить зібрати більше інформації про безпеку застосування препарату.
5. Як зберігати препарат NUMETA G16%E
Препарат потрібно зберігати в місці, недоступному для дітей, коли він не вводиться.
У разі застосування у новонароджених та дітей до 2 років розчин (у мішках та наборах для введення) потрібно захистити від світла до закінчення введення (див. пункт 2).
Не застосовуйте цей препарат після закінчення терміну придатності, вказаного на мішку та зовнішньому пакуванні (MM/RRRR). Термін придатності означає останній день вказаного місяця.
Не заморожуйте.
Зберігайте у захисному мішку.
Препарати не потрібно викидати у каналізацію або домашні контейнери для відходів. Зверніться до фармацевта, щоб дізнатися, як видалити препарати, які вже не використовуються. Таке поводження допоможе захистити навколишнє середовище.
6. Зміст пакування та інші відомості
Як виглядає препарат NUMETA G16%E та що містить пакування
Препарат NUMETA міститься у трикамерному мішку. Зміст кожного мішка є стерильним і складається з розчину глюкози, розчину амінокислот для дітей з електролітами та жирової емульсії, згідно з нижчезгаданим описом.
| Об'єм контейнера | 50% розчин глюкози | 5,9% розчин амінокислот з електролітами | 12,5% жирова емульсія |
| 500 мл | 155 мл | 221 мл | 124 мл |
Вигляд до підготовки:
- Розчини у камерах, що містять амінокислоти та глюкозу, є прозорими, безбарвними або легенько жовтуватими
- Камера з жировою емульсією є однорідним та молочнобілим рідиною Вигляд після підготовки:
- Розчини для інфузії «2 у 1» є прозорими, безбарвними або легенько жовтуватими
- Емульсія для інфузії «3 у 1» є однорідною та молочнобілою
Трійкамерний мішок є багатошаровим пластиковим мішком.
Щоб захистити від контакту з повітрям, мішок NUMETA пакується у захисний мішок, який захищає від доступу кисню, та містить поглинач кисню та індикатор кисню.
Об'єм пакувань
мішки 500 мл: 6 мішків у картонній коробці
1 мішок 500 мл
Не всі типи пакувань повинні бути в обігу.
Відповідальна особа та виробник
Відповідальна особа
Baxter Polska Sp. z o.o.
вул. Кручиковського, 8
00-380 Варшава
Виробник
Baxter S.A.
Бульвар Рене Бранквар, 80
7860 Лессін
Бельгія
Цей лікарський засіб дозволений до обігу в країнах-членах Європейського економічного простору під наступними назвами:
| Австрія Німеччина | Numeta G 16 % E Emulsion zur Infusion |
| Бельгія Люксембург | NUMETZAH G16%E, émulsion pour perfusion |
| Франція | NUMETAH G16 %E, émulsion pour perfusion |
| Данія Норвегія Швеція | Numeta G16E |
| Чехія Греція | NUMETA G 16 % E |
| Нідерланди | NUMETA G16%E emulsie voor infusie |
| Ірландія Велика Британія | Numeta G16%E, Emulsion for Infusion |
| Італія | NUMETA G16%E emulsione per infusione |
| Фінляндія | Numeta G16E infuusioneste, emulsio |
| Польща | NUMETA G16%E |
| Португалія | Numeta G16%E |
| Іспанія | NUMETA G16%E, emulsión para perfusión |
Дата останньої актуалізації брошури: Травень 2024 --------------------------------------------------------------------------------------------------------------------
Інформація, призначена лише для фахівців медичного персоналу або працівників служби охорони здоров'я*
*У деяких випадках цей препарат може бути введений вдома батьками або іншими опікунами.
У таких випадках батьки/опікуни повинні прочитати нижчезгадані відомості.
Не потрібно вводити до мішка додаткові компоненти без попередньої перевірки їх сумісності.
Це може призвести до утворення твердих частинок або дестабілізації жирової емульсії. Це може призвести до закупорки вен.
Препарат NUMETA G16%E повинен досягти кімнатної температури перед застосуванням.
Перед введенням препарату NUMETA G16%E мішок потрібно підготувати, як показано нижче.
Необхідно переконатися, що мішок не пошкоджений. Мішок можна використовувати лише якщо він не пошкоджений. Нижче перелічені ознаки неушкодженого мішка:
- Перегородки цілі. Це вказує на відсутність змішання вмісту будь-якої з трьох камер.
- Розчини, що містять амінокислоти та глюкозу, є прозорими, безбарвними або легенько жовтуватими, без видимих частинок.
- Жирова емульсія є однорідним рідиною з молочнобілим виглядом.
Перед відкриттям захисного мішка потрібно перевірити колір поглинача кисню.
- Необхідно порівняти його з колором зразка, надрукованого поруч із символом OK та показаного на друкуваній частині етикетки індикатора.
- Не потрібно застосовувати препарат, якщо колір індикатора кисню не відповідає колору зразка, надрукованого поруч із символом OK.
Рисунки 1 та 2 показують, як зняти захисний мішок. Викинути захисний мішок, індикатор кисню та поглинач кисню.













Рисунок 1
Рисунок 2
Підготовка змішаної емульсії:
- Перед розриванням швів потрібно переконатися, що препарат має кімнатну температуру.
- Помістіть мішок на пласку, чисту поверхню.
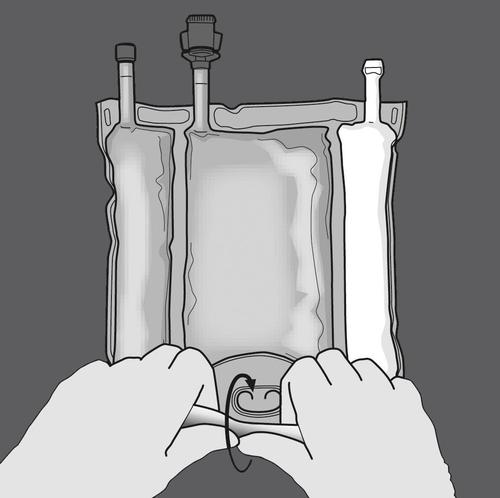
Активація трикамерного мішка (змішання 3 розчинів шляхом відкриття двох розривних швів)
Крок 1: Звивання мішка потрібно починати зі сторони з кронштейном.
Крок 2: Тисніть, поки не відкриються шви.
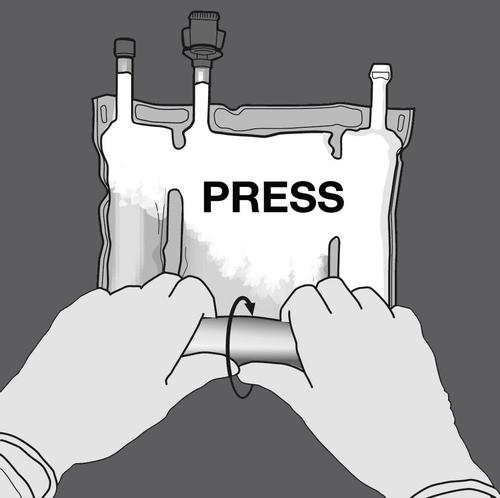
ТИСНІТЬ
Крок 3: Змініть напрямок, звиваємо мішок у напрямку до трубок.
Продовжуйте до повного відкриття шву.
Повторіть те саме для повного відкриття другого шву.
ТИСНІТЬ

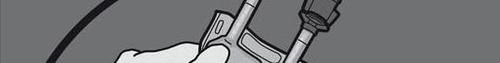
Крок 4: Оберніть мішок щонайменше три рази, щоб добре перемішати вміст.
Змішаний розчин повинен мати вигляд молочнобілого осаду.







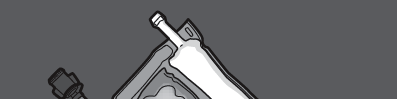
Крок 5: Видаліть захисний затик з місця введення препарату та введіть набір для внутрішньовенної інфузії.








Активація двокамерного мішка (змішання 2 розчинів шляхом відкриття розривного шву між камерами, що містять амінокислоти та глюкозу)
Крок 1: Щоб змішати лише 2 розчини, звивайте мішок, починаючи від верхнього кута (з кронштейном) біля шву, що розділяє розчини.
Тисніть, щоб відкрити шов, що розділяє відділи з глюкозою та амінокислотами.
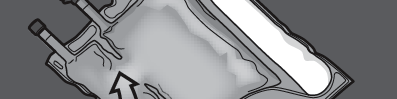
ТИСНІТЬ

НАТИСНІТИ


Крок 5: Повернути мішок щонайменше три рази, щоб точно змішати вміст.
Змішаний розчин повинен бути прозорим, безбарвним або легенько жовтим.







Крок 6: Вилучити захисний ковпачок з місця введення лікарського засобу та ввести набір для внутрішньовенного введення.
У першій годині швидкість потоку повинна поступово збільшуватися. Швидкість введення лікарського засобу повинна бути відкоригована на підставі нижченаведених факторів:








- введеної дози
- прийманої добової кількості
- тривалості інфузії.
Спосіб введення:
У разі застосування у новонароджених та дітей до 2 років розчин (у мішках та наборах для введення) повинен бути захищений від світла до закінчення введення.
Для введення лікарського засобу NUMETA G16%E рекомендується використовувати фільтр 1,2 мкм.
Через велику осмолярність нерозведеного лікарського засобу NUMETA G16%E можна вводити лише через центральну вену. Відповідне розведення лікарського засобу NUMETA G16%E водою для ін'єкцій зменшує осмолярність та дозволяє інфузію в периферичну судину.
Нижченаведена формула показує вплив розведення на осмолярність лікарського засобу.
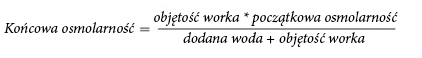
У нижченаведеній таблиці показані приклади осмолярності активованого двокамерного мішка та активованого трикамерного мішка після додавання води для ін'єкцій:
| Амінокислоти та глюкоза (активований W2K) | Амінокислоти, глюкоза та ліпіди (активований W3K) | |
| Початковий об'єм у мішку (мл) | 376 | 500 |
| Початкова осмолярність (мОсм/л приблизно) | 1585 | 1230 |
| Об'єм доданої води (мл) | 376 | 500 |
| Кінцевий об'єм після додавання (мл) | 752 | 1000 |
| Осмолярність після додавання (мОсм/л приблизно) | 792,5 | 615 |
Введення додаткових складників:
Експозиція світлу розчинів для парентерального харчування, особливо після змішування з мікроелементами та (або) вітамінами, може мати несприятливий вплив на клінічні результати у новонароджених через утворення надокисів та інших продуктів деградації. У разі застосування у новонароджених та дітей до 2 років лікарський засіб NUMETA G16%E повинен бути захищений від світла оточення до закінчення введення.
Додаткові складники, які показали сумісність, можуть бути додані до відновленої суміші через місце для ін'єкції (після відкриття розривних швів та після змішування вмісту двох або трьох камер).
Вітаміни також можуть бути додані до камери, яка містить глюкозу, до відновлення суміші (до відкриття розривних швів та до змішування розчинів та емульсій).
Можливі добавки готових розчинів мікроелементів (ідентифіковані як TE1, TE2 та TE4), вітамінів (ідентифіковані як ліофілізат V1 та емульсія V2) та електролітів у певних кількостях показані в Таблицях 1-6.
- 1.Сумісність з TE4, V1 та V2
Таблиця 1: Сумісність 3-в-1 (активований W3K) з розведенням водою та без розведення
| На 500 мл (після змішування 3 камер, з ліпідами) | ||||||
| Додаток без розведення | Додаток з розведенням | |||||
| Додаткові складники | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість |
| Натрій (ммоль) | 12,0 | 25,6 | 37,6 | 12,0 | 25,6 | 37,6 |
| Калій (ммоль) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
| Магній (ммоль) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
| Кальцій (ммоль) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
| Фосфати* (ммоль) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
| Мікроелементи та вітаміни | 10 мл TE4 + 1 флакон V1 + 30 мл V2 | 10 мл TE4 + 1 флакон V1 + 30 мл V2 | 5 мл TE4 + ½ флакона V1 + 5 мл V2 | 5 мл TE4 + ½ флакона V1 + 5 мл V2 | ||
| Вода для ін'єкцій | 350 мл | 350 мл | ||||
Таблиця 2: Сумісність 2-в-1 (активований W2K) з розведенням водою та без розведення
| На 376 мл (після змішування 2 камер, без ліпідів) | ||||||
| Додаток без розведення | Додаток з розведенням | |||||
| Додаткові складники | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість |
| Натрій (ммоль) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Калій (ммоль) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Магній (ммоль) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Кальцій (ммоль) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Фосфати* (ммоль) | 3,2 |
| 11,3 | 3,2 | 0,0 | 3,2 |
| Мікроелементи та вітаміни | 5 мл TE4 + ½ флакона V1 | 5 мл TE4 + ½ флакона V1 | 5 мл TE4 + ½ флакона V1 | 5 мл TE4 + ½ флакона V1 | ||
| Вода для ін'єкцій | 450 мл | 450 мл | ||||
- 2.Сумісність з TE1, V1 та V2Таблиця 3: Сумісність 3-в-1 (активований W3K) з розведенням водою та без розведення
| На 500 мл (після змішування 3 камер, з ліпідами) | ||||||
| Додаток без розведення | Додаток з розведенням | |||||
| Додаткові складники | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість |
| Натрій (ммоль) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Калій (ммоль) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Магній (ммоль) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Кальцій (ммоль) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Фосфати* (ммоль) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Мікроелементи та вітаміни | 5 мл TE1 + ½ флакона V1 + 5 мл V2 | 5 мл TE1 + ½ флакона V1 + 5 мл V2 | 5 мл TE1 + ½ флакона V1 + 5 мл V2 | 5 мл TE1 + ½ флакона V1 + 5 мл V2 | ||
| Вода для ін'єкцій | 350 мл | 350 мл | ||||
Таблиця 4: Сумісність 2-в-1 (активований W2K) з розведенням водою та без розведення
| На 376 мл (після змішування 2 камер, без ліпідів) | ||||||
| Додаток без розведення | Додаток з розведенням | |||||
| Додаткові складники | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість |
| Натрій (ммоль) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Калій (ммоль) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Магній (ммоль) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Кальцій (ммоль) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Фосфати* (ммоль) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Мікроелементи та вітаміни | 5 мл TE1 + ½ флакона V1 | 5 мл TE1 + ½ флакона V1 | 5 мл TE1 + ½ флакона V1 | 5 мл TE1 + ½ флакона V1 | ||
| Вода для ін'єкцій | 450 мл | 450 мл | ||||
- 3.Сумісність з TE2, V1 та V2Таблиця 5: Сумісність 3-в-1 (активований W3K) з розведенням водою та без розведення
| На 500 мл (після змішування 3 камер, з ліпідами) | ||||||
| Додаток без розведення | Додаток з розведенням | |||||
| Додаткові складники | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість |
| Натрій (ммоль) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Калій (ммоль) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Магній (ммоль) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Кальцій (ммоль) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Фосфати* (ммоль) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Мікроелементи та вітаміни | 5 мл TE2 + ½ флакона V1 + 5 мл V2 | 5 мл TE2 + ½ флакона V1 + 5 мл V2 | 5 мл TE2 + ½ флакона V1 + 5 мл V2 | 5 мл TE2 + ½ флакона V1 + 5 мл V2 | ||
| Вода для ін'єкцій | 350 мл | 350 мл | ||||
Таблиця 6: Сумісність 2-в-1 (активований W2K) з розведенням водою та без розведення
| На 376 мл (після змішування 2 камер, без ліпідів) | ||||||
| Додаток без розведення | Додаток з розведенням | |||||
| Додаткові складники | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість | Змішана кількість | Максимальна додана кількість | Максимальна загальна кількість |
| Натрій (ммоль) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Калій (ммоль) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Магній (ммоль) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Кальцій (ммоль) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Фосфати* (ммоль) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Мікроелементи та вітаміни | 5 мл TE2 + ½ флакона V1 | 5 мл TE2 + ½ флакона V1 | 5 мл TE2 + ½ флакона V1 | 5 мл TE2 + ½ флакона V1 | ||
| Вода для ін'єкцій | 450 мл | 450 мл | ||||
Склад препаратів, що містять вітаміни та мікроелементи, показаний у Таблицях 7 та 8.
Таблиця 7: Склад використаного готового препарату, що містить мікроелементи:
| Склад на флакон 10 мл | TE1 | TE2 | TE4 |
| Залізо | 8,9 мкмоль або 0,5 мг | ||
| Цинк | 38,2 мкмоль або 2,5 мг | 15,3 мкмоль або 1 мг | 15,3 мкмоль або 1 мг |
| Селен | 0,253 мкмоль або 0,02 мг | 0,6 мкмоль або 0,05 мг | 0,253 мкмоль або 0,02 мг |
| Мідь | 3,15 мкмоль або 0,2 мг | 4,7 мкмоль або 0,3 мг | 3,15 мкмоль або 0,2 мг |
| Йод | 0,0788 мкмоль або 0,01 мг | 0,4 мкмоль або 0,05 мг | 0,079 мкмоль або 0,01 мг |
| Фтор | 30 мкмоль або 0,57 мг | 26,3 мкмоль або 0,5 мг | |
| Молібден | 0,5 мкмоль або 0,05 мг | ||
| Манган | 0,182 мкмоль або 0,01 мг | 1,8 мкмоль або 0,1 мг | 0,091 мкмоль або 0,005 мг |
| Кобальт | 2,5 мкмоль або 0,15 мг | ||
| Хром | 0,4 мкмоль або 0,02 мг 18 |
Таблиця 8: Склад використаного готового препарату, що містить вітаміни:
Введення додаткових складників:
- Повинні бути дотримані асептичні умови.
- Підготувати місце для ін'єкції до мішка.
- Проколити місце для ін'єкції та ввінчити додаткові складники за допомогою голки для ін'єкцій або пристрою для підготовки лікарського засобу.
- Змішати вміст мішка з додатковими складниками.
Підготовка інфузії:
- Повинні бути дотримані асептичні умови.
- Завісити мішок.
- Вилучити пластиковий захисник з порту для введення лікарського засобу.
- З рішучим рухом ввінчити голку інфузійного набору в порт для введення лікарського засобу.
Введення інфузії:
- Тільки для одноразового використання.
- Вводити лікарський засіб тільки після розриву швів між двома або трьома камерами та змішування вмісту двох або трьох камер.
- Повинно бути забезпечено, щоб у готовій емульсії активованого трикамерного мішка для інфузії не відбувалося розділення фаз або у готовому розчині двокамерного мішка для інфузії не було жодних твердих частинок.
- Рекомендується негайне використання після відкриття розривних швів. Лікарського засобу NUMETA G16%E не слід зберігати для наступної інфузії.
- Не підключати частково використані мішки.
- Для уникнення утворення повітряної емболії, спричиненої залишковим повітрям у першому мішку, не підключайте мішки послідовно.
- Для введення лікарського засобу NUMETA G16%E рекомендується використовувати фільтр 1,2 мкм.
- У разі застосування у новонароджених та дітей до 2 років лікарський засіб NUMETA G16%E повинен бути захищений від світла до закінчення введення. Експозиція лікарського засобу NUMETA G16%E на світло оточення, особливо після змішування з мікроелементами та (або) вітамінами, може спричинити утворення надокисів та інших продуктів деградації, що можна зменшити шляхом захисту від світла.
- Всі залишки невикористаного лікарського засобу або його відходи та весь необхідний набір для одноразового використання повинні бути видалені у відповідний спосіб.
| Склад на флакон | V1 | V2 |
| Вітамін B1 | 2,5 мг | |
| Вітамін B2 | 3,6 мг | |
| Нікотинамід | 40 мг | |
| Вітамін B6 | 4,0 мг | |
| Пантотенова кислота | 15,0 мг | |
| Біотин | 60 мкг | |
| Фолієва кислота | 400 мкг | |
| Вітамін B12 | 5,0 мкг | |
| Вітамін C | 100 мг | |
| Вітамін A | 2300 МО | |
| Вітамін D | 400 МО | |
| Вітамін E | 7 МО | |
| Вітамін K | 200 мкг |
Строк придатності після змішування розчинів:
Лікарський засіб повинен бути використаний негайно після відкриття розривних швів між двома або трьома камерами.
Дослідження стабільності сумішей проводилися протягом 7 днів при температурі від 2°C до 8°C, а потім протягом 48 годин при температурі 30°C.
Строк придатності після введення додаткових складників (електролітів, мікроелементів, вітамінів, води)
Для певних додаткових складників була показана фізична стабільність лікарського засобу NUMETA протягом 7 днів при температурі від 2°C до 8°C, а потім протягом 48 годин при температурі 30°C.
З мікробіологічної точки зору лікарський засіб повинен бути використаний негайно. Якщо такий лікарський засіб не буде використаний негайно, відповідальність за час і умови зберігання до моменту його застосування лежить на користувачі, однак стандартно не слід перевищувати 24 години при температурі від 2°C до 8°C, якщо підготовка/розведення/введення додаткових складників відбулося в контрольованих та валідованих асептичних умовах.
Не застосовувати лікарський засіб NUMETA G16%E, якщо мішок пошкоджений. Нижче наведені характеристики пошкодженого мішка:
- Розривні шви відкриті
- Хоча б одна з камер містить суміш розчинів
- Розчини, що містять амінокислоти та глюкозу, не є прозорими, безбарвними або легенько жовтими та (або) містять видимі частинки
- Ліпідна емульсія не є однорідною рідиною з молочним виглядом.
Лікарських засобів не слід викидати у каналізацію чи домашні контейнери для відходів. Слід запитати фармацевта, що зробити з лікарськими засобами, яких вже не потрібно. Таке поводження допоможе захистити навколишнє середовище.
Що містить лікарський засіб NUMETA G16%E
Активні речовини:
| Склад | ||
| Активна речовина | Активований W2K (376 мл) | Активований W3K (500 мл) |
| Камера з амінокислотами | ||
| Аланін | 1,03 г | 1,03 г |
| Аргінін | 1,08 г | 1,08 г |
| Кислота аспарагінова | 0,77 г | 0,77 г |
| Цистеїн | 0,24 г | 0,24 г |
| Кислота глутамінова | 1,29 г | 1,29 г |
| Гліцин | 0,51 г | 0,51 г |
| Гістидин | 0,49 г | 0,49 г |
| Ізолейцин | 0,86 г | 0,86 г |
| Лейцин | 1,29 г | 1,29 г |
| Лізин моногідрат (що відповідає лізину) | 1,59 г (1,42 г) | 1,59 г (1,42 г) |
| Метіонін | 0,31 г | 0,31 г |
| Орнітин хлорид (що відповідає орнітину) | 0,41 г (0,32 г) | 0,41 г (0,32 г) |
| Фенілаланін | 0,54 г | 0,54 г |
| Пролін | 0,39 г | 0,39 г |
| Серін | 0,51 г | 0,51 г |
| Таурин | 0,08 г | 0,08 г |
| Треонін | 0,48 г | 0,48 г |
| Триптофан | 0,26 г | 0,26 г |
| Тирозин | 0,10 г | 0,10 г |
| Валін | 0,98 г | 0,98 г |
| Хлорид натрію | 0,30 г | 0,30 г |
| Оцтат калію | 1,12 г | 1,12 г |
| Хлорид кальцію дигідрат | 0,46 г | 0,46 г |
| Оцтат магнію тетрагідрат | 0,33 г | 0,33 г |
| Гліцерофосфат натрію моногідрат | 0,98 г | 0,98 г |
| Камера з глюкозою | ||
| Глюкоза моногідрат (що відповідає глюкозі безводній) | 85,25 г (77,50 г) | 85,25 г (77,50 г) |
| Камера з ліпідами | ||
| Очищена оливкова олія (близько 80%) + очищена сояна олія (близько 20%) | 15,5 г | |
Розчин після змішування/емульсія містить наступні складники:
| Склад | ||||
| Активований W2K | Активований W3K | |||
| На одиницю об'єму (мл) Азот (г) Амінокислоти (г) Глюкоза (г) Ліпіди (г) Енергетична цінність Загальна енергетична цінність (ккал) Енергетична цінність не білкової (ккал) Енергетична цінність глюкози (ккал) Енергетична цінність ліпідів (ккал) Енергетична цінність не білкової/азот (ккал/г Н) Енергетична цінність ліпідів/енергетична цінність не білкової (%) Енергетична цінність ліпідів/загальна енергетична цінність (%) | 376 2,0 13,0 77,5 0 362 310 310 0 158 Не дот. Не дот. | 100 0,52 3,5 20,6 0 96 82 82 0 158 Не дот. Не дот. | 500 2,0 13,0 77,5 15,5 517 465 310 155 237 33 30 | 100 0,39 2,6 15,5 3,1 103 93 62 31 237 33 30 |
| Оцтати (ммоль) Яблучні кислоти (ммоль) Хлориди (ммоль) | 14,5 4,3 13,8 | 3,9 1,1 3,7 | 14,5 4,3 13,8 | 2,9 0,86 2,8 |
| pH (приблизно) Осмолярність (приблизно) (мОсм/л) | 5,5 1585 | 5,5 1585 | 5,5 1230 | 5,5 1230 |
У цьому значення енергетичної цінності фосфоліпідів з курячого яйця для ін'єкцій.
У цьому фосфати з фосфоліпідів з курячого яйця для ін'єкцій, що є складником ліпідної емульсії.
Інші складники:
Яблучна кислота
Соляна кислота
Фосфоліпіди з курячого яйця для ін'єкцій
Гліцерол
Олеат натрію
Гідроксид натрію
Вода для ін'єкцій для встановлення pH
Baxter, Numeta, Numetzah та Numetah є торговими марками Baxter International Inc.
- Країна реєстрації
- Діючі речовини
- Потрібен рецептТак
- Виробник
- ІмпортерBaxter S.A.
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до Нумета Г16%еФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецептФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецептФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецепт
Аналоги Нумета Г16%е в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Нумета Г16%е у Испания
Аналог Нумета Г16%е у Украина
Лікарі онлайн щодо Нумета Г16%е
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Нумета Г16%е – за рішенням лікаря та згідно з місцевими правилами.














