
Кабівен
Запитайте лікаря про рецепт на Кабівен

Інструкція із застосування Кабівен
Укладення до пакування: інформація для користувача
КабIVEN, емульсія для інфузії
Перш ніж використовувати препарат, уважно ознайомтеся з вмістом цієї брошури, оскільки вона містить
важливу інформацію для пацієнта.
- Збережіть цю брошуру, щоб у разі потреби ви могли її знову прочитати.
- Якщо у вас виникли будь-які сумніви, зверніться до лікаря, фармацевта або медсестри.
- Цей препарат призначений лише для певної особи. Не передавайте його іншим. Препарат може нашкодити іншій особі, навіть якщо симптоми її хвороби такі самі.
- Якщо в пацієнта виникнуть будь-які побічні ефекти, включаючи будь-які побічні ефекти, не перераховані в цій брошурі, повідомте про це лікаря, фармацевта або медсестру. Див. пункт 4.
Зміст брошури
- 1. Що таке КабIVEN і для чого його використовують
- 2. Інформація, яку потрібно знати до використання препарату КабIVEN
- 3. Як використовувати КабIVEN
- 4. Можливі побічні ефекти
- 5. Як зберігати КабIVEN
- 6. Зміст пакування та інші відомості
1. Що таке КабIVEN і для чого його використовують
КабIVEN - це препарат, який містить: амінокислоти (компоненти, необхідні для створення білків), жири, глюкозу та електроліти. Він забезпечує внутрішньовенне введення енергії (з цукру та жирів) та амінокислот, коли пероральне харчування неможливе, недостатнє або протипоказане. КабIVEN показаний для використання як складник комплексної парентеральної дієти, разом з солями, мікроелементами та вітамінами.
2. Інформація, яку потрібно знати до використання препарату КабIVEN
Коли не використовувати препарат КабIVEN
Не використовувати препарат:
- якщо пацієнт має алергію(гіперчутливість) на КабIVEN, на активні речовини або на будь-який з інших компонентів цього препарату (перелічених у пункті 6);
- якщо пацієнт має алергію (гіперчутливість) на яйця, сою або арахіс;
- якщо у пацієнта спостерігається зbyt висока концентрація жирів(наприклад, холестерину) в крові;
- якщо пацієнт має важку хворобу печінки;
- якщо у пацієнта спостерігається гострий шок(спровокований втратою великої кількості крові або алергією);
- якщо пацієнт має розлади згортання крові(гемофагоцитарний синдром) або якщо кров не згортається正常но;
- якщо пацієнт має розлади метаболізму білків або амінокислот;
- якщо пацієнт має важку хворобу нирок;
- якщо пацієнт має гіперглікемію (зbyt велика кількість цукру в крові), яка вимагає введення більше ніж 6 одиниць інсуліну на годину;
- якщо пацієнт має підвищену концентрацію електролітів(солей) в крові;
- якщо пацієнт має метаболічний ацидоз(накопичення в крові та тканинах надмірної кількості кислоти);
- якщо пацієнт має зbyt велику кількість рідинив організмі (гіперволемія);
- якщо пацієнт має рідину в легенях(гострий пульмонічний едема);
- якщо пацієнт знаходиться в комі;
- якщо пацієнт має проблеми з серцем;
- якщо пацієнт дегідратованийта має низьку концентрацію солей;
- якщо у пацієнта спостерігається важка системна запальна реакція(стан, при якому в організмі спостерігається важка інфекція).
Не використовувати препарат КабIVEN у новонароджених та дітей віком до 2 років.
Остеріження та заходи обережності
Повідомте лікаря, якщо у пацієнта спостерігаються:
- розлади функції печінки;
- не лікована цукровий діабет;
- розлади метаболізму жирів;
- хвороби нирок;
- будь-які захворювання підшлункової залози;
- хвороби щитоподібної залози- гіпотиреоз;
- системна запальна реакція(стан, при якому в організмі спостерігається інфекція);
- розлади виведення електролітів з організму;
- недостатнє забезпечення клітин киснем;
- збільшена осмолярність сироватки.
Якщо під час інфузії спостерігається гарячка, висип, озноб або труднощі з диханням, негайно повідомте про це медичний персонал. Ці симптоми можуть бути спричинені алергічною реакцією або введенням надмірної дози препарату (див. пункт 4). Цей препарат може впливати на результати деяких аналізів. Повідомте лікаря про використання цього препарату перед проведенням аналізу. Лікар може призначити регулярне проведення аналізу крові, щоб підтвердити правильну дію препарату КабIVEN.
КабIVEN та інші препарати
Повідомте лікаря або медсестру про всі препарати, які зараз приймає пацієнт, а також про препарати, які пацієнт планує використовувати. Повідомте лікаря, якщо пацієнт приймає:
- гепарин - препарат, який запобігає утворенню тромбів та допомагає в їх розчиненні;
- варфарин, оскільки вітамін К, який міститься в соєвій олії, може впливати на здатність крові згортатися;
- інсулін - препарат, який використовується для лікування цукрового діабету.
Вагітність і годування грудьми
Якщо пацієнтка вагітна або годує грудьми, підозрює, що може бути вагітна або планує мати дитину, вона повинна проконсультуватися з лікарем або фармацевтом перед використанням цього препарату. Відсутні дані про використання препарату КабIVEN у вагітних жінок або під час годування грудьми. Якщо введення парентерального харчування (позажелудкового) є необхідним у вагітних жінок або під час годування грудьми, лікар буде використовувати КабIVEN тільки після ретельного розгляду переваг і ризику.
3. Як використовувати КабIVEN
КабIVEN вводиться виключно в центральну вену. Дозування та об'єм введеного пакування визначаються залежно від маси тіла пацієнта та його здатності метаболізувати жири та цукри. КабIVEN вводиться повільною інфузією тривалістю від 12 до 24 годин. Дозування визначається лікарем індивідуально для кожного пацієнта. Медичний персонал може контролювати стан здоров'я пацієнта під час лікування. Не використовувати препарат КабIVEN у новонароджених та дітей віком до 2 років.
Введення більшої, ніж рекомендована, дози препарату КабIVEN
Мало ймовірно, щоб пацієнт отримав надмірну дозу препарату КабIVEN, оскільки препарат вводиться кваліфікованим медичним персоналом. Симптомами передозування є нудота, блювота, надмірна потливість та затримка рідини в організмі. Також спостерігаються гіперглікемія (зbyt велика кількість цукру в крові) та розлади електролітного балансу. При передозуванні існує ризик прийому надмірної кількості жирів. Цей симптом називається "синдромом передозування жирів". Для отримання детальної інформації див. пункт 4. Можливі побічні ефекти. Якщо пацієнт помічає вищезазначені симптоми або вважає, що отримав більшу, ніж рекомендована, дозу препарату КабIVEN, він повинен негайно повідомити про це лікаря або медсестру. Вони можуть зменшити швидкість інфузії або припинити її. Усі ці симптоми зазвичай проходять або зменшуються після припинення інфузії. У разі будь-яких подальших сумнівів, пов'язаних з використанням цього препарату, зверніться до лікаря, медсестри або фармацевта.
4. Можливі побічні ефекти
Як і будь-який препарат, цей препарат може спричиняти побічні ефекти, хоча не у всіх пацієнтів вони спостерігаються.
Дуже рідко (рідше, ніж у 1 з 10 000 пацієнтів) КабIVEN може спричиняти алергію (гіперчутливість). Негайно повідомте лікаря про появу:
- гузкової та сверблячої висипи на тілі;
- дуже високої температури;
- труднощів з диханням.
Часто спостерігаються побічні ефекти (рідше, ніж у 1 з 10 пацієнтів, але частіше, ніж у 1 з 100 пацієнтів):
- підвищення температури тіла.
Не дуже часто спостерігаються побічні ефекти (рідше, ніж у 1 з 100 пацієнтів, але частіше, ніж у 1 з 1000 пацієнтів):
- озноб;
- втома;
- болі в животі;
- головні болі;
- нудота;
- блювота;
- збільшення активності ферментів печінки. Лікар повідомить пацієнта про появу цього побічного ефекту.
Інші побічні ефекти спостерігаються дуже рідко (рідше, ніж у 1 з 10 000 пацієнтів):
- підвищення або зниження артеріального тиску;
- прискорене дихання;
- тривала, болюча ерекція у чоловіків;
- розлади згортання крові.
Синдром передозування жирів
Синдром передозування жирів спостерігається, коли організм має проблему з метаболізмом жирів у зв'язку з отриманням надмірної кількості препарату КабIVEN. Він також може спостерігатися через раптову зміну стану здоров'я пацієнта (наприклад, проблеми з нирками або інфекція). Можливі симптоми - гарячка, збільшена кількість жирів у крові, клітинах та тканинах, розлади функції багатьох органів та кома. Усі ці симптоми зазвичай проходять після припинення інфузії.
Звітність про побічні ефекти
Якщо спостерігаються будь-які побічні ефекти, включаючи будь-які побічні ефекти, не перераховані в цій брошурі, повідомте про це лікаря, фармацевта або медсестру. Побічні ефекти можна повідомляти безпосередньо до Департаменту моніторингу небажаних дій лікарських засобів Міністерства охорони здоров'я України
вул. Хмельницького, 14-16, м. Київ, 01001
телефон: +38 (044) 279-16-16, факс: +38 (044) 279-16-17
електронна пошта: [[email protected]](mailto:[email protected])
веб-сайт: https://adverse-event.moz.gov.ua/
Побічні ефекти також можна повідомляти відповідальному суб'єкту. Завдяки повідомленню про побічні ефекти можна буде зібрати більше інформації про безпеку використання препарату.
5. Як зберігати КабIVEN
Препарат повинен зберігатися в місці, недоступному для дітей.
Лікар або фармацевт відповідають за забезпечення належних умов зберігання, використання та утилізації препарату КабIVEN. Не зберігати при температурі вище 25°C. Зберігати у зовнішньому пакуванні. Не заморожувати. Не використовувати препарат після закінчення терміну придатності, вказаного на пакуванні. Не використовувати, якщо пакування пошкоджено. Для одноразового використання. Не використана частина препарату не підходить для подальшого використання.
6. Зміст пакування та інші відомості
Що містить КабIVEN
КабIVEN доступний у трикамерних пакетах. Пакети з трьома камерами виготовляються у чотирьох об'ємах. Кожен трикамерний пакет містить наступні різні об'єми компонентів: Відповідає наступним складам:
| 2566 мл | 2053 мл | 1540 мл | 1026 мл | |
| глюкоза 19% | 1316 мл | 1053 мл | 790 мл | 526 мл |
| розчин амінокислот з електролітами | 750 мл | 600 мл | 450 мл | 300 мл |
| жирина емульсія (Intralipid 20%) | 500 мл | 400 мл | 300 мл | 200 мл |
| Активні речовини: | 2566 мл | 2053 мл | 1540 мл | 1026 мл |
| очищена соєва олія | 100 г | 80 г | 60 г | 40 г |
| глюкоза моногідратна, що відповідає глюкозі безводній | 275 г 250 г | 220 г 200 г | 165 г 150 г | 110 г 100 г |
| аланін | 12,0 г | 9,6 г | 7,2 г | 4,8 г |
| аргінін | 8,5 г | 6,8 г | 5,1 г | 3,4 г |
| аспарагінова кислота | 2,6 г | 2,0 г | 1,5 г | 1,0 г |
| глутамінова кислота | 4,2 г | 3,4 г | 2,5 г | 1,7 г |
| гліцин (амінооктанова кислота) | 5,9 г | 4,7 г | 3,6 г | 2,4 г |
| гістидин | 5,1 г | 4,1 г | 3,1 г | 2,0 г |
| ізолейцин | 4,2 г | 3,4 г | 2,5 г | 1,7 г |
| лейцин | 5,9 г | 4,7 г | 3,6 г | 2,4 г |
| лізин гідрохлорид, що відповідає лізину безводному | 8,5 г 6,8 г | 6,8 г 5,4 г | 5,1 г 4,1 г | 3,4 г 2,7 г |
| метіонін | 4,2 г | 3,4 г | 2,5 г | 1,7 г |
| фенілаланін | 5,9 г | 4,7 г | 3,6 г | 2,4 г |
| пролін | 5,1 г | 4,1 г | 3,1 г | 2,0 г |
| серин | 3,4 г | 2,7 г | 2,0 г | 1,4 г |
| треонін | 4,2 г | 3,4 г | 2,5 г | 1,7 г |
| триптофан | 1,4 г | 1,1 г | 0,86 г | 0,57 г |
| тірозин | 0,17 г | 0,14 г | 0,10 г | 0,07 г |
| валін | 5,5 г | 4,4 г | 3,3 г | 2,2 г |
| хлорид кальцію дигідрат, що відповідає хлориду кальцію | 0,74 г 0,56 г | 0,59 г 0,44 г | 0,44 г 0,33 г | 0,29 г 0,22 г |
| гліцерофосфат натрію, що відповідає гліцерофосфату натрію безводному | 3,8 г | 3,0 г | 2,3 г | 1,5 г |
| сульфат магнію гептахідрат, що відповідає сульфату магнію | 2,5 г 1,2 г | 2,0 г 0,96 г | 1,5 г 0,72 г | 0,99 г 0,48 г |
| хлорид калію | 4,5 г | 3,6 г | 2,7 г | 1,8 г |
| ацетат натрію трігідрат, що відповідає ацетату натрію | 6,1 г 3,7 г | 4,9 г 2,9 г | 3,7 г 2,2 г | 2,5 г 1,5 г |
Інші компоненти (допоміжні речовини) - це:очищені лецитини яєчного жовтка, гліцерол, гідроксид натрію (для встановлення pH), оцтова кислота (для встановлення pH) та вода для ін'єкцій.
Як виглядає КабIVEN і що містить пакування
Розчини глюкози та амінокислот з електролітами є прозорими, безбарвними до легкого жовтого кольору, а жирова емульсія - біла та однорідна. Пакування препарату КабIVEN складається з трикамерного внутрішнього пакету та зовнішнього пакету. Між внутрішнім та зовнішнім пакетами знаходиться поглинувач кисню, який потрібно видалити перед використанням препарату. Внутрішній пакет розділений на три камери зварюваннями, які розриваються під час підготовки пакету до використання. Зміст усіх трьох камер потрібно перемішати перед використанням.
Об'єми пакувань:
1026 мл, 1540 мл, 2053 мл, 2566 мл. Не всі об'єми пакувань повинні бути в обігу.
Відповідальний суб'єкт та виробник
Fresenius Kabi AB
Швеція
Для отримання більш детальної інформації зверніться до представника відповідального суб'єкта:
Fresenius Kabi Україна ТОВ
вул. Хмельницького, 14-16, м. Київ, 01001
телефон: +38 (044) 279-16-16
Дата останнього оновлення брошури:16.11.2023 р.
Інформація, призначена лише для кваліфікованого медичного персоналу:
Спеціальні попередження та заходи обережності при використанні
Для уникнення ризиків, пов'язаних з надмірною швидкістю інфузії, рекомендується проводити її безперервно та під контролем, якщо можливо, з використанням об'ємної помпи. Оскільки використання центральної вени для інфузії пов'язане з підвищеним ризиком інфекції, під час встановлення та обслуговування катетера рекомендується суворо дотримуватися правил асептики, щоб уникнути будь-якої інфекції. Рекомендується також контролювати концентрацію глюкози та електролітів у сироватці, осмолярність, а також проводити біохімічні тести печінки (алкалічна фосфатаза, АспАТ, Алат). У разі появи будь-яких ознак або симптомів анафілактичної реакції (таких як гарячка, озноб, висип або задуха) потрібно негайно припинити інфузію. Не вводити препарат КабIVEN одночасно з кров'ю в одному інфузійному наборі через ризик псевдоаглютинації.
Спосіб введення
Внутрішньовенне введення, інфузія в центральну вену. Для забезпечення повного парентерального харчування рекомендується додатково використовувати, залежно від потреб пацієнта, мікроелементи, вітаміни та електроліти (враховуючи електроліти, що містяться в препараті КабIVEN).
Швидкість інфузії
Максимальна швидкість інфузії глюкози становить 0,25 г/кг маси тіла на годину. Доза амінокислот не повинна перевищувати 0,1 г/кг маси тіла на годину. Доза жирів не повинна перевищувати 0,15 г/кг маси тіла на годину. Швидкість інфузії не повинна перевищувати 2,6 мл/кг маси тіла на годину (що відповідає 0,25 г глюкози, 0,09 г амінокислот та 0,1 г жирів на кг маси тіла). Рекомендований час тривалості інфузії становить від 12 до 24 годин.
Згодність
Дані про згодність доступні для препаратів Діпе ptивен, Омегавен, Аддамел Н/Суплівен, Глікофос, Аддифос, Віталіпід Н дорослих/дітей та Солувіт Н. Під час додавання електролітів потрібно враховувати їх кількість, вже присутню в пакеті, для задоволення клінічних потреб пацієнта. Доступні дані підтверджують можливість додавання зазначених препаратів до активованого пакету згідно з нижчезазначеною таблицею: Обсяг згодності: стабільний протягом 8 днів, тобто 6 днів зберігання при температурі 2-8 °C, а потім 48 годин при температурі 20-25 °C.
| Одиниця | Максимальна загальна кількість | ||||
| Об'єм пакету КабIVEN | мл | 1026 | 1540 | 2053 | 2566 |
| Додаток | Об'єм | ||||
| Діпе ptивен | мл |
|
|
|
|
| Суплівен/Аддамел Н | мл |
|
|
|
|
| Солувіт Н | флакон |
|
|
|
|
| Віталіпід Н дорослих/дітей | мл |
|
|
|
|
| Ліміти електролітів1 | Кількість на пакет | ||||
| Натрій | ммоль | ≤ 154 | ≤ 231 | ≤ 308 | ≤ 385 |
| Калій | ммоль | ≤ 154 | ≤ 231 | ≤ 308 | ≤ 385 |
| Кальцій | ммоль | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
| Магній | ммоль | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
| Неорганічний фосфат (Аддифос) або органічний фосфат (Глікофос) | ммоль | ≤ 15 | ≤ 22,5 | ≤ 30 | ≤ 37,5 |
Обсяг згодності з препаратом Омегавен: стабільний протягом 48 годин при температурі 20-25 °C.
| Одиниця | Максимальна загальна кількість | ||||
| Об'єм пакету КабIVEN | мл | 1026 | 1540 | 2053 | 2566 |
| Додаток | Об'єм | ||||
| Діпе ptивен | мл |
|
|
|
|
| Омегавен | мл |
|
|
|
|
| Суплівен/Аддамел Н | мл |
|
|
|
|
| Солувіт Н | флакон |
|
|
|
|
| Віталіпід Н дорослих/дітей | мл |
|
|
|
|
| Ліміти електролітів1 | Кількість на пакет | ||||
| Натрій | ммоль | ≤ 150 | ≤ 225 | ≤ 300 | ≤ 375 |
| Калій | ммоль | ≤ 150 | ≤ 225 | ≤ 300 | ≤ 375 |
| Кальцій | ммоль | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
| Магній | ммоль | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
| Неорганічний фосфат (Аддифос) або органічний фосфат (Глікофос) | ммоль | ≤ 15 | ≤ 22,5 | ≤ 30 | ≤ 37,5 |
Примітка: ці таблиці призначені для демонстрації згодності. Вони не є керівництвами щодо дозування. Перед призначенням зазначених препаратів необхідно ознайомитися з затвердженими інструкціями. Інформація про згодність з іншими добавками та часи зберігання різних сумішей буде доступна за запитом. Будь-які добавки потрібно змішувати з препаратом у асептичних умовах. Будь-які невикористані залишки препарату або його відходи потрібно утилізувати згідно з місцевими правилами.
Строк придатності та умови зберігання
Не зберігати при температурі вище 25°C. Зберігати у зовнішньому пакуванні. Не заморожувати. Строк придатності після змішання вмісту камер пакету
Доведено фізичну та хімічну стабільність змішаного вмісту трикамерного пакету протягом 48 годин при температурі 20-25 °C, включаючи час тривалості інфузії. З мікробіологічної точки зору препарат потрібно використовувати негайно. В іншому випадку період зберігання під час використання та умови зберігання перед використанням лежать на відповідальності користувача. Цей період зазвичай не повинен перевищувати 24 години при температурі 2-8 °C, якщо змішування відбулося в контрольованих та валідованих асептичних умовах. Строк придатності після змішання з додатковими речовинами
Після порушення упаковки та змішання вмісту камер пакету можна додавати інші компоненти через порт для введення додаткових речовин.
Доведено фізико-хімічну стабільність змішаного вмісту трикамерного пакету з додатковими речовинами протягом періоду до 8 днів, тобто 6 днів при температурі 2-8 °C, а потім 48 годин при температурі 20-25 °C, включаючи час тривалості інфузії, або з добавкою препарату Омегавен протягом 48 годин при температурі 20-25 °C, включаючи час тривалості інфузії. З мікробіологічної точки зору препарат потрібно використовувати негайно після додавання інших компонентів. В іншому випадку період зберігання під час використання та умови зберігання перед використанням лежать на відповідальності користувача. Цей період зазвичай не повинен перевищувати 24 години при температурі 2-8 °C, якщо змішування відбулося в контрольованих та валідованих асептичних умовах.
Утилізація залишків препарату
Не використовувати, якщо пакування пошкоджено. Використовувати лише тоді, коли розчини амінокислот з електролітами та глюкози є прозорими, безбарвними до легкого жовтого кольору, а жирова емульсія - біла та однорідна. Зміст усіх трьох камер потрібно перемішати перед використанням. Після видалення упаковки потрібно негайно кілька разів перевернути пакет, щоб отримати перед інфузією однорідну суміш. Для одноразового використання. Не використана частина препарату не підходить для подальшого використання. Будь-які невикористані залишки препарату або його відходи потрібно утилізувати згідно з місцевими правилами.
КабIVEN - Інструкція з підготовки пакету типу Biofine до використання
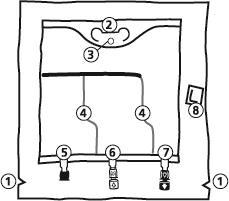
- 1. Надріз на зовнішньому пакуванні
- 2. Ручка пакету
- 3. Отвір для підвішування пакету
- 4. Зварювання, що відокремлює окремі камери пакету
- 5. Сліпий порт (використовується лише у виробництві)
- 6. Порт для введення додаткових речовин
- 7. Інфузійний порт
- 8. Поглинувач кисню
1. Видалення зовнішнього пакування
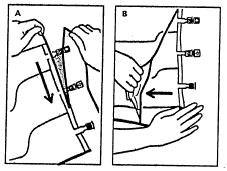
- Для видалення зовнішнього пакування потрібно покласти його горизонтально та розірвати уздовж верхнього краю (А), починаючи від надрізу біля портів.
- Потім розірвати зовнішній пакет уздовж довгого краю, зняти його та викинути разом з поглинувачем кисню (Б).
2. Перемішування
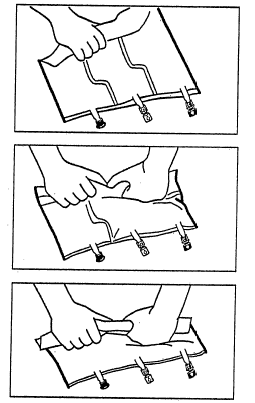
- Покласти пакет на плоску поверхню.
- Починаючи від сторони ручки, сильно скрутити пакет у напрямку портів, спочатку правою рукою, а потім, прикладаючи постійний тиск, лівою рукою, поки не розірвуться вертикальні зварювання. Вони відкриваються під дією тиску рідини. Зварювання можна також відкрити перед видаленням зовнішнього пакування. Примітка:рідини легко перемішуються, хоча горизонтальне зварювання залишається неушкодженим.
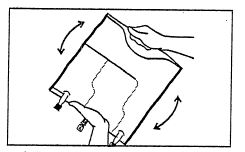
- Перемішати вміст трьох камер, обертаючи пакет тричі, щоб забезпечити повне перемішування компонентів.
3. Остаточні підготовчі дії
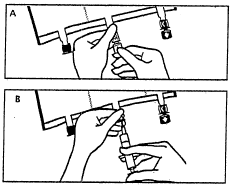
- Поновно покласти пакет на плоску, рівну поверхню. Безпосередньо перед введенням додаткових речовин потрібно відірвати позначену стрілкою затичку одноразового використання, що закриває білий порт для введення додаткових речовин (А). Примітка:мембрана порту для введення додаткових речовин є стерильною.
- Утримувати основу порту для введення додаткових речовин. Ввести голку, ввести додаткові речовини (із відомою згодністю) через центр місця для ін'єкції (Б).
- Перемішати вміст пакету докладно після додавання кожного компоненту, обертаючи пакет тричі після кожного додавання. Використовувати шприци з голками діаметром 18-23 Г та довжиною не більше 40 мм.
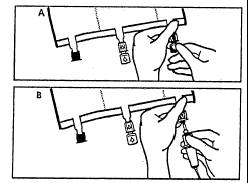
- Безпосередньо перед підключенням інфузійного набору потрібно відірвати затичку одноразового використання, що закриває синій інфузійний порт (А). Примітка:мембрана інфузійного порту є стерильною.
- Використовувати інфузійні набори без повітряного клапану або закрити повітряний клапан.
- Утримувати основу інфузійного порту.
- Ввести голку апарату для інфузії в інфузійний порт. Для забезпечення хорошого утримання голки потрібно ввести всю її довжину. Примітка:внутрішня поверхня інфузійного порту є стерильною.
4. Підвішування пакету
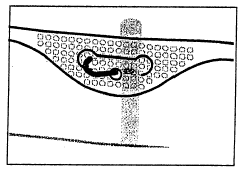
- Підвісити пакет, використовуючи отвір, розташований під ручкою.
- Країна реєстрації
- Діючі речовини
- Потрібен рецептНі
- Виробник
- ІмпортерFresenius Kabi AB
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до КабівенФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецептФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецептФорма випуску: Розчин, -Діючі речовини: combinationsНе потрібен рецепт
Аналоги Кабівен в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Кабівен у Іспанія
Аналог Кабівен у Україна
Лікарі онлайн щодо Кабівен
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Кабівен – за рішенням лікаря та згідно з місцевими правилами.














