
Ефлуелда
Запитайте лікаря про рецепт на Ефлуелда

Інструкція із застосування Ефлуелда
ЛИСТКОВКА ДЛЯ ПАЦІЄНТА
Листківка, додана до упаковки: інформація для користувача
Ефлуелда, суспензія для ін'єкцій в ампулі-шприці,
Трійвалентна вакцина проти грипу (розщеплений віріон), інактивована,
60 мкг HA/доза
Цей лікарський засіб буде додатково моніторитися. Це дозволить швидко
виявити нову інформацію про безпеку. Користувач препарату також може допомогти,
зголошуючи будь-які побічні дії, які виникли після застосування препарату. Щоб дізнатися,
як повідомляти про побічні дії – див. пункт 4.
Необхідно уважно ознайомитися з вмістом листківки перед застосуванням вакцини, оскільки вона містить важливу інформацію для пацієнта.
- Необхідно зберегти цю листківку, щоб у разі потреби можна було її знову прочитати.
- У разі будь-яких сумнівів необхідно звернутися до лікаря, фармацевта або медсестри.
- Цю вакцину призначено конкретній особі. Необхідно її зберігати та не передавати іншим.
- Якщо в пацієнта виникнуть будь-які побічні дії, включаючи ті, які не перераховані в цій листківці, необхідно повідомити про це лікаря, фармацевта або медсестру. Див. пункт 4.
Зміст листківки
- 1. Що таке Ефлуелда і для чого вона застосовується
- 2. Інформація, важлива перед застосуванням вакцини Ефлуелда
- 3. Як застосовувати вакцину Ефлуелда
- 4. Можливі побічні дії
- 5. Як зберігати вакцину Ефлуелда
- 6. Зміст упаковки та інші відомості
1. Що таке Ефлуелда і для чого вона застосовується
Ефлуелда – вакцина. Ця вакцина допомагає захистити осіб у віці 60 років і старше від грипу.
Застосування вакцини Ефлуелда повинно ґрунтуватися на офіційних рекомендаціях щодо щеплень
проти грипу.
Після введення вакцини Ефлуелда імунна система (природний захист організму) створює
власний захист проти захворювання (антитіла). Жоден з компонентів вакцини не може спричинити
грип.
Грип – це інфекційне захворювання дихальної системи, викликане вірусами грипу, від легкого до важкого та може призвести до серйозних ускладнень, таких як пневмонія, наслідком якої може бути госпіталізація, а навіть смерть. Грип – це захворювання, яке може швидко поширюватися та викликатися багатьма різними штамами вірусу, які можуть змінюватися
кожного року. Через цю можливу щорічну зміну циркулюючих штамів, а також через тривалість дії захисту, забезпеченого вакциною, рекомендується щеплення кожного року. Найбільше ризик захворювання на грип спостерігається під час зимових місяців між
жовтнем та березнем. У разі осіб, які не були щеплені восени, все ще є підстава для щеплення
в період до весни, оскільки до цього часу існує ризик захворювання на грип. Лікар буде能够 порекомендувати найкращий час для щеплення.
Вакцина Ефлуелда призначена для захисту проти трьох штамів вірусу, які містяться
у вакцині, приблизно через 2-3 тижні після щеплення. Оскільки інкубаційний період грипу становить кілька днів,

захворювання все ще можливе у разі контакту з вірусом грипу безпосередньо перед
щепленням або після щеплення.
Вакцина не захищає від застуди, хоча деякі її симптоми схожі на грип.
2. Інформація, важлива перед застосуванням вакцини Ефлуелда
Необхідно повідомити лікаря або фармацевта, якщо будь-яке з нижченаведених тверджень стосується особи,
якої має бути введено вакцину Ефлуелда. Якщо щось незрозуміле, необхідно попросити лікаря
або фармацевта про роз'яснення.
Коли не застосовувати вакцину Ефлуелда:
- Якщо особа має алергію на:
- активні речовини, або
- будь-який з інших компонентів цієї вакцини (перелічених у пункті 6), або
- будь-який компонент, який може бути присутнім у дуже малих кількостях, такий як залишки яєць (альбумін яєць курей, білки курей) та формальдегід.
Острожності та заходи обережності
Перед застосуванням вакцини Ефлуелда необхідно обговорити це з лікарем, фармацевтом або медсестрою.
Перед щепленням необхідно повідомити лікаря, якщо в пацієнта спостерігаються:
- ослаблення імунної відповіді (спричинене дефектом імунітету або прийомом ліків, що впливають на імунну систему),
- кровотечі або схильність до синяків,
- перебіг синдрому Гієна-Барре (важке слабіння м'язів) після отримання вакцини проти грипу,
- хвороба, що перебігає з високою або помірною температурою або гостра хвороба. Щеплення необхідно відстрочити до часу одужання. Лікар вирішить, чи необхідно прийняти вакцину.
Оmdlіння може виникнути після, або навіть перед будь-яким уколом. Тому необхідно повідомити
лікаря або медсестру, якщо особа пережила оmdlіння при попередніх ін'єкціях.
Як і у випадку з будь-якою вакциною, Ефлуелда може не забезпечити повний захист усім
щепленим особам.
Необхідно повідомити лікаря, якщо в пацієнта протягом кількох днів після щеплення проти грипу
планується аналіз крові, через спостережувані хибно позитивні результати аналізу крові
у деяких пацієнтів раніше підданих щепленню.
Застосування у дітей
Цю вакцину не слід застосовувати у дітей. Застосування цієї вакцини рекомендується у осіб дорослих
у віці 60 років і старше.
Вакцина Ефлуелда та інші ліки
Необхідно повідомити лікаря або фармацевта про всі ліки або вакцини, які застосовуються пацієнтом зараз або останнім часом, а також про ліки або вакцини, які пацієнт планує застосовувати.
- У разі введення вакцини Ефлуелда в один час з іншими вакцинами, вакцини необхідно завжди вводити в різні кінцівки.
- Необхідно звернути увагу на те, що при одночасному введенні вакцин можуть виникнути посилені побічні дії.
- У разі застосування ліків або терапії, що знижують імунітет, таких як кортикостероїди, цитотоксичні ліки або радіотерапія, імунна відповідь на щеплення може бути ослабленою.
Вагітність і годування грудьми
Вакцина Ефлуелда призначена для застосування виключно у осіб дорослих у віці 60 років і старше.
Якщо пацієнтка вагітна або годує грудьми, припускає, що може бути вагітна або планує мати
дитину, вона повинна проконсультуватися з лікарем або фармацевтом перед застосуванням цієї вакцини. Лікар або фармацевт допоможе вирішити, чи повинна пацієнтка отримати вакцину Ефлуелда.
Керування транспортними засобами та обслуговування машин
Вакцина Ефлуелда не має впливу або має незначний вплив на здатність керування транспортними засобами
та обслуговування машин. Однак не рекомендується керувати транспортним засобом, якщо пацієнт погано себе cảmує або має головокружіння.
Вакцина Ефлуелда містить натрій
Ця вакцина містить менше 1 ммоль натрію (23 мг) на дозу, тобто препарат вважається «безнатрієвим».
3. Як застосовувати вакцину Ефлуелда
Дорослі у віці 60 років і старше отримують одну дозу 0,5 мл.
Як вводиться вакцина Ефлуелда
Лікар, фармацевт або медсестра введуть рекомендовану дозу вакцини у вигляді ін'єкції в м'яз або
під шкіру.
У разі будь-яких подальших сумнівів, пов'язаних з застосуванням цієї вакцини, необхідно звернутися
до лікаря або фармацевта.
4. Можливі побічні дії
Як і будь-який лік, ця вакцина може спричинити побічні дії, хоча не у кожної особи вони
відбуваються.
Алергічні реакції
Необхідно НАТИХМІСТЬзв'язатися з лікарем, якщо в пацієнта виникнуть:
- Важкі алергічні реакції:
- можуть вимагати медичної допомоги, з низьким тиском крові, задишкою, свистом у легенях або проблемами з диханням, швидким пульсом і слабким пульсом, холодною, вологою шкірою, головокружінням, яке може призвести до оmdlіння (анafilаксія [у тому числі ангіоневротичний набряк, тобто набряк, найбільш помітний на голові та шиї, включаючи обличчя, губи, язик, горло або інші частини тіла, який може спричинити труднощі з ковтанням або диханням]).
Необхідно зв'язатися з лікарем, якщо в пацієнта виникнуть:
- Алергічні реакції, такі як шкірні реакції, які можуть стосуватися всього тіла, включаючи свербіж, кропив'янку, висипку. ці побічні дії є рідкими (можуть стосуватися до 1 на 1000 осіб).
Інші зареєстровані побічні дії
Нижченаведені побічні дії зареєстровані у дорослих у віці 60 років і старше.
Дуже часто (можуть виникнути у більш ніж 1 на 10 осіб):
- Реакції в місці ін'єкції: біль, червоність (еритема)
- Загальне погане самопочуття (втома), головний біль, біль у м'язах
Часто (можуть виникнути у максимум 1 на 10 осіб):
- Реакції в місці ін'єкції: набряк, синяк, загустіння
- Гарячка, озноб
Не дуже часто (можуть виникнути у максимум 1 на 100 осіб):
- Реакції в місці ін'єкції: свербіж
- Втома, сонливість, нудота, блювота, діарея
- Кашель, слабкість м'язів, нудота, запалення горла (біль у роті та горлі)
Рідко (можуть виникнути у максимум 1 на 1000 осіб):
- Відсутність енергії (слабкість), червоність, біль у суглобах, головокружіння, нічні поти, висипка, оніміння або відчуття поколювання (парестезії), запалення носа (риніт), головокружіння (забурення рівноваги), надмірна кров у білку ока (гіперемія ока)
- Біль у кінцівках
Частота невідома: частота не може бути визначена на підставі наявних даних:
- Зниження кількості певних типів клітин у крові, званих тромбоцитами; їх низький рівень може спричинити надмірне утворення синяків або кровотечу (тромбоцитопенія)
- Збільшення лімфатичних вузлів у області шиї, паху або пахвинної області (лімфаденопатія)
- Нейрологічні розлади, які можуть спричинити загальмованість шиї, дезорієнтацію, оніміння, біль та слабкість кінцівок, втрату рівноваги, втрату рефлексів, параліч частини або всього тіла (енцефаліт і мієліт, полірадикуліт, синдром Гієна-Барре), параліч обличчя (параліч Белла), порушення зору, спричинені дисфункцією зорових нервів (неврит зорового нерва/нейропатія), судоми (в тому числі фебрильні судоми), оmdlіння безпосередньо після щеплення
- Васкуліт, який може призвести до шкірних висипів, а в дуже рідких випадках – до тимчасових порушень функції нирок, розширення кровоносних судин
- Біль у грудній клітці
- Свистячий дихання, тиснява в горлі, труднощі з диханням (задишка)
Більшість побічних дій відбувалися зазвичай протягом 3 днів після щеплення і проходили протягом
3 днів. Наслідування цих побічних дій було легким до помірного.
Зголошення побічних дій
Якщо виникнуть будь-які симптоми побічних дій, включаючи ті, які не перераховані в цій листківці, необхідно повідомити про це лікаря, фармацевта або медсестру. Побічні дії можна zgолошувати безпосередньо до Департаменту моніторингу непередбачених дій лікарських засобів Міністерства охорони здоров'я
вул. Європейська, 2
04050 Київ
Тел.: +38 044 279 65 42
Факс: +38 044 279 65 42
Адреса електронної пошти: [[email protected]](mailto:[email protected])
Побічні дії також можна zgолошувати подміотові, відповідальному за лікарський засіб.
Зголошуючи побічні дії, можна буде зібрати більше інформації про безпеку застосування ліків.
5. Як зберігати вакцину Ефлуелда
Вакцину необхідно зберігати в місці, недоступному для дітей.
Не застосовувати цю вакцину після закінчення терміну придатності, зазначеного на етикетці та упаковці після
«Термін придатності (EXP)». Термін придатності означає останній день вказаного місяця.
Зберігати у холодильнику (2 °C – 8 °C). Не заморожувати. Зберігати ампулку-шприц у зовнішній упаковці для захисту від світла.
Ліків не слід викидати у каналізацію чи домашні контейнери для відходів. Необхідно запитати
фармацевта, як видалити ліки, яких вже не використовують. Таке поводження допоможе захистити довкілля.
6. Зміст упаковки та інші відомості
Що містить вакцина Ефлуелда
- Активними речовинами є: Вірус грипу (інактивований, розщеплений) наступних штамів*:
A/Victoria/4897/2022 (H1N1)pdm09-подібний штам (A/Victoria/4897/2022, IVR-238)
.....................................................................................................................................60 мкг HA**
A/Croatia/10136RV/2023 (H3N2)-подібний штам (A/Croatia/10136RV/2023, X-425A)
.................................................................................................................................... 60 мкг HA**
B/Austria/1359417/2021-подібний штам (B/Michigan/01/2021, тип дикого)
................................................................................................................................... 60 мкг HA**
у дозі 0,5 мл
*
вирощений у курячих ембріонах
**
гемаглютинін
Вакцина відповідає рекомендаціям Всесвітньої організації охорони здоров'я (ВООЗ)
для півкулі півночі та рекомендаціям Європейського Союзу на сезон 2025/2026.
Інші компоненти: буферний розчин, що містить хлорид натрію, моногідрофосфат натрію, дигідрофосфат натрію, вода для ін'єкцій та октоксинол-9.
Деякі компоненти, такі як залишки яєць (альбумін яєць курей, білки курей) чи формальдегід, можуть
бути присутні у дуже малих кількостях (див. пункт 2).
Як виглядає вакцина Ефлуелда та що містить упаковка
Після легкого встряхування вакцина являє собою безбарвну, опалескуючу рідину.
Ефлуелда – суспензія для ін'єкцій в ампулці-шприці (суспензія для ін'єкцій) по 0,5 мл,
з голкою або без голки (в упаковці по 1, 5 або 10) або з голкою в захисній оболонці (в упаковці по
1 або 10). Не всі розміри упаковок повинні бути в обігу.
Відповідальний суб'єкт та імпортер
Відповідальний суб'єкт:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
Франція
Імпортер:
Sanofi Winthrop Industrie
Voie de l’Institut - Parc Industriel d'Incarville
B.P 101
27100 Val de Reuil
Франція
Цей лікарський засіб дозволений до обігу в країнах-членах Європейського економічного простору під наступними назвами:
Дата останньої актуалізації листківки:липень 2025
<Інші джерела інформації
Поточна затверджена інформація про цей продукт доступна <після сканування смартфоном коду QR
наведеного на паперовій коробці> або за наступною адресою URL: https://efluelda-nh.info.sanofi >
-----------------------------------------------------------------------------------------------------------------------
Інформація, призначена виключно для фахового медичного персоналу:
Як і у випадку з усіма вакцинами, що вводяться ін'єкціями, необхідно забезпечити
відповідне лікування та медичний нагляд на випадок виникнення анафілактичної реакції після введення
вакцини.
Перед введенням вакцина повинна досягти кімнатної температури.
Встряхнути перед застосуванням. Перевірити візуально перед введенням.
Вакцини не слід застосовувати у разі наявності в суспензії твердих частинок.
Вакцини не слід змішувати з іншими лікарськими засобами в одному шприці.
Вакцини не слід вводити безпосередньо в кровоносні судини.
Див. також пункт 3. Як застосовувати вакцину Ефлуелда
Підготовка до застосування
Інструкція щодо використання голки з захисною оболонкою з ампулкою-шприцем з кінчиком Luer
Lock:
| Австрія, Бельгія, Болгарія, Хорватія, Чехія, Данія, Естонія, Фінляндія, Франція, Іспанія, Нідерланди, Ісландія, Ірландія, Литва, Люксембург, Латвія, Мальта, Німеччина, Норвегія, Польща, Португалія, Румунія, Словаччина, Словенія, Швеція, Угорщина, Італія | Ефлуелда |
| Кіпр, Греція | Ефлуелда TIV |
| Рисунок А: Голка з захисною оболонкою (в обудові) | Рисунок Б: Елементи захисної оболонки голки (підготовлені до застосування) |
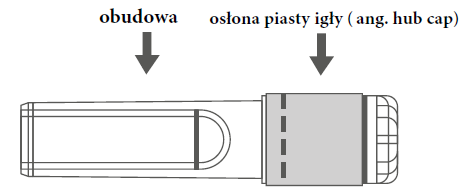 |  |
| Крок 1: Щоб прикріпити голку до шприца, необхідно зняти захисну оболонку голки (анг. hub cap), щоб відкрити голку та легенько вкрутити голку в адаптер Luer Lock шприца, поки не відчутиться легкий опір. | |
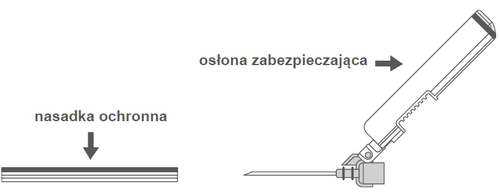
Крок 2: Зняти обудову голки. Голка захищена захисною оболонкою та насадкою.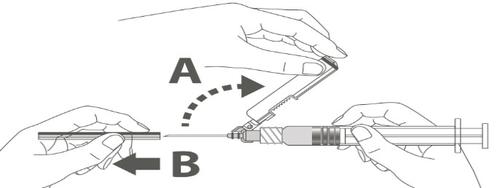 | |
| Kрок 3: A: Відштовхнути захисну оболонку від голки у напрямку корпусу шприца під показаним кутом. B: Зняти насадку. | 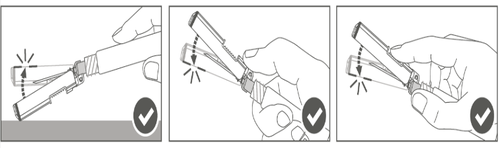 |
| Kрок 4: Після ін'єкції заблокувати (активувати) захисну оболонку, застосовуючи одну з трьох (3) представлених технік обслуговування однією рукою: активація на плоскій поверхні, великим пальцем або вказівним пальцем. Примітка: Активація підтверджується чутним та (або) відчутним «кліком». | |
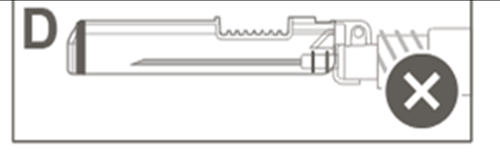
| Kрок 5: Перевірити візуально роботу захисної оболонки. Захисна оболонка повинна бути повністю заблокована (активована), як показано на рисунку С. Рисунок D показує, що захисна оболонка НЕ є повністю заблокованою (не активованою). | 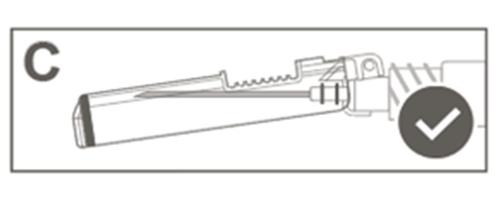 |
 | |
| Острога: Не слід намагатися розблокувати (деактивувати) захисного пристрою шприца шляхом виштовхування голки з захисної оболонки. | |
Будь-які невикористані залишки лікарського засобу або його відходи необхідно видалити згідно
з місцевими правилами.˃
- Країна реєстрації
- Діючі речовини
- Потрібен рецептТак
- ІмпортерSanofi Winthrop Industrie
- Інформація є довідковою і не є медичною порадою. Перед прийомом будь-яких препаратів обов'язково проконсультуйтеся з лікарем. Oladoctor не несе відповідальності за медичні рішення, прийняті на основі цього контенту.
- Альтернативи до ЕфлуелдаФорма випуску: Суспензія, 60 мкг HA/штам, 1 доза (0,7 мл)Діючі речовини: influenza, inactivated, split virus or surface antigenПотрібен рецептФорма випуску: Суспензія, 1 доза (0,5 мл)Діючі речовини: influenza, inactivated, split virus or surface antigenПотрібен рецептФорма випуску: Суспензія, 1 доза (0,5 мл)Діючі речовини: influenza, inactivated, split virus or surface antigenПотрібен рецепт
Аналоги Ефлуелда в інших країнах
Найкращі аналоги з тією самою діючою речовиною та терапевтичним ефектом.
Аналог Ефлуелда у Іспанія
Аналог Ефлуелда у Україна
Лікарі онлайн щодо Ефлуелда
Консультація щодо дозування, побічних ефектів, взаємодій, протипоказань та поновлення рецепта на Ефлуелда – за рішенням лікаря та згідно з місцевими правилами.














