
Ваксигриптетра

Спросите врача о рецепте на Ваксигриптетра

Инструкция по применению Ваксигриптетра
Инструкция, прилагаемая к упаковке: информация для пользователя
VaxigripTetra, суспензия для инъекций в шприце-ампуле
Четырехвалентная вакцина против гриппа (расщепленный вирион), инактивированная
Прежде чем использовать вакцину, необходимо внимательно ознакомиться с содержанием инструкции, поскольку она содержит важную информацию для взрослых пациентов или детей.
- Необходимо сохранить эту инструкцию, чтобы в случае необходимости иметь возможность ее повторно прочитать.
- В случае любых сомнений необходимо обратиться к врачу, фармацевту или медсестре.
- Эту вакцину назначили конкретному человеку. Не следует передавать ее другим.
- Если у взрослого пациента или ребенка出现ят любые нежелательные реакции, включая любые нежелательные реакции, не указанные в этой инструкции, необходимо сообщить об этом врачу, фармацевту или медсестре. См. пункт 4.
Содержание инструкции
- 1. Что такое VaxigripTetra и для чего она используется
- 2. Важные сведения перед использованием вакцины VaxigripTetra
- 3. Как использовать VaxigripTetra
- 4. Возможные нежелательные реакции
- 5. Как хранить вакцину VaxigripTetra
- 6. Содержание упаковки и другие сведения
1. Что такое VaxigripTetra и для чего она используется
VaxigripTetra - вакцина. Эта вакцина, вводимая взрослым и детям от 6 месяцев, помогает защитить от гриппа.
После введения вакцины VaxigripTetra иммунная система (естественная защитная система организма)
производит свою собственную защиту от заболевания (антитела). Вакцина, введенная во время беременности,
помогает защитить беременных женщин, а также детей от рождения до 6 месяцев, передавая защиту от матери к ребенку во время беременности (см. также пункты 2 и 3).
Ни один из компонентов вакцины не может вызвать грипп.
Использование вакцины VaxigripTetra должно быть в соответствии с официальными рекомендациями.
Грипп - это заболевание, которое может быстро распространяться и вызывается многими разными
штаммами вируса, которые могут меняться каждый год. Из-за этой возможной ежегодной смены
циркулирующих штаммов, а также с учетом периода сохранения защиты, обеспечиваемой вакциной, рекомендуется проводить вакцинацию каждый год. Наибольший риск заболеть гриппом существует в холодные месяцы между октябрем и марцем. В случае взрослых и детей, которые не были вакцинированы осенью, все еще оправдано провести вакцинацию в период до весны, поскольку до этого времени существует риск заболеть гриппом. Врач сможет порекомендовать лучшее время для вакцинации.
Вакцина VaxigripTetra предназначена для защиты взрослых и детей от четырех штаммов вируса, содержащихся в вакцине, через 2-3 недели после вакцинации. Поскольку инкубационный период для гриппа составляет несколько дней, в случае воздействия вируса гриппа непосредственно перед или после вакцинации, все еще возможно заболеть.
Вакцина не защищает от простуды, хотя некоторые ее симптомы похожи на грипп.
2. Важные сведения перед использованием вакцины VaxigripTetra
Необходимо проинформировать врача или фармацевта, если какие-либо из нижеперечисленных утверждений относятся к взрослому пациенту или ребенку, которым будет введена вакцина VaxigripTetra. Если что-то непонятно, необходимо попросить врача или фармацевта объяснить.
Когда не использовать вакцину VaxigripTetra:
- Если у взрослого пациента или ребенка есть аллергия на:
- Активные вещества, или
- Любой из остальных компонентов этой вакцины (перечисленных в пункте 6), или
- Любой компонент, который может присутствовать в очень небольших количествах, такой как остаток яйца (яичный альбумин, куриный белок), нейомицин, формальдегид или октоксинол-9,
- Если у взрослого пациента или ребенка выявлено заболевание, протекающее с высокой или умеренной температурой или острым заболеванием, вакцинация должна быть отложена до выздоровления.
Предостережения и меры предосторожности
Прежде чем использовать вакцину VaxigripTetra, необходимо поговорить с врачом, фармацевтом или медсестрой.
Прежде чем сделать прививку, необходимо проинформировать врача, если у взрослого пациента или ребенка есть:
- Ослабление иммунного ответа (вызванный иммунодефицитом или приемом препаратов, влияющих на иммунную систему),
- Кровотечения или склонность к синякам. Врач решит, должен ли взрослый пациент или ребенок получить вакцину.
Обморок может произойти (особенно у подростков) после или даже до любой инъекции.
Поэтому необходимо проинформировать врача или медсестру, если пациент или его ребенок испытывал обмороки при предыдущих инъекциях.
Как и в случае с любой вакциной, VaxigripTetra может не обеспечить полную защиту всем привитым лицам.
Не все дети в возрасте до 6 месяцев, родившиеся у вакцинированных во время беременности женщин, будут защищены.
Необходимо проинформировать врача, если у взрослого пациента или ребенка в течение нескольких дней после вакцинации против гриппа запланировано исследование крови, поскольку были обнаружены ложноположительные результаты исследования крови у некоторых пациентов, ранее получавших вакцину.
Дети
Использование вакцины VaxigripTetra не рекомендуется для детей до 6 месяцев.
VaxigripTetra и другие препараты
Необходимо сказать врачу или фармацевту о всех препаратах или вакцинах, которые принимает взрослый пациент или ребенок в настоящее время или最近, а также о препаратах или вакцинах, которые планируется использовать.
- Вакцина VaxigripTetra может быть введена одновременно с другими вакцинами, но в разные конечности.
- При использовании препаратов, снижающих иммунитет, таких как кортикостероиды, цитотоксические препараты или радиотерапия, иммунный ответ на вакцинацию может быть ослаблен.
Беременность и грудное вскармливание
Если пациентка беременна или кормит грудью, предполагает, что может быть беременной, должна проконсультироваться с врачом или фармацевтом перед использованием этой вакцины.
Вакцина VaxigripTetra может быть введена во все периоды беременности.
Вакцина VaxigripTetra может быть использована во время грудного вскармливания.
Врач решает о возможности введения вакцины VaxigripTetra.
Вождение транспортных средств и использование машин
Вакцина VaxigripTetra не влияет или имеет незначительное влияние на способность вождения транспортных средств и использование машин.
VaxigripTetra содержит калий и натрий
Этот препарат содержит менее 1 ммоль калия (39 мг) и менее 1 ммоль натрия (23 мг) на дозу, то есть по сути является "безкалиевым" и "безнатриевым".
3. Как использовать VaxigripTetra
Дозировка
Взрослые получают одну дозу 0,5 мл.
Использование у детей
Дети от 6 месяцев до 17 лет получают одну дозу 0,5 мл.
Детям до 9 лет, которые ранее не были вакцинированы против гриппа, необходимо ввести вторую дозу 0,5 мл через не менее 4 недель.
В случае беременных женщин одна доза 0,5 мл, введенная во время беременности, может защитить ребенка от рождения до 6 месяцев. Для получения дополнительной информации необходимо обратиться к врачу или фармацевту.
Как принимать VaxigripTetra
Врач или медсестра введет рекомендуемую дозу вакцины в виде инъекции в мышцу или под кожу.
Использование большей, чем рекомендуемая, дозы вакцины VaxigripTetra
В некоторых случаях случайно была введена большая доза, чем рекомендуемая.
В этих случаях, когда сообщались нежелательные реакции, они были аналогичны тем, которые описаны после введения рекомендуемой дозы (см. пункт 4).
В случае любых дальнейших сомнений, связанных с использованием этой вакцины, необходимо обратиться к врачу или фармацевту.
4. Возможные нежелательные реакции
Как и любой препарат, эта вакцина может вызывать нежелательные реакции, хотя они не возникнут у каждого.
Аллергические реакции
Необходимо немедленно обратиться к врачу или медицинскому работнику или пойти в ближайшую приемную, если у взрослого пациента или ребенка возникнут аллергические реакции (сообщаемые как редкие: могут возникнуть у до 1 из 1000 человек), которые могут угрожать жизни.
Симптомы могут включать сыпь, зуд, крапивницу, покраснение, трудности с дыханием, одышку, отек лица, губ, горла или языка, холодную, влажную кожу, сердцебиение, головокружение, слабость или обморок.
Другие нежелательные реакции, сообщаемые у взрослых и пожилых
Очень часто (могут возникнуть у более чем 1 из 10 человек)
- Головная боль, боль в мышцах, общее плохое самочувствие, боль в месте инъекции. Часто у пожилых людей Часто (могут возникнуть у до 1 из 10 человек)
- Лихорадка, озноб, реакции в месте инъекции: покраснение (эритема), отек, индурация. Не очень часто у пожилых людей Не очень часто (могут возникнуть у до 1 из 100 человек)
- Головокружение, диарея, тошнота (наusea), усталость, реакции в месте инъекции: синяки (гематома), зуд (прурит) и индурация. Редко у взрослых Редко у пожилых
- Приливы жара: наблюдались только у пожилых людей.
- Увеличение лимфатических узлов в области шеи, подмышек или паха (лимфаденопатия): наблюдались только у взрослых.
Редко (могут возникнуть у до 1 из 1000 человек)
- Нарушения чувствительности, сонливость, чрезмерное потоотделение, необычная усталость или слабость (астения), гриппоподобные симптомы.
- Боль в суставах, дискомфорт в месте инъекции: наблюдались только у взрослых.
Другие нежелательные реакции, сообщаемые у детей в возрасте от 3 до 17 лет
Очень часто (могут возникнуть у более чем 1 из 10 человек)
- Головная боль, боль в мышцах, общее плохое самочувствие, озноб, реакции в месте инъекции: боль, отек, покраснение (эритема), индурация. Часто у детей в возрасте от 9 до 17 лет Часто (могут возникнуть у до 1 из 10 человек)
- Лихорадка, синяк в месте инъекции (гематома).
Не очень часто (могут возникнуть у до 1 из 100 человек) у детей в возрасте от 3 до 8 лет
- Временное снижение количества определенных типов кровяных клеток, называемых тромбоцитами; их низкий уровень может вызывать чрезмерное образование синяков или кровотечение (временная тромбоцитопения): сообщалось у одного ребенка в возрасте 3 лет.
- Капризность, беспокойство.
- Головокружение, диарея, рвота, боль в верхней части живота, боль в суставах, усталость, индурация в месте инъекции.
Не очень часто (могут возникнуть у до 1 из 100 человек) у детей в возрасте от 9 до 17 лет
- Диарея, зуд (прурит) в месте инъекции.
Другие нежелательные реакции, сообщаемые у детей от 6 месяцев до 35 месяцев
Очень часто (могут возникнуть у более чем 1 из 10 человек):
- Рвота, боль в мышцах, раздражительность, потеря аппетита, общее плохое самочувствие, лихорадка. Не очень часто у детей в возрасте от 24 до 35 месяцев Редко у детей в возрасте до 24 месяцев Редко у детей в возрасте от 24 до 35 месяцев
- Реакции в месте инъекции: боль/чувствительность, покраснение (эритема).
- Головная боль: наблюдалась только у детей до 24 месяцев.
- Сонливость, необычный плач: наблюдалась только у детей до 24 месяцев.
Часто (могут возникнуть у до 1 из 10 человек):
- Озноб: наблюдалась только у детей в возрасте 24 месяцев и старше
- Реакции в месте инъекции: индурация, отек, синяк в месте инъекции (гематома).
Не очень часто (могут возникнуть у до 1 из 100 человек):
- Диарея, повышенная чувствительность.
Редко (могут возникнуть у до 1 из 1000 человек):
- Гриппоподобное заболевание, реакции в месте инъекции: сыпь, зуд (прурит).
У детей в возрасте от 6 месяцев до 8 лет, получающих 2 дозы, нежелательные реакции после первой и после второй дозы подобны. Меньше нежелательных реакций может возникнуть после введения второй дозы у детей в возрасте от 6 месяцев до 35 месяцев.
Наблюдаемые нежелательные реакции обычно возникали в течение первых 3 дней после вакцинации и проходили самостоятельно в течение 1-3 дней после возникновения. Наблюдаемые нежелательные реакции имели легкий характер.
В целом нежелательные реакции возникали реже у пожилых людей, чем у взрослых и детей.
Ниже перечисленные нежелательные реакции были сообщены после введения вакцины Vaxigrip. Они могут возникнуть после введения вакцины VaxigripTetra:
- Боль, ощущаемая вдоль нервов (невралгия), судороги (конвульсии), неврологические расстройства, которые могут вызывать шейный спазм, дезориентацию, онемение, боль и слабость конечностей, потерю равновесия, потерю рефлексов, паралич части или всего тела (воспаление мозга и спинного мозга, воспаление нерва, синдром Гийена-Барре).
- Воспаление кровеносных сосудов, которое может привести к кожным высыпаниям и в очень редких случаях к временным нарушениям функции почек.
- Временная тромбоцитопения, лимфаденопатия, парестезия в возрастных группах, других чем описано выше для этих нежелательных реакций.
Сообщение о нежелательных реакциях
Если у взрослого пациента или ребенка возникнут любые нежелательные реакции, включая любые нежелательные реакции, не указанные в инструкции, необходимо сообщить об этом врачу, фармацевту или медсестре. Нежелательные реакции можно сообщать напрямую в Департамент мониторинга нежелательных реакций лекарственных препаратов Управления по регистрации лекарственных препаратов, медицинских изделий и биоцидных продуктов
Ал. Ерозолимских 181С
02 222 Варшава
Тел.: + 48 22 49 21 301
Факс: + 48 22 49 21 309
Сайт: https://smz.ezdrowie.gov.pl
Нежелательные реакции также можно сообщать подлежащему ответственности лицу.
Благодаря сообщению о нежелательных реакциях можно будет собрать больше информации о безопасности использования препарата.
5. Как хранить вакцину VaxigripTetra
Вакцину необходимо хранить в месте, недоступном для детей.
Не использовать эту вакцину после истечения срока годности, указанного на этикетке и упаковке после "Срок годности (EXP)". Срок годности указывает последний день указанного месяца.
Хранить в холодильнике (2 ° C - 8 ° C). Не замораживать. Хранить шприц-ампулу в наружной упаковке, чтобы защитить от света.
Лекарства не следует выбрасывать в канализацию или домашние мусорные контейнеры. Необходимо спросить фармацевта, как утилизировать лекарства, которые больше не используются. Такое поведение поможет защитить окружающую среду.
6. Содержание упаковки и другие сведения
Что содержит VaxigripTetra
- Активными веществами являются: вирус гриппа (инактивированный, расщепленный) следующих штаммов*:
A/Victoria/4897/2022 (H1N1)pdm09-подобный штамм (A/Victoria/4897/2022, IVR-238)
............................................................................................................................. 15 микрограммов HA**
A/Croatia/10136RV/2023 (H3N2)-podobный штамм (A/Croatia/10136RV/2023, X-425A)
…………………………………………………………………………………. 15 микрограммов HA**
B/Austria/1359417/2021–podobный штамм (B/Michigan/01/2021, тип дикого)
............................................................................................................................. 15 микрограммов HA**
B/Phuket/3073/2013–podobный штамм (B/Phuket/3073/2013, тип дикого)
............................................................................................................................. 15 микрограммов HA**
в дозе 0,5 мл
* полученные в куриных эмбрионах от здоровых стад
** гемагглютинин
Вакцина соответствует рекомендациям Всемирной организации здравоохранения (World Health Organization, WHO) для северного полушария и рекомендациям Европейского Союза на сезон 2025/2026.
- Остальными компонентами являются: буферный раствор, содержащий хлорид натрия, хлорид калия, дигидрофосфат натрия, диводородфосфат калия и воду для инъекций.
Некоторые компоненты, такие как яйца (яичный альбумин, куриный белок), нейомицин, формальдегид или октоксинол-9, могут присутствовать в очень небольших количествах (см. пункт 2).
Как выглядит VaxigripTetra и что содержит упаковка
После легкого встряхивания вакцина представляет собой бесцветную, опалесцирующую жидкость.
VaxigripTetra - суспензия для инъекций в шприце-ампуле по 0,5 мл, с приложенной иглой или без иглы (в упаковке по 1, 10 или 20) или с отдельной иглой в защитной оболочке (в упаковке по 1 или 10). Не все размеры упаковок могут находиться в обращении.
Ответственное лицо и производитель
Ответственным лицом в Польше является:
Sanofi Winthrop Industrie
82 Avenue Raspail
94250 Gentilly, Франция
Производителем является:
Reuil - Франция>
Этот лекарственный препарат разрешен к обращению в странах-членах Европейского экономического пространства под следующими названиями:
- Австрия: VaxigripTetra Injektionssuspension in einer Fertigspritze.
- Литва: VaxigripTetra injekcinė suspensija užpildytame švirkšte.
- Болгария, Хорватия, Кипр, Эстония, Финляндия, Франция, Греция, Исландия, Латвия, Мальта, Польша, Португалия, Румыния, Словения, Швеция, Нидерланды: VaxigripTetra.
- Дания, Норвегия: Vaxigriptetra.
- Бельгия, Люксембург: Vaxigrip Tetra suspension injectable en seringue préremplie.
- Германия, Италия, Испания, Чехия, Словакия, Венгрия: Vaxigrip Tetra.
- Ирландия, Великобритания (Северная Ирландия): Quadrivalent influenza vaccine (split virion, inactivated).
Дата последнего обновления инструкции:май 2025
Другие источники информации
В настоящее время утвержденная информация о этом продукте доступна после сканирования QR-кода на картонной упаковке или по адресу URL: https://vaxigriptetra-nh.info.sanofi
-----------------------------------------------------------------------------------------------------------------------
Информация, предназначенная только для медицинского персонала:
Как и в случае со всеми вакцинами, вводимыми в виде инъекций, необходимо обеспечить надлежащее лечение и медицинский надзор на случай возникновения анафилактической реакции после введения вакцины.
Прежде чем ввести вакцину, необходимо достичь комнатной температуры.
Встряхнуть перед использованием. Проверить визуально перед введением.
Вакцину не следует использовать в случае присутствия в суспензии твердых частиц.
Вакцину не следует смешивать с другими лекарственными препаратами в одном шприце.
Вакцину не следует вводить直接 в кровеносные сосуды.
См. также пункт 3. Как использовать VaxigripTetra
| Подготовка к введению | |
| Инструкция по использованию иглы с защитной оболочкой с шприцем-ампулой с концом Luer | |
| Замок: | |
Рисунок А: Игла с защитной оболочкой (в корпусе)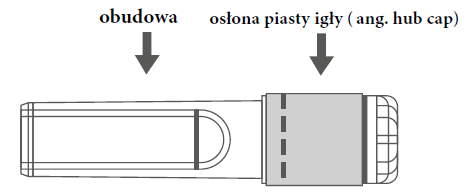 | Рисунок Б: Элементы защитной оболочки иглы (приготовлены к использованию)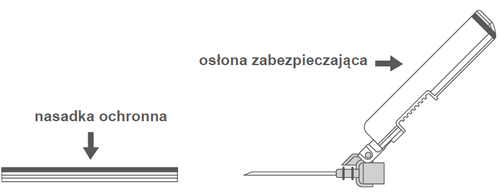 |
| Шаг 1: Чтобы прикрепить иглу к шприцу, необходимо удалить защитный колпачок иглы (анг. hub cap), чтобы открыть хвостовик иглы, и осторожно вкрутить иглу в адаптер Luer Lock шприца до ощущения легкого щелчка. | ||
| Шаг 2: Удалить корпус иглы. Игла защищена защитной оболочкой и защитной насадкой. | ||
| Шаг 3: А: Отодвинуть защитную оболочку от иглы в направлении корпуса шприца под показанным углом. Б: Удалить защитную насадку. | 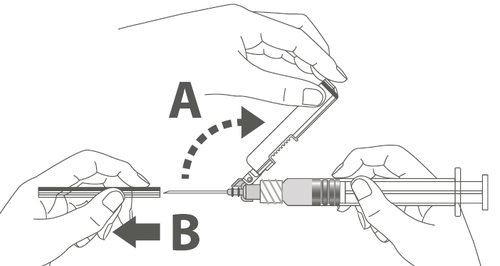 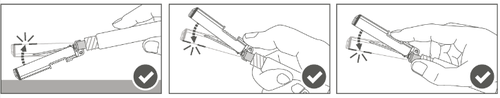 | |
| Шаг 4: После инъекции необходимо заблокировать (активировать) защитную оболочку, используя одну из трех (3) представленных техник обращения одной рукой: активация на плоской поверхности, большим пальцем или указательным пальцем. Примечание: Активация подтверждается слышимым и (или) ощутимым "щелчком". | ||
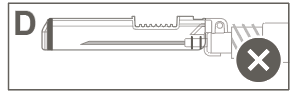
| Шаг 5: Визуально проверить работу защитной оболочки. Защитная оболочка должна быть полностью заблокирована (активирована), как показано на рисунке С. Рисунок D показывает, что защитная оболочка НЕ полностью заблокирована (не активирована). | ||
Предупреждение: Не следует пытаться разблокировать (деактивировать) защитное устройство, пытаясь вытолкнуть иглу из защитной оболочки.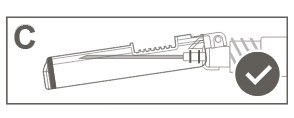 | ||
 | ||
| Любые неиспользованные остатки препарата или его отходы необходимо утилизировать в соответствии | ||
| с местными правилами.> | ||
- Страна регистрации
- Активное вещество
- Требуется рецептДа
- ИмпортерSanofi Winthrop Industrie Sanofi Winthrop Industrie Sanofi-Aventis Zrt.
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги ВаксигриптетраФорма выпуска: Суспензия, 60 мкг HA/штамм, 1 доза (0,7 мл)Активное вещество: influenza, inactivated, split virus or surface antigenТребуется рецептФорма выпуска: Суспензия, 60 мкг HA/штамм, 1 доза (0,5 мл)Активное вещество: influenza, inactivated, split virus or surface antigenТребуется рецептФорма выпуска: Суспензия, 1 доза (0,5 мл)Активное вещество: influenza, inactivated, split virus or surface antigenТребуется рецепт
Аналоги Ваксигриптетра в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Ваксигриптетра в Испания
Аналог Ваксигриптетра в Украина
Врачи онлайн по Ваксигриптетра
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Ваксигриптетра – по решению врача и с учетом местных правил.














