
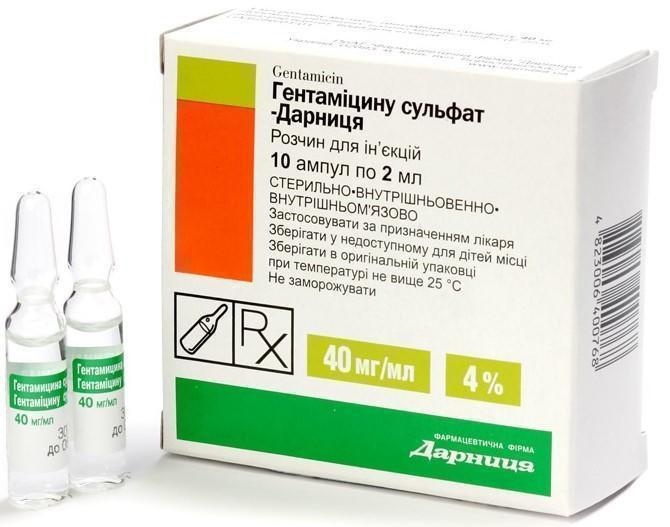
GENTAMICINU SUL'FAT

Pergunte a um médico sobre a prescrição de GENTAMICINU SUL'FAT

Como usar GENTAMICINU SUL'FAT
INSTRUÇÕES para aplicação médica do medicamento Bonviva®
Composição:
substância ativa: ácido ibandrônico;
1 seringa pré-preenchida (3 ml de solução) contém 3 mg de ácido ibandrônico na forma de monoidrato de ibandrônico de sódio 3,375 mg;
a concentração de ácido ibandrônico na solução para injeção é de 1 mg/ml;
excipientes: cloreto de sódio; ácido acético glacial; tri-hidrato de acetato de sódio; água para injeção.
Forma farmacêutica.
Solução para injeção.
Propriedades físico-químicas principais:
solução límpida e incolor.
Grupo farmacoterapêutico.
Medicamentos que afetam a estrutura e a mineralização óssea. Bifosfonatos.
Ácido ibandrônico.
Código ATC M05BX06.
Propriedades farmacológicas.
Farmacodinâmica.
O ácido ibandrônico é um bifosfonato nitrogenado de alta atividade que atua seletivamente no tecido ósseo e inibe especificamente a atividade dos osteoclastos, sem afetar a formação do tecido ósseo. O medicamento não afeta o processo de recrutamento de osteoclastos. Em mulheres na pós-menopausa, reduz a taxa aumentada de renovação do tecido ósseo para o nível pré-menopausa, o que leva a um aumento progressivo da massa óssea e redução da frequência de fraturas.
O ácido ibandrônico inibe a reabsorção óssea. In vivo, o ácido ibandrônico previne a destruição óssea causada por bloqueio experimental da função das glândulas sexuais, retinoides, tumores e extratos de tumores. Em ratos jovens (em crescimento rápido), também foi observada reabsorção óssea, que levou a um aumento da massa óssea normal em comparação com animais que não receberam tratamento.
Modelos animais confirmam que o ácido ibandrônico é um inibidor potente da atividade dos osteoclastos. Em ratos em crescimento, não foram observados sinais de alteração da mineralização, mesmo com doses que excedem em mais de 5000 vezes a dose necessária para tratar a osteoporose.
A aplicação diária de longo prazo e a aplicação periódica (com grandes intervalos) durante um longo período em ratos, cães e macacos foi associada à formação de nova osso de qualidade normal, com força mecânica preservada ou aumentada, mesmo com doses tóxicas. A eficácia da administração diária e periódica do ácido ibandrônico com intervalo de 9-10 semanas entre as doses foi confirmada em um estudo clínico (MF 4411) com participação humana. Neste estudo, o ácido ibandrônico demonstrou eficácia na prevenção de fraturas.
Nos modelos animais, o ácido ibandrônico leva a alterações bioquímicas que indicam inibição dependente da dose da reabsorção do tecido ósseo, incluindo redução dos níveis de marcadores bioquímicos de degradação do colágeno ósseo na urina (como desoxipiridinolina, peptídeo N-telopéptido do colágeno tipo I).
A administração diária e periódica (com intervalo de 9-10 semanas, trimestral) do ácido ibandrônico por via oral ou intravenosa em mulheres na pós-menopausa levou a alterações bioquímicas que indicam inibição dependente da dose da reabsorção óssea.
A administração intravenosa do medicamento Bonviva®leva a uma redução nos níveis de telopeptídeo C do colágeno tipo I no soro durante 3-7 dias após o início do tratamento e a uma redução nos níveis de osteocalcina durante 3 meses.
Após a interrupção do tratamento, é observado um retorno aos níveis patológicos de reabsorção óssea aumentada, associada à osteoporose pós-menopausa.
A análise histológica de amostras obtidas por biópsia óssea após 2 e 3 anos de tratamento com ácido ibandrônico por via oral em dose de 2,5 mg por dia e por via intravenosa em dose de até 1 mg a cada 3 meses em mulheres na pós-menopausa mostrou um estado normal do tecido ósseo. Além disso, não foram encontradas evidências de deficiência de mineralização. Após 2 anos de tratamento com injeções do medicamento Bonviva®em dose de 3 mg, foi observada uma redução esperada do metabolismo ósseo, bem como uma qualidade normal do tecido ósseo e ausência de defeitos de mineralização.
Farmacocinética.
O efeito farmacológico primário do ácido ibandrônico nos ossos não está relacionado às concentrações reais de ácido ibandrônico no plasma sanguíneo, como demonstrado em vários estudos em animais e humanos.
A concentração plasmática de ácido ibandrônico aumenta proporcionalmente à dose após administração intravenosa de 0,5-6 mg.
Distribuição
Após a exposição sistêmica inicial, o ácido ibandrônico se liga rapidamente ao tecido ósseo ou é excretado na urina. No ser humano, o volume de distribuição aparente é de pelo menos 90 l e aproximadamente 40-50% da quantidade do medicamento que circula no sangue se acumula no tecido ósseo. Com as proteínas plasmáticas, cerca de 85-87% se ligam (determinado in vitro com ácido ibandrônico em concentrações terapêuticas), portanto, devido à substituição, há um baixo potencial de interação com outros medicamentos.
Metabolismo
Não há dados sobre o metabolismo do ácido ibandrônico em animais e humanos.
Excreção
O ácido ibandrônico é eliminado do sistema circulatório por absorção óssea (aproximadamente 40-50% em mulheres na pós-menopausa) e o restante é excretado inalterado nos rins.
O intervalo de meia-vida aparente é amplo e varia de 10-72 horas. Como os valores calculados dependem fortemente da duração do estudo, da dose aplicada e da sensibilidade do método de análise, o período de meia-vida final provavelmente é consideravelmente mais longo, assim como em outros bifosfonatos. O nível inicial do medicamento no plasma sanguíneo diminui rapidamente e atinge 10% do valor máximo após 3 horas e 8 horas após administração intravenosa ou oral, respectivamente.
A depuração total do ácido ibandrônico é baixa e é de, em média, 84-160 ml/min. A depuração renal (aproximadamente 60 ml/min em mulheres saudáveis na pós-menopausa) é de 50-60% da depuração total e depende da depuração da creatinina. A diferença entre a depuração aparente, total e renal reflete a absorção do medicamento pelo tecido ósseo.
Os caminhos de secreção provavelmente não incluem os sistemas de transporte ácido e básico conhecidos, envolvidos na excreção de outras substâncias ativas (ver seção "Interações com outros medicamentos e outras formas de interação"). Além disso, o ácido ibandrônico não inibe os principais isoenzimas hepáticos P450 em humanos e não induz o sistema do citocromo P450 em ratos.
Farmacocinética em casos especiais
Sexo
Os parâmetros farmacocinéticos do ácido ibandrônico não dependem do sexo.
Raça
Não há dados sobre diferenças clinicamente significativas entre etnias mongoloides e europoides em relação à distribuição do ácido ibandrônico. Há dados insuficientes sobre pacientes da etnia negra.
Pacientes com insuficiência renal
A depuração renal do ácido ibandrônico em pacientes com diferentes estágios de insuficiência renal depende linearmente da depuração da creatinina. Pacientes com insuficiência renal leve e moderada (depuração da creatinina ≥ 30 ml/min) não precisam de ajuste da dose do medicamento.
Em pacientes com insuficiência renal grave (depuração da creatinina < 30 ml/min) que receberam ácido ibandrônico por via oral em dose de 10 mg durante 21 dias, a concentração no plasma sanguíneo foi 2-3 vezes maior do que em pacientes com função renal normal, e a depuração total do ácido ibandrônico foi de 44 ml/min. Após administração intravenosa de 0,5 mg de ácido ibandrônico, a depuração total, renal e não renal diminuíram 67%, 77% e 50%, respectivamente, em pacientes com insuficiência renal grave, mas não foi observada diminuição da tolerabilidade do medicamento devido ao aumento da exposição. Devido à experiência clínica limitada com o medicamento Bonviva®, não é recomendado para pacientes com insuficiência renal grave (ver seções "Posologia e administração" e "Farmacocinética"). A farmacocinética do ácido ibandrônico em pacientes com estágio terminal de insuficiência renal foi avaliada apenas em um número limitado de pacientes em diálise, portanto, a farmacocinética do ácido ibandrônico em pacientes que não estão em diálise é desconhecida. Devido à limitação dos dados, o ácido ibandrônico não deve ser administrado a pacientes com estágio terminal de insuficiência renal.
Pacientes com insuficiência hepática (ver seção "Posologia e administração")
Não há dados sobre a farmacocinética do ácido ibandrônico em pacientes com insuficiência hepática. O fígado não desempenha um papel significativo na depuração do ácido ibandrônico, que não é metabolizado e é excretado nos rins e pelo tecido ósseo. Portanto, em pacientes com insuficiência hepática, não é necessária a correção da dose do medicamento.
Pacientes idosos (ver seção "Posologia e administração")
Os parâmetros farmacocinéticos estudados na análise multivariada não dependem da idade. Como a função renal diminui com a idade, este é o único fator a ser considerado (ver seção "Pacientes com insuficiência renal").
Crianças (ver seção "Posologia e administração")
Não há dados sobre a administração do medicamento Bonviva®em crianças.
Características clínicas.
Indicações.
Tratamento da osteoporose em mulheres na pós-menopausa com risco aumentado de fraturas. Foi demonstrada a redução do risco de fraturas vertebrais, a eficácia na prevenção de fraturas do colo do fêmur não foi estabelecida.
Contraindicações.
Hipersensibilidade ao ácido ibandrônico ou a qualquer outro componente do medicamento (ver seção "Composição").
Hipocalcemia.
Interações com outros medicamentos e outras formas de interação.
Interações metabólicas não são consideradas prováveis, pois o ácido ibandrônico não inibe os principais isoenzimas hepáticos P450 em humanos e não induz o sistema do citocromo P450 em ratos (ver seção "Farmacocinética"). O ácido ibandrônico é excretado por meio da excreção renal e não está sujeito a processos de biotransformação.
Precauções especiais.
Erros de administração
É necessário ter cuidado e evitar a administração do medicamento Bonviva®por via intrarterial ou no espaço perivenoso, pois isso pode causar danos aos tecidos.
Hipocalcemia
A administração do medicamento Bonviva®, como a administração de outros bifosfonatos por via intravenosa, pode levar a uma redução temporária nos níveis séricos de cálcio. Antes do início do tratamento com o medicamento Bonviva®, é necessário corrigir a hipocalcemia existente. Todas as outras alterações do metabolismo ósseo e do equilíbrio mineral também devem ser tratadas eficazmente. É necessário ingerir quantidades adequadas de cálcio e vitamina D, pois isso é importante para todos os pacientes.
Reação anafilática/choque
Em pacientes que receberam tratamento com ácido ibandrônico por via intravenosa, foram observados casos de reação anafilática/choque, incluindo casos fatais.
Durante a administração intravenosa do medicamento, devem estar disponíveis meios de assistência médica e monitoramento adequados. Em caso de ocorrência de reação anafilática ou outra reação grave de hipersensibilidade/alergia, a injeção deve ser interrompida imediatamente e deve ser iniciado o tratamento adequado.
Insuficiência renal
Pacientes com doenças concomitantes ou que utilizam medicamentos que possam afetar negativamente os rins devem ser submetidos a exames regulares de acordo com a prática médica adequada durante o tratamento.
Devido à experiência clínica limitada com a injeção do medicamento Bonviva®, não é recomendado para pacientes com nível de creatinina no soro sanguíneo superior a 200 μmol/l (2,3 mg/dl) ou depuração da creatinina (determinada ou calculada) inferior a 30 ml/min (ver seções "Posologia e administração" e "Farmacocinética").
Insuficiência cardíaca
Pacientes com risco de desenvolver insuficiência cardíaca devem evitar a hidratação excessiva.
Neconecrose da mandíbula
A neconecrose da mandíbula foi observada muito raramente durante a aplicação pós-comercialização do medicamento Bonviva®em pacientes que receberam o medicamento para osteoporose (ver seção "Efeitos colaterais").
O início do tratamento ou de um novo curso de tratamento deve ser adiado para pacientes com lesões abertas não cicatrizadas dos tecidos moles da boca.
Antes do início do tratamento com o medicamento Bonviva®, pacientes com fatores de risco concomitantes devem ser submetidos a exames odontológicos com intervenções preventivas adequadas e avaliação individual do risco-benefício.
Ao avaliar o risco de neconecrose da mandíbula em um paciente, devem ser considerados os seguintes fatores de risco:
- Atividade do medicamento que inibe a reabsorção óssea (o risco é maior com compostos de alta atividade); via de administração (o risco é maior com administração parenteral) e dose cumulativa da terapia de reabsorção óssea.
- Neoplasias, doenças concomitantes (em particular, anemia, coagulopatias, infecções), tabagismo.
- Tratamento concomitante: corticosteroides, quimioterapia, inibidores da angiogênese, radioterapia na região da cabeça e pescoço.
- Higiene bucal inadequada, doenças periodontais, próteses dentárias mal adaptadas, história de doenças dentárias, intervenções odontológicas invasivas, como extrações dentárias.
Durante o tratamento com o medicamento Bonviva®, todos os pacientes devem manter uma boa higiene bucal, realizar exames odontológicos regulares e informar imediatamente sobre qualquer sintoma bucal, como mobilidade dentária, dor ou inchaço, úlceras não cicatrizadas ou secreção. Durante o tratamento, intervenções odontológicas invasivas devem ser realizadas apenas após uma avaliação cuidadosa: elas devem ser evitadas durante e logo após a aplicação do medicamento Bonviva®.
O plano de tratamento para pacientes que desenvolveram neconecrose da mandíbula deve ser elaborado em estreita colaboração com um odontologista ou cirurgião maxilofacial experiente no tratamento da neconecrose da mandíbula. Deve-se considerar a possibilidade de interrupção temporária do tratamento com o medicamento Bonviva®até a melhora do estado e redução dos fatores de risco concomitantes.
Neconecrose do canal auditivo externo
Foram relatados casos de neconecrose do canal auditivo externo com o uso de bifosfonatos, principalmente em associação com terapia de longo prazo. Os fatores de risco para neconecrose do canal auditivo externo incluem o uso de hormônios esteroides e quimioterapia e/ou fatores de risco locais, como infecção ou trauma. A possibilidade de neconecrose do canal auditivo externo deve ser considerada em pacientes que recebem bifosfonatos e apresentam sintomas auriculares, incluindo infecções crônicas do ouvido.
Fraturas atípicas do fêmur
Fraturas atípicas do fêmur, tanto subtrocanterianas quanto diafisárias, foram relatadas em pacientes tratados com bifosfonatos, principalmente em pacientes que receberam tratamento de longo prazo para osteoporose. Essas fraturas transversais ou oblíquas curtas podem ocorrer em qualquer parte do fêmur, desde logo abaixo do trocânter menor até logo acima do tubérculo maior. Essas fraturas podem ocorrer após trauma mínimo ou sem trauma, e alguns pacientes podem sentir dor na região do fêmur ou dor pélvica que frequentemente está associada a características de fratura por estresse, durante várias semanas ou meses antes de a fratura se tornar aparente como uma fratura completa do fêmur. As fraturas frequentemente são bilaterais, portanto, o outro fêmur também deve ser examinado em pacientes que recebem tratamento com bifosfonatos e desenvolvem fratura diafisária do fêmur. Também foi relatado que essas fraturas têm uma taxa de cura pobre. A questão de interromper o tratamento com bifosfonatos em pacientes com suspeita de fratura atípica do fêmur deve ser considerada antes de concluir a avaliação do paciente, levando em conta a avaliação individual do risco-benefício.
Durante o tratamento com bifosfonatos, os pacientes devem ser aconselhados a relatar dor na região do fêmur, dor na articulação do quadril ou dor pélvica; todos os pacientes com esses sintomas devem ser examinados para detectar fratura incompleta do fêmur.
Capacidade de influenciar a capacidade de conduzir veículos ou operar máquinas.
Com base nas características farmacodinâmicas, perfil farmacocinético e efeitos colaterais relatados, é esperado que o Bonviva®não tenha ou tenha um efeito insignificante na capacidade de conduzir veículos ou operar máquinas.
Posologia e administração.
Dosagem
A dose recomendada de ácido ibandrônico é de 3 mg por injeção intravenosa durante 15-30 segundos, a cada 3 meses. O medicamento é destinado apenas para administração intravenosa (ver "Precauções especiais").
Os pacientes devem ingerir cálcio e vitamina D adicionais (ver seções "Precauções especiais" e "Interações com outros medicamentos e outras formas de interação").
Se a dose planejada for perdida, a injeção do medicamento deve ser feita assim que possível. Em seguida, as injeções devem ser feitas a cada 3 meses a partir do momento da última administração do medicamento.
O período ótimo de tratamento da osteoporose com bifosfonatos não foi estabelecido. A necessidade de continuar o tratamento com o medicamento Bonviva®deve ser reavaliada periodicamente, considerando o benefício e o risco potencial para cada paciente, especialmente após 5 ou mais anos de tratamento.
Grupos especiais de pacientes
Pacientes com insuficiência renal
As injeções do medicamento Bonviva®não são recomendadas para pacientes com nível de creatinina no soro sanguíneo superior a 200 μmol/l (2,3 mg/dl) ou depuração da creatinina (determinada ou calculada) inferior a 30 ml/min, pois os dados de estudos clínicos, incluindo este grupo de pacientes, são limitados (ver seções "Precauções especiais" e "Farmacocinética").
Ajuste da dose não é necessário para pacientes com insuficiência renal leve ou moderada, com nível de creatinina no soro sanguíneo igual ou inferior a 200 μmol/l (2,3 mg/dl) ou depuração da creatinina (determinada ou calculada) igual ou superior a 30 ml/min.
Pacientes com insuficiência hepática
Ajuste da dose não é necessário (ver seção "Farmacocinética").
Pacientes idosos (>65 anos)
Ajuste da dose não é necessário (ver seção "Farmacocinética").
Crianças
Não há experiência adequada com o uso do medicamento Bonviva®em crianças (menores de 18 anos). O uso do medicamento Bonviva®em crianças (menores de 18 anos) não foi estudado (ver seções "Farmacodinâmica" e "Farmacocinética").
Precauções especiais de administração
Se o medicamento for administrado em um sistema de infusão intravenosa existente, o solvente (solução para infusão) deve ser solução salina isotônica ou solução de glicose a 5% (50 mg/ml). Isso também se aplica a soluções usadas para limpar cateteres e outros dispositivos.
Qualquer solução para injeção não utilizada, seringa e agulha para injeção devem ser descartados de acordo com as regulamentações locais. A liberação do medicamento no meio ambiente deve ser minimizada.
É necessário seguir rigorosamente as seguintes instruções para a administração e eliminação de seringas e outros instrumentos perfurantes e cortantes:
- As agulhas e seringas nunca devem ser reutilizadas.
- Coloque todas as agulhas e seringas usadas em um recipiente para instrumentos perfurantes e cortantes (recipiente resistente a perfurações para uso único).
- Este recipiente deve estar localizado em um local inacessível a crianças.
- Não se deve jogar o recipiente para instrumentos perfurantes e cortantes no lixo doméstico.
- O recipiente cheio deve ser eliminado de acordo com as regulamentações locais ou de acordo com as instruções do médico.
Sobredosagem.
Não há informações específicas sobre o tratamento da sobredosagem com o medicamento Bonviva®.
Com base nos conhecimentos atuais sobre os bifosfonatos, a sobredosagem por via intravenosa pode levar a hipocalcemia, hipofosfatemia e hipomagnesemia. Reduções clinicamente significativas nos níveis séricos de cálcio, fósforo e magnésio devem ser corrigidas com a administração intravenosa de gluconato de cálcio, fosfato de potássio ou sódio e sulfato de magnésio, respectivamente.
Efeitos colaterais.
Resumo do perfil de segurança
As reações adversas mais graves relatadas foram reação anafilática/choque, fraturas atípicas do fêmur, neconecrose da mandíbula e inflamação ocular (ver "Descrição de reações adversas individuais" e seção "Precauções especiais").
As reações adversas mais frequentes relatadas foram artralgia e sintomas gripais. Esses sintomas geralmente estavam associados à primeira dose, eram geralmente de curta duração, de intensidade leve ou moderada e desapareciam após a continuação do tratamento e não requeriam intervenção médica (ver "Descrição de reações adversas individuais").
Abaixo está uma lista completa de reações adversas conhecidas.
Distúrbios do sistema imunológico
- Pouco frequentes – agravamento da asma;
- Frequentes – reações de hipersensibilidade;
- Muito frequentes – reação anafilática/choque*†.
Distúrbios do sistema nervoso
- Frequentes – cefaleia.
Distúrbios do sistema ocular
- Pouco frequentes – inflamação ocular*†.
Distúrbios vasculares
- Pouco frequentes – flebite/tromboflebite.
Distúrbios do sistema gastrointestinal
- Frequentes – gastrite, dispepsia, diarreia, dor abdominal, náusea, constipação.
Distúrbios da pele e do tecido subcutâneo
- Frequentes – erupções cutâneas;
- Pouco frequentes – angioedema, edema/edema facial, urticária;
- Muito frequentes – síndrome de Stevens-Johnson†, eritema multiforme†, dermatite bolhosa†.
Distúrbios do sistema musculoesquelético e do tecido conjuntivo
- Frequentes – artralgia, mialgia, dor musculoesquelética, dor nas costas;
- Pouco frequentes – dor óssea;
- Frequentes – fraturas atípicas do fêmur†;
- Muito frequentes – neconecrose da mandíbula*†.
- Neconecrose do canal auditivo externo (reação adversa característica dos bifosfonatos como classe)†.
- Osteoartrite, distúrbios da função articular.
Distúrbios gerais e no local de administração
- Frequentes – doença gripal*, fadiga;
- Pouco frequentes – reações no local de administração, astenia.
Descrição de reações adversas individuais
Doença gripal
A doença gripal incluiu sintomas como reações ou sintomas de fase aguda, incluindo mialgia, artralgia, febre, calafrios, fadiga, náusea, perda de apetite e dor óssea.
Neconecrose da mandíbula
Foram relatados casos de neconecrose da mandíbula, principalmente em pacientes com neoplasias que receberam tratamento com medicamentos que inibem a reabsorção óssea, incluindo o ácido ibandrônico (ver seção "Precauções especiais").
Inflamação ocular
Foram relatados casos de inflamação ocular com o uso do ácido ibandrônico, incluindo uveíte, episclerite, esclerite. Em alguns casos, essas inflamações desapareceram apenas após a interrupção do tratamento com bifosfonatos.
Reação anafilática/choque
Em pacientes que receberam tratamento com ácido ibandrônico por via intravenosa, foram observados casos de reação anafilática/choque, incluindo casos fatais.
Prazo de validade.
2 anos.
Condições de armazenamento.
Armazenar em local inacessível a crianças, a uma temperatura não superior a 30°C.
Incompatibilidades.
O medicamento Bonviva®não deve ser misturado com soluções que contenham cálcio ou com outros medicamentos para administração intravenosa.
Apresentação.
3 ml de solução em seringa pré-preenchida.
1 seringa pré-preenchida com 1 agulha estéril para injeção, colocada em um recipiente de plástico, em caixa de cartão com rótulo em língua portuguesa.
Classificação de prescrição.
Sob prescrição médica.
Fabricante.
Roch Diagnostics GmbH
Weismayd Platz
Endereço do fabricante.
Sandhofer Strasse 116, 68305 Mannheim, Alemanha
Sovereign House, Miles Gray Road, Basildon, SS14 3FR, Reino Unido
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a GENTAMICINU SUL'FATForma farmacêutica: solução, 40 mg/ml em 1 ml ou 2 mlSubstância ativa: gentamicinRequer receita médicaForma farmacêutica: solução, 40 mg/ml, 2 ml em ampolaSubstância ativa: gentamicinFabricante: ПрАТ "Фармацевтична фірма "ДарницяRequer receita médicaForma farmacêutica: solução, 250 mg/ml, 2 ml ou 4 ml em frascosSubstância ativa: amikacinRequer receita médica
Alternativas a GENTAMICINU SUL'FAT noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a GENTAMICINU SUL'FAT em Polónia
Alternativa a GENTAMICINU SUL'FAT em Espanha
Médicos online para GENTAMICINU SUL'FAT
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de GENTAMICINU SUL'FAT – sujeita a avaliação médica e regras locais.














