ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA
Pergunte a um médico sobre a prescrição de ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA

Como usar ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA
Introdução
Prospecto: informação para o utilizador
ZYPADHERA 210 mg pó e diluente para suspensão injectável de libertação prolongada
ZYPADHERA 300 mg pó e diluente para suspensão injectável de libertação prolongada
ZYPADHERA 405 mg pó e diluente para suspensão injectável de libertação prolongada
Olanzapina
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é ZYPADHERA e para que é utilizado
- O que necessita saber antes de começar a usar ZYPADHERA
- Como usar ZYPADHERA
- Possíveis efeitos adversos
- Conservação de ZYPADHERA
- Conteúdo do envase e informações adicionais
1. O que é ZYPADHERA e para que é utilizado
ZYPADHERA contém olanzapina como substância ativa. ZYPADHERA pertence a um grupo de medicamentos denominados antipsicóticos e é utilizado para tratar a esquizofrenia – uma doença com sintomas tais como ouvir, ver ou perceber coisas que não existem, crenças erróneas, suspeita incomum e retraimento. As pessoas com esta doença também podem sentir-se deprimidas, ansiosas ou tensas.
ZYPADHERA está indicado em pacientes adultos que foram estabilizados previamente durante o tratamento com olanzapina oral.
2. O que necessita saber antes de começar a usar ZYPADHERA
Não use ZYPADHERA:
- se é alérgico a olanzapina ou a algum dos outros componentes deste medicamento (incluídos na secção 6). Uma reação alérgicapode manifestar-se em forma de erupção cutânea, picazón, inchação da face, dos lábios, ou dificuldade para respirar. Se sofreu algum desses sintomas alguma vez, por favor informe o seu médico ou enfermeiro.
- se previamente lhe foram diagnosticados problemas oculares, tais como certos tipos de glaucoma (aumento de pressão no olho).
Advertências e precauções
Consulte o seu médico ou enfermeiro antes de começar a usar ZYPADHERA.
- Uma reação pouco frequente mas grave, pode ocorrer após cada injeção.Às vezes, ZYPADHERA pode entrar no torrente sanguíneo demasiado rapidamente. Se isso lhe acontecer, poderá sofrer algum dos sintomas enumerados a seguir após cada injeção. Em alguns casos, estes sintomas podem provocar a perda de consciência.
• | sonolência excessiva | • | tontura | |
• | confusão | • | desorientação | |
• | irritabilidade | • | ansiedade | |
• | agressividade |
| ||
• | dificuldade para falar | • | sanguínea | |
• | dificuldade para caminhar | debilidade | ||
• | convulsões |
|
Estes sintomas normalmente desaparecem em 24 a 72 horas após a injeção. Após cada injeção, deverá permanecer em observação no seu centro de saúde durante pelo menos 3 horas por si apresenta algum dos sintomas acima indicados.
Embora seja pouco provável, pode sofrer estes sintomas uma vez transcorridas 3 horas após a injeção. Se isso lhe acontecer, entre em contacto com o seu médico ou enfermeiro imediatamente. Como consequência deste risco, não deve conduzir veículos nem manejar máquinas durante o resto do dia após cada injeção.
- Se se sentir tonto ou desmaiar após a injeção, informe o seu médico ou enfermeiro. É provável que tenha que deitar-se até que se sinta melhor. Pode que o médico ou enfermeiro queira tomar-lhe a tensão e verificar o seu pulso.
- Não se recomenda o uso de ZYPADHERA em pacientes de idade avançada com demência(confusão ou perda de memória) pois pode provocar efeitos adversos graves.
- Em muito raras ocasiões, os medicamentos deste tipo podem causar movimentos anormais, principalmente na face ou na língua ou uma combinação de febre, respiração acelerada, suor, rigidez muscular e sopor ou sonolência. Se isso lhe acontecer após receber ZYPADHERA, informe o seu médico ou enfermeiro de forma imediata.
- Verificou-se um aumento de peso nos pacientes que estão a tomar ZYPADHERA. O senhor e o seu médico devem verificar o seu peso com regularidade. Se for necessário, o seu médico pode ajudá-lo a planificar uma dieta ou considerar a possibilidade de o remeter a um nutricionista.
- Verificaram-se níveis elevados de açúcar e gorduras (triglicéridos e colesterol) no sangue nos pacientes que estão a usar ZYPADHERA. O seu médico deve fazer-lhe análises de sangue para controlar o seu açúcar no sangue e os níveis de gordura antes de começar a usar ZYPADHERA e de forma regular durante o tratamento.
- Informa o seu médico se o senhor ou alguém na sua família tem antecedentes de coágulos sanguíneos, pois os medicamentos deste tipo têm sido associados à formação de coágulos no sangue.
Informa o seu médico o mais rapidamente possível se sofrer alguma das seguintes afecções:
- Acidente vascular cerebral ou “mini” acidente vascular cerebral (sintomas transitórios de acidente vascular cerebral)
- Doença de Parkinson
- Problemas de próstata
- Obstrução intestinal (Íleo paralítico)
- Doença hepática ou renal
- Distúrbios do sangue
- Um infarto recente, doença coronária, síndrome do nó enfermo (ritmos cardíacos anormais), angina instável ou tensão arterial baixa.
- Diabetes
- Convulsões
- Se acredita que pode ter perda de sais como consequência de ter diarreia e vómitos intensos de forma prolongada ou por uso de medicamentos diuréticos (comprimidos para urinar)
Como precaução rotineira, recomenda-se medir a tensão arterial periodicamente em pacientes maiores de 65 anos.
Não se recomenda começar o tratamento com ZYPADHERA se o senhor tiver mais de 75 anos.
Crianças e adolescentes
Os pacientes menores de 18 anos não devem usar ZYPADHERA.
Outros medicamentos e ZYPADHERA
Informa o seu médico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Em especial, informa o seu médico se está a tomar:
- medicamentos para a doença de Parkinson.
- carbamazepina (um antiepiléptico e estabilizador do humor), fluvoxamina (um antidepressivo) ou ciprofloxacino (um antibiótico) – é possível que se tenha que modificar a sua dose de
ZYPADHERA.
Se já está a tomar antidepressivos, medicamentos para aliviar a ansiedade ou para o ajudar a dormir (tranquilizantes), pode sentir-se mais sonolento se tomar ZYPADHERA.
Uso de ZYPADHERA com álcool
Deve evitar todo o consumo de álcool se lhe foi administrada ZYPADHERA, pois em combinação com álcool, pode causar sonolência.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de receber esta injeção.
Não deve receber esta injeção se está a amamentar, pois pequenas quantidades de olanzapina podem passar para o leite materno.
Podem ocorrer os seguintes sintomas em bebés recém-nascidos, de mães que foram tratadas com ZYPADHERA no último trimestre de gravidez (últimos três meses da sua gravidez): tremores, rigidez e/ou fraqueza muscular, sonolência, agitação, problemas ao respirar, e dificuldade na alimentação. Se o seu bebé desenvolver algum desses sintomas, deve contactar o seu médico.
Condução e uso de máquinas
Não conduza nem use máquinas durante o resto do dia após cada injeção.
ZYPADHERA contém sódio
Uma vez reconstituído este medicamento contém menos de 1 mmol de sódio (23 mg) por frasco; isto é, essencialmente “isento de sódio”.
3. Como usar ZYPADHERA
O seu médico decidirá a quantidade de ZYPADHERA que necessita e com que frequência necessita receber uma injeção. ZYPADHERA é administrado em doses de 150 mg a 300 mg cada 2 semanas ou de 300 mg a 405 mg cada 4 semanas.
ZYPADHERA é apresentado em forma de pó que o seu médico ou enfermeiro reconstituirá para criar uma suspensão que depois lhe será injectada no músculo da nádega.
Se usar mais ZYPADHERA do que deve
Este medicamento será administrado sob supervisão médica. Por isso, é pouco provável que receba uma quantidade excessiva.
Os pacientes que receberam mais olanzapina do que deviam, também experimentaram os seguintes sintomas:
- ritmo cardíaco acelerado, agitação/agressividade, problemas de fala, movimentos anormais (especialmente na face ou na língua) e níveis diminuídos de consciência.
Outros sintomas poderiam incluir:
- confusão aguda, convulsões (epilepsia), coma, uma combinação de febre, respiração acelerada, suor, entumecimento muscular, e um estado de sopor ou sonolência, respiração mais lenta, aspiração, tensão arterial elevada ou baixa, ritmos cardíacos anormais.
Entre em contacto com o seu médico ou hospital de forma imediata se experimentar algum dos sintomas previamente descritos.
Se esquecer de usar ZYPADHERA
Não interrompa o tratamento só porque começa a se sentir melhor. É importante que continue a ser administrado ZYPADHERA durante todo o tempo indicado pelo seu médico.
Se faltar à consulta para a sua injeção, deve contactar o seu médico para concertar a próxima injeção o mais rapidamente possível.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Entre em contacto com o seu médico imediatamente se o senhor tiver:
- sonolência excessiva, tontura, confusão, desorientação, dificuldade para falar, dificuldade para andar, rigidez muscular ou agitação, fraqueza, irritabilidade, agressividade, ansiedade, aumento da pressão sanguínea ou convulsões e pode chegar a provocar perda de consciência. Estes sinais e sintomas podem dever-se a que às vezes ZYPADHERA pode entrar no torrente sanguíneo demasiado rapidamente (efeito adverso frequente que pode afetar até 1 de cada 10 pessoas);
- movimentos anormais (um efeito adverso frequente que pode afetar até 1 de cada 10 pessoas) especialmente da face ou da língua;
- coágulos sanguíneos nas veias (um efeito adverso pouco frequente que pode afetar até 1 de cada 100 pessoas), especialmente nas pernas (os sintomas incluem inchação, dor e vermelhidão na perna), que podem viajar através do sangue para os pulmões, causando dor no peito e dificuldade para respirar. Se experimentar algum desses sintomas, acuda ao médico imediatamente.
- combinação de febre, respiração acelerada, suor, rigidez muscular e um estado de obnubilação ou sonolência (a frequência não pode ser estimada a partir dos dados disponíveis)
Outros efeitos adversos frequentes (podem afetar até 1 de cada 10 pessoas) com ZYPADHERA incluem sonolência e dor no local da injeção.
Dentro dos efeitos adversos raros com ZYPADHERA (podem afetar 1 de cada 1.000 pessoas) inclui-se infecção no local da injeção.
Os efeitos adversos que se enumeram a seguir foram observados ao administrar olanzapina por via oral, mas podem aparecer após a administração de ZYPADHERA.
Outros efeitos adversos muito frequentes (podem afetar mais de 1 de cada 10 pessoas) incluem aumento de peso e aumento dos níveis de prolactina no sangue. Nas primeiras fases do
tratamento, algumas pessoas podem sentir tonturas ou desmaios (com latidos do coração mais lentos), sobretudo ao incorporar-se quando estão deitados ou sentados. Esta sensação costuma desaparecer espontaneamente, mas se não ocorrer assim, consulte o seu médico.
Outros efeitos adversos frequentes (podem afetar até 1 de cada 10 pessoas) incluem alterações nos níveis de algumas células sanguíneas, gorduras no torrente sanguíneo e ao início do tratamento aumentos temporários das enzimas hepáticas; aumentos do nível de açúcares no sangue e na urina; aumento dos níveis de ácido úrico e creatina fosfoquinase no sangue; aumento do apetite; tonturas; agitação; tremores; movimentos extraños (discinesias); constipação; secura da boca; erupção cutânea; perda de força; cansaço excessivo; retenção de líquidos produzindo inchação nas mãos, tornozelos ou pés; febre; dor nas articulações; e disfunções sexuais tais como diminuição da libido em homens e mulheres ou disfunção erétil em homens.
Outros efeitos adversos pouco frequentes (podem afetar até 1 de cada 100 pessoas) incluem hipersensibilidade (p. ex. inflamação da boca e da garganta, picazón; erupção na pele); diabetes ou agravamento do diabetes, relacionados ocasionalmente com cetoacidose (acetona no sangue e na urina) ou coma; convulsões, na maioria dos casos relacionados com antecedentes de convulsões (epilepsia); rigidez muscular ou espasmos (incluindo movimentos dos olhos); síndrome de pernas inquietas; problemas com a fala; tartamudez; ritmo cardíaco lento; sensibilidade à luz solar; sangramento pelo nariz; distensão abdominal; salivação excessiva; perda de memória ou esquecimento; incontinência urinária; perda da habilidade para urinar; queda de cabelo; ausência ou diminuição dos períodos menstruais; e alterações na glândula mamária em homens e em mulheres tais como produção anormal de leite materno ou crescimento anormal.
Efeitos adversos raros (podem afetar até 1 pessoa de cada 1000) incluem diminuição da temperatura corporal normal; ritmos cardíacos anormais; morte súbita de origem desconhecida; inflamação do pâncreas que provoca dor de estômago intenso; febre e vómitos; doença hepática que se manifesta como uma coloração amarelada da pele e da parte branca dos olhos; doença muscular que se manifesta com dores articulares de origem desconhecida; e ereção prolongada e/ou dolorosa.
Efeitos adversos muito raros incluem reações alérgicas graves tais como reação a fármaco com eosinofilia e sintomas sistémicos (DRESS por suas siglas em inglês). Inicialmente DRESS manifesta-se com sintomas semelhantes à gripe com sarpullido na face e posteriormente, com um sarpullido extenso, febre, gânglios linfáticos aumentados, elevação das enzimas hepáticas observada em análise de sangue e aumento de um tipo de glóbulos brancos do sangue (eosinofilia).
Durante o tratamento com olanzapina, os pacientes de idade avançada com demência podem sofrer acidente vascular cerebral, pneumonia, incontinência urinária, quedas, cansaço excessivo, alucinações visuais, aumento da temperatura corporal, vermelhidão da pele e dificuldade para caminhar. Alguns casos de falecimento foram observados neste grupo de pacientes em particular.
Olanzapina por via oral pode agravar os sintomas em pacientes com a doença de Parkinson.
Comunicação de efeitos adversos
Se experimentar algum tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, o senhor pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de ZYPADHERA
Mantenha este medicamento fora da vista e do alcance das crianças.
Não administre a injeção após a data de validade indicada no envase.
Não refrigerar nem congelar.
Verificou-se a estabilidade química e física da suspensão nos frascos durante 24 horas a 20 - 25ºC. Desde um ponto de vista microbiológico, o medicamento deve ser administrado imediatamente. Se não for assim, os tempos de armazenamento e as condições de uso antes do seu emprego são responsabilidade do profissional de saúde e normalmente não devem superar as 24 horas a 20 - 25ºC. Não use este produto se notar decoloração ou outros sinais visíveis de deterioração.
Se não for utilizado o medicamento de forma imediata, deve ser agitado de forma vigorosa para conseguir a ressuspensão. Uma vez retirada a suspensão do frasco para a seringa, deve ser usado de imediato.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de ZYPADHERA
O princípio ativoé olanzapina.
ZYPADHERA 210 mg: Cada frasco contém pamoato de olanzapina monohidratado, equivalente a 210 mg de olanzapina.
ZYPADHERA 300 mg: Cada frasco contém pamoato de olanzapina monohidratado, equivalente a 300 mg de olanzapina.
ZYPADHERA 405 mg: Cada frasco contém pamoato de olanzapina monohidratado, equivalente a 405 mg de olanzapina
Uma vez reconstituído, cada mililitro da suspensão contém 150 mg/ml de olanzapina.
Os componentes do dissolventesão carmelosa sódica, manitol, polissorbato 80, água para preparações injetáveis, ácido clorídrico e hidróxido de sódio.
Aspecto do produto e conteúdo do envase
ZYPADHERA pó para suspensão injetável de libertação prolongada apresenta-se como um pó amarelo num frasco de vidro transparente. O seu médico ou enfermeiro o reconstituirá numa suspensão que será administrada sob a forma de injeção utilizando o conteúdo do frasco de dissolvente para ZYPADHERA que se apresenta como uma solução transparente, incolor ou de cor amarela pálida, dentro de um frasco de vidro transparente.
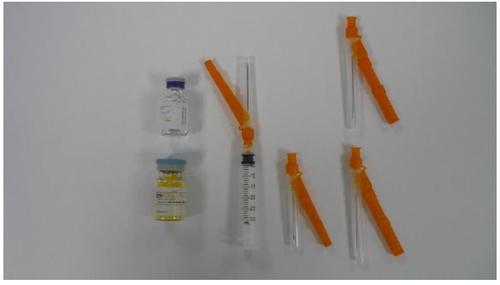
ZYPADHERA é um pó e dissolvente para suspensão injetável de libertação prolongada. Cada envase contém um frasco de pó para suspensão injetável de libertação prolongada, um frasco de 3 ml de dissolvente, uma seringa com uma agulha de segurança de calibre 19 e de 38 mm anexada e três agulhas de segurança separadas; uma agulha de calibre 19 e de 38 mm e duas agulhas de calibre 19 e de 50 mm.
Título da autorização de comercialização
CHEPLAPHARM Registration GmbH, Weilerstr. 5e, 79540 Lörrach, Alemanha.
Responsável pela fabricação
Lilly S.A., Avda. de la Industria 30, 28108 Alcobendas, Madrid, Espanha.
Data da última revisão deste prospecto:
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos http://www.ema.europa.eu/.
INSTRUÇÕES PARA OS PROFISSIONAIS DE SAÚDE
INSTRUÇÕES PARA A RECONSTITUIÇÃO E ADMINISTRAÇÃO
ZYPADHERA olanzapina pó e dissolvente para suspensão injetável de libertação prolongada
SÓ PARA INJEÇÃO INTRAMUSCULAR PROFUNDA NO GLÚTEO.
NÃO ADMINISTRAR POR VIA INTRAVENOSA OU SUBCUTÂNEA.
Reconstituição
PASO 1: Preparação dos materiais
O envase inclui:
- Frasco de ZYPADHERA pó para suspensão injetável de libertação prolongada
- Frasco de dissolvente para ZYPADHERA
- Uma seringa hipodérmica e uma agulha de segurança (dispositivo hipodérmico)
- Uma agulha de segurança hipodérmica do calibre 19, de 38 mm
- Duas agulhas de segurança hipodérmicas do calibre 19, de 50 mm
- Prospecto
- Cartão de instruções para a Reconstituição e Administração (este documento)
- Informação de Segurança e Instruções de Uso do Dispositivo Hipodérmico
|
Recomenda-se a utilização de luvas, pois ZYPADHERA pode provocar irritação da pele.
Reconstituir ZYPADHERA pó para suspensão injetável de libertação prolongada exclusivamente com o dissolvente fornecido no envase, mediante técnicas assépticas padrão para a reconstituição de produtos parenterais.
PASO 2: Determinação do volume de dissolvente para a reconstituição
Esta tabela indica a quantidade de dissolvente necessária para reconstituir ZYPADHERA pó para suspensão injetável de libertação prolongada.
Concentração do frasco de ZYPADHERA (mg) | Volume de dissolvente a adicionar (ml) |
210 | 1,3 |
300 | 1,8 |
405 | 2,3 |
É importante ressaltar que o frasco contém mais dissolvente do que o necessário para reconstituir o produto.
PASO 3: Reconstituição de ZYPADHERA
- Golpear suavemente o frasco para soltar o pó.
- Abrir a seringa hipodérmica e a agulha pré-embalada com o dispositivo de proteção para agulhas. Abrir a bolsa de plástico e sacar o dispositivo. Unir a seringa (se ainda não estiver) ao conector tipo Luer do dispositivo com um giro simples. Colocar a agulha firmemente sobre o dispositivo empurrando e girando no sentido dos ponteiros do relógio. Em seguida, retire diretamente a capa da agulha. Se não seguir estas instruções, pode produzir-se uma lesão por picada de agulha.
- Retirar o volume de dissolvente pré-determinado (Paso 2) dentro da seringa.
- Injetar o volume de dissolvente requerido no frasco de pó.
- Retirar o ar para igualar a pressão no frasco.
- Retirar a agulha, com o frasco para cima para impedir a perda de dissolvente.
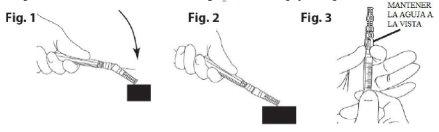
- Colocar o dispositivo de segurança para agulhas. Colocar a agulha em sua capa utilizando uma técnica com uma única mão. Realizar esta manobra com uma mão fazendo uma pressão SUAVE da capa contra uma superfície plana. AO PRESSIONAR SOBRE A CAPA (Fig. 1), A AGULHA SE CONECTA A ELA FIRMEMENTE (Fig. 2)
- Confirmar visualmente que a agulha está completamente conectada à sua capa protetora. Retirar o dispositivo com a agulha sujeita à seringa, quando for necessário, mediante um procedimento médico específico. Retirá-lo segurando o conector tipo Luer do dispositivo de proteção da agulha com ajuda dos dedos polegar e índice, e deixando os outros três dedos restantes afastados do dispositivo onde se encontra a ponta da agulha (Fig. 3).
|
- Golpear o frasco de forma vigorosa repetidas vezes sobre uma superfície dura até que não reste pó visível. Proteger a superfície para amortecer o impacto. (Ver Figura A)
|
Figura A: Golpear vigorosamente para misturar
- Verificar o frasco visualmente para identificar aglomeração do pó. O pó que não está em suspensão tem um aspecto de grumos secos de cor amarela pálida adheridos ao frasco. Pode ser necessário continuar golpeando se permanecem grumos. (Ver Figura B)
|
Sem suspender: grumos visíveis Suspensa: sem grumos
Figura B: Verificar se há pó sem suspender e seguir golpeando se necessário.
- Agitar o frasco energeticamente até que a suspensão tenha um aspecto uniforme com cor e texturas homogêneas. O produto suspenso aparecerá amarelo e opaco. (Ver Figura C)
|
Figura C: Agitar o frasco vigorosamente
Se se formar espuma, deixe o frasco repousar para que se disipe a espuma. Se não se utilizar o produto de forma imediata, deve agitar-se de forma vigorosa para conseguir a ressuspensão. ZYPADHERA reconstituído permanece estável no frasco até um máximo de 24 horas.
Administração
PASO 1: Injetar ZYPADHERA
Esta tabela confirma o volume final de ZYPADHERA em suspensão que deve ser injetado. A concentração da suspensão é 150 mg/ml de olanzapina.
Dose (mg) | Volume final a injetar (ml) |
150 | 1,0 |
210 | 1,4 |
300 | 2,0 |
405 | 2,7 |
- Determinar qual agulha se vai empregar para administrar ao paciente a injeção. Para os pacientes obesos, recomenda-se para a injeção agulhas de 50 mm:
- Se se empregar a agulha de 50 mm para a injeção, coloque a agulha de segurança de 38 mm na seringa para retirar o volume de suspensão requerido.
- Se se empregar a agulha de 38 mm para a injeção, coloque a agulha de segurança de 50 mm para retirar o volume de suspensão requerido.
- Retirar lentamente a quantidade desejada. Permanecerá um pouco de produto sobrante no frasco.
- Colocar o dispositivo de segurança para agulhas e retirar a agulha da seringa.
- Colocar a agulha de segurança, selecionando a de 50 mm ou a de 38 mm, na seringa antes da injeção. Uma vez extraída a suspensão do frasco e passada para a seringa, deve ser injetada de forma imediata.
- Selecionar e preparar o local da injeção na zona glútea. NÃO INJETAR POR VIA INTRAVENOSA OU SUBCUTÂNEA.
- Depois de inserir a agulha, aspirar durante alguns segundos para confirmar que não sai nada de sangue. Se se aspirar sangue dentro da seringa, descartar a seringa e preparar uma nova suspensão. A injeção deve ser realizada com pressão firme e contínua.
NÃO MASSAJAR O LOCAL DA INJEÇÃO.
- Colocar o dispositivo de segurança de agulhas. (Fig. 1 e 2)
- Descartar os frascos, seringa, agulhas usadas, agulha adicional e o dissolvente sobrante de acordo com os procedimentos clínicos adequados. O frasco é de uso único.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADAForma farmacêutica: COMPRIMIDO, 10 mgSubstância ativa: olanzapineFabricante: Neuraxpharm Spain S.L.Requer receita médicaForma farmacêutica: COMPRIMIDO, 2,5 mgSubstância ativa: olanzapineFabricante: Neuraxpharm Spain S.L.Requer receita médicaForma farmacêutica: COMPRIMIDO, 5 mgSubstância ativa: olanzapineFabricante: Neuraxpharm Spain S.L.Requer receita médica
Alternativas a ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA em Polonia
Alternativa a ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA em Ucrania
Médicos online para ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de ZYPADHERA 300 mg PÓ E SOLVENTE PARA SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA – sujeita a avaliação médica e regras locais.