VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA

Pergunte a um médico sobre a prescrição de VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA

Como usar VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA
Introdução
Prospecto: informação para o utilizador
Vaxigrip suspensão injetável em seringa pré-carregada
Vacina antigripal trivalente (vírus fracionados, inativados)
Leia todo o prospecto atentamente antes de si ou seu filho serem vacinados porque contém informações importantes para si ou seu filho.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Esta vacina foi-lhe prescrita apenas para si ou para seu filho e não deve dá-la a outras pessoas, embora tenham os mesmos sintomas que si, pois pode prejudicá-las.
- Se si ou seu filho experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Vaxigrip e para que é utilizado
- O que precisa saber antes de si ou seu filho começarem a usar Vaxigrip
- Como usar Vaxigrip
- Posíveis efeitos adversos
- Conservação de Vaxigrip
- Conteúdo do envase e informação adicional
1. O que é Vaxigrip e para que é utilizado
Vaxigrip é uma vacina.
Esta vacina é administrada a si ou a seu filho a partir dos 6 meses de idade, está indicada para protegê-lo(a) contra a gripe.
Quando se injeta a uma pessoa a vacina Vaxigrip, o sistema imunológico (o sistema de defesas naturais do corpo) produzirá proteção (anticorpos) contra a infecção. Quando se administra a vacina durante a gravidez, além de proteger a mulher grávida, também protege o seu bebê desde o nascimento até os 6 meses de idade através da transmissão da proteção da mãe para o bebê durante a gravidez (ver também as seções 2 e 3).
Nenhum dos componentes da vacina pode causar gripe.
O uso de Vaxigrip deve basear-se nas recomendações oficiais.
A gripe é uma doença que pode espalhar-se rapidamente e é causada por diferentes tipos de cepas que podem mudar todos os anos. Devido a esta mudança potencial nas cepas circulantes todos os anos, bem como a duração da proteção prevista pela vacina, a vacinação é recomendada todos os anos. Há um maior risco de contágio por gripe durante os meses frios entre outubro e março. Se si ou seu filho não se vacinaram no outono, é possível vacinar até a primavera, pois si ou seu filho correm o risco de se infectar com a gripe durante esse período. O seu médico poderá recomendar a melhor data para a vacinação.
O objetivo de Vaxigrip é proteger si ou seu filho contra as três cepas do vírus contidas na vacina após cerca de 2 a 3 semanas da injeção.
Além disso, o período de incubação da gripe é de alguns dias, de modo que se si ou seu filho se expuserem à gripe imediatamente antes ou após a vacinação, poderão desenvolver a doença.
A vacina não o(a) protegerá contra o resfriado comum, mesmo que alguns dos sintomas sejam semelhantes aos da gripe.
2. O que precisa saber antes de começar a usar Vaxigrip
Para se certificar de que Vaxigrip é adequado para si ou seu filho, é importante que consulte o seu médico ou farmacêutico se algum dos pontos descritos a seguir o(a) afetar a si ou a seu filho. Se houver algo que não entende, consulte o seu médico ou farmacêutico para que o esclareça.
Não use Vaxigrip
- Se si ou seu filho são alérgicos a:
- Os princípios ativos, ou
- A qualquer um dos outros componentes desta vacina (enumerados na seção 6), ou
- A qualquer um dos componentes que podem estar presentes em quantidades mínimas, como ovos (ovoalbúmina ou proteínas de frango), neomicina, formaldeído ou octoxinol-9.
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de começar a usar Vaxigrip.
Consulte o seu médico antes de se vacinar se si ou seu filho tiverem:
- Uma resposta imunológica debilitada (imunodeficiência ou tratamento com medicamentos que afetem o sistema imunológico),
- Problemas de sangramento ou se produzem hematomas com facilidade.
Se si ou seu filho tiverem uma doença aguda com febre, a vacinação deve ser adiada até que a febre tenha desaparecido.
O seu médico decidirá se si ou seu filho devem receber a vacina.
Antes ou após qualquer injeção, pode ocorrer um desmaio (especialmente em adolescentes), por isso deve informar o seu médico ou enfermeiro se si ou seu filho desmaiaram em ocasiões anteriores após a administração de uma injeção.
Como todas as vacinas, Vaxigrip pode não proteger totalmente a todas as pessoas que se vacinam.
Nem todos os bebês menores de 6 meses de idade nascidos de mulheres grávidas vacinadas durante a gravidez estarão protegidos.
Crianças
Não se recomenda o uso de Vaxigrip em crianças menores de 6 meses de idade.
Uso de Vaxigripcomoutros medicamentos
Informa o seu médico ou farmacêutico se si ou seu filho estão utilizando, utilizaram recentemente ou possam ter que utilizar qualquer outro medicamento ou vacina.
- Vaxigrip pode ser administrado ao mesmo tempo que outras vacinas em diferentes locais de injeção.
- A resposta imunológica pode diminuir no caso de tratamentos imunossupressores, tais como os corticosteroides, os medicamentos citotóxicos ou a radioterapia.
Gravidez elactação
Se está grávida ou em período de lactação, acredita que possa estar grávida, consulte o seu médico ou farmacêutico antes de utilizar esta vacina.
Vaxigrip pode ser utilizado em todas as fases da gravidez.
Vaxigrip pode ser usado durante o período de lactação.
O seu médico/farmacêutico poderá decidir se si deve ser vacinado com Vaxigrip.
Condução e uso de máquinas
Vaxigrip tem uma influência nula ou insignificante sobre a capacidade de conduzir e usar máquinas.
Vaxigrip contém potássio e sódio
Este medicamento contém menos de 1 mmol de potássio (39 mg) e menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente "isento de potássio" e "isento de sódio".
3. Como usar Vaxigrip
Posologia
Adultos: 1 dose de 0,5 ml.
Uso em crianças e em adolescentes
As crianças a partir dos 6 meses até os 17 anos de idade recebem uma dose de 0,5 ml.
Se seu filho tem menos de 9 anos de idade e não foi previamente vacinado contra a gripe, deve ser administrada uma segunda dose de 0,5 ml após um intervalo de pelo menos 4 semanas.
Se está grávida, uma dose de 0,5 ml administrada durante a gravidez pode proteger o seu bebê desde o nascimento até os 6 meses de idade. Para mais informações, pergunte ao seu médico ou farmacêutico.
Como é administrado Vaxigrip
O seu médico ou enfermeiro administrará a dose recomendada da vacina com uma injeção no músculo ou sob a pele.
Se si ou seu filho receberem mais Vaxigrip do que devem
Em alguns casos, foi administrada involuntariamente mais doses do que a recomendada.
Nestes casos, quando foram notificados acontecimentos adversos, estes estavam em linha com os descritos após a administração da dose recomendada (ver seção 4).
Se tiver alguma dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Posíveis efeitos adversos
Como todos os medicamentos, esta vacina pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Se experimentar uma reação alérgica, entre em contato imediatamente com o seu médico ou profissional de saúde ou dirija-se imediatamente ao serviço de urgências do hospital mais próximo.
Reações alérgicas
Podem ocorrer imediatamente após a administração da vacina e podem ser ameaçadoras para a vida.
Os sintomas podem incluir:
- erupção cutânea, picazão, dificuldade para respirar, falta de ar, inchaço do rosto, lábios, garganta ou língua, pressão arterial baixa, frequência cardíaca rápida e pulso débil, pele fria e pegajosa, tontura, fraqueza ou desfalecimento (reação anafilática, angioedema, choque).
- Outros sintomas podem incluir:
- zonas de picazão, vermelhidão, inchaço e rachadura da pele (dermatite atópica), rubor, sofoco, sangue na parte branca do olho (hiperemia ocular), vermelhidão e irritação do olho (conjuntivite), irritação da garganta, dor de garganta, irritação no interior do nariz, gotejamento nasal, espirros, congestão nasal, dos seios nasais ou da garganta, formigamento ou sensação de picadas na boca (parestesia oral), erupção na boca (erupção da mucosa oral), asma.
Estas reações alérgicas foram notificadas como pouco frequentes (podem afetar até 1 de cada 100 pessoas) a raras (podem afetar até 1 de cada 1 000 pessoas).
Efeitos adversos adicionais em adultos e pessoas idosas
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas):
- Dor de cabeça, dor muscular, mal-estar geral (mal-estar) (1), dor no local da injeção.
(1) Frequente em pessoas idosas
Frequentes (podem afetar até 1 de cada 10 pessoas):
- Febre (2), calafrios, reações no local da injeção: vermelhidão (eritema), dureza (induração), inchaço.
(2) Pouco frequente em pessoas idosas
Pouco frequentes (podem afetar até 1 de cada 100 pessoas):
- Inchaço dos gânglios do pescoço, axilas ou virilhas (linfadenopatia) (3), fraqueza incomum (3), cansaço, sonolência (4), tontura (4), aumento da sudorese (hiperhidrose) (3), dor articular (3), diarreia, sensação de doença (náuseas), reações no local da injeção: hematomas, picazão, calor e mal-estar.
(3) Raro em pessoas idosas (4) Raro em adultos
Raros (podem afetar até 1 de cada 1 000 pessoas):
- Formigamento ou sensação de picadas (parestesia), vômitos, diminuição do apetite, doença semelhante à gripe.
- Diminuição da sensibilidade (hipoestesia), dor abdominal, alergia no local da injeção: apenas observados em adultos.
- Descamação da pele (exfoliação) no local da injeção: apenas observados em pessoas idosas.
Efeitos adversos adicionais em crianças de 3 a 17 anos de idade
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas):
- Dor de cabeça, dor muscular, mal-estar geral, calafrios, reações no local da injeção: dor, vermelhidão, inchaço, dureza (5).
(5) Frequente em crianças de 9 a 17 anos de idade
Frequentes (podem afetar até 1 de cada 10 pessoas):
- Febre, hematoma no local da injeção.
Pouco frequentes (podem afetar até 1 de cada 100 pessoas):
- Cansaço, tontura, diarreia, reações no local da injeção: picazão, calor.
- Inflamação dos gânglios do pescoço, axilas ou virilhas, dor abdominal, vômitos, inquietude, gemidos, dor articular, choro: apenas observados em crianças de 3 a 8 anos de idade.
- Redução do número de certos tipos de partículas no sangue chamadas plaquetas; um número baixo dessas pode provocar hematomas ou hemorragias excessivas (trombocitopenia): apenas observado em uma criança de 3 anos de idade.
- Fraqueza incomum, incômodo no local da injeção: apenas observados em crianças de 9 a 17 anos de idade.
Efeitos adversos adicionais em crianças de 6 a 35 meses de idade
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas):
- Irritabilidade (6), vômitos (7), dor muscular (8), mal-estar geral (8), febre, diminuição do apetite (6), reações no local da injeção; sensibilidade, vermelhidão.
- Choro anormal, sonolência: apenas observados em crianças menores de 24 meses de idade.
- Dor de cabeça: apenas observado em crianças a partir dos 24 meses de idade.
(6) Raro em crianças de 24 a 35 meses de idade
(7) Pouco frequente em crianças de 24 a 35 meses de idade
(8) Raro em crianças de 6 a 23 meses de idade
Frequentes (podem afetar até 1 de cada 10 pessoas):
- Diarreia, reações no local da injeção: endurecimento, hematoma, inchaço.
- Calafrios: apenas observado em crianças a partir dos 24 meses de idade.
Raros (podem afetar até 1 de cada 1 000 pessoas):
- Doença semelhante à gripe, reações no local da injeção: picazão, erupção.
Em crianças de 6 meses a 8 anos de idade que recebem 2 doses, os efeitos adversos são semelhantes tanto após a primeira dose quanto após a segunda dose. Alguns efeitos adversos podem ocorrer após a administração da segunda dose em crianças de 6 meses a 35 meses de idade.
A maioria dos efeitos adversos ocorreu geralmente nos 3 dias posteriores à vacinação e remitiu no prazo de 1 a 3 dias sem tratamento. A intensidade da maioria desses efeitos adversos foi de leve a moderada.
Desconhece-se a frequência dos seguintes efeitos adversos (não pode ser estimada a partir dos dados disponíveis) em toda a população, exceto na população para a qual é indicado acima o efeito adverso:
- Inflamação das glândulas do pescoço, axilas ou virilhas.
- Formigamento ou sensação de picadas (parestesia), dor situada na via nervosa (neuralgia) (9), ataques (convulsões), distúrbios neurológicos que podem provocar rigidez de pescoço, confusão, formigamento, dor e fraqueza dos membros, perda de equilíbrio, perda de reflexos, paralisia de uma parte ou de todo o corpo (encefalomielite, neurite (9), Síndrome de Guillain-Barré (9)).
- Inflamação dos vasos sanguíneos (vasculite) que pode dar origem a erupções cutâneas e, em casos muito raros, a problemas renais temporários.
- Redução temporária do número de certos tipos de partículas no sangue denominadas plaquetas; um número baixo dessas pode provocar hematomas ou hemorragias excessivas (trombocitopenia transitória).
(9) Não foi notificado em crianças de 6 a 35 meses de idade
Comunicação de efeitos adversos
Se si ou seu filho experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, si pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Vaxigrip
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize esta vacina após a data de validade que aparece no envase após CAD. A data de validade é o último dia do mês que se indica.
Conservar na geladeira (2°C - 8°C). Não congelar. Conservar a seringa no embalagem exterior para protegê-la da luz.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, si ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Vaxigrip
Os princípios ativos são: Vírus da gripe (fracionados, inativados) das seguintes cepas*:
- Cepa semelhante a A/Victoria/4897/2022 (H1N1)pdm09: (IVR-238)....... 15 microgramas HA**
- Cepa semelhante a A/Croácia/10136RV/2023(H3N2): (X-425A)............. 15 microgramas HA**
- Cepa semelhante a B/Áustria/1359417/2021: B/Michigan/01/2021 ..…... 15 microgramas HA**
Por dose de 0,5 ml
- cultivados em ovos de galinha embrionados procedentes de galinhas saudáveis
** hemaglutinina
Esta vacina cumpre com as recomendações da Organização Mundial da Saúde (Hemisfério Norte) e a decisão da União Europeia para a campanha 2025-2026.
Os demais componentes são: uma solução tampão que contém cloreto de sódio, hidrogenofosfato de sódio dihidrato, dihidrogenofosfato de potássio, cloreto de potássio e água para preparações injetáveis.
Alguns componentes, tais como ovos (ovoalbúmina, proteínas de galinha), neomicina, formaldeído ou octoxinol-9, podem estar presentes em quantidades muito pequenas (ver seção 2).
Aspecto do produto e conteúdo do envase
Depois de agitada cuidadosamente, a vacina é um líquido ligeiramente incolor e opalescente.
Vaxigrip é apresentado em uma seringa pré-carregada que contém 0,5 ml de suspensão injetável, com agulha fixa, com agulha separada ou com agulha de segurança, ou sem agulha, em embalagens de 1 ou 10. Pode ser que apenas alguns tamanhos de embalagens sejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
França
Responsável pela fabricação:
O fabricante responsável pela liberação dos lotes é:
Sanofi Winthrop Industrie
1541 avenue Marcel Mérieux
69280 Marcy l’Etoile
França
ou
Sanofi Winthrop Industrie
Voie de l’Institut – Parc Industriel d’Incarville
B.P 101
27100 Val de Reuil
França
ou
Sanofi-Aventis Zrt.
Building Dc5 - Campona Utca 1
Budapeste XXII,1225
Hungria
Representante local
sanofi-aventis, S.A.
C/ Rosselló i Porcel, 21
08016 Barcelona
Espanha
Tel: +34 93 485 94 00
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Estado Membro | Nome |
Áustria, Bélgica, Bulgária, Croácia, República Checa, Alemanha, Dinamarca, Estônia, Finlândia, França, Hungria, Islândia, Irlanda, Itália, Letônia, Lituânia, Luxemburgo, Malta, Países Baixos, Noruega, Polônia, Portugal, Romênia, Suécia, Eslovênia, Eslováquia, Espanha | Vaxigrip |
Chipre, Grécia | Vaxigrip TIV |
Data da última revisão desteprospecto: Junho 2025
Outras fontes de informação
Pode aceder a informação detalhada e actualizada sobre este medicamento escaneando com o seu telemóvel (smartphone) o código QR incluído no cartonagem. Também pode aceder a esta informação na seguinte direção de internet: https://vaxigrip-nh.info.sanofi.
--------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a médicos ou profissionais do sector sanitário:
Como com todas as vacinas injetáveis, deve dispor do tratamento médico e da supervisão apropriada no caso de ocorrer uma reação anafiláctica após a administração da vacina.
A vacina deve atingir a temperatura ambiente antes de sua utilização.
Agite antes de usar. Inspeccione visualmente antes da administração.
A vacina não se deve utilizar se apresentar partículas estranhas na suspensão.
Não se deve misturar com outros medicamentos na mesma seringa.
Esta vacina não se deve injetar directamente em nenhum vaso sanguíneo.
Ver também seção 3. Como usar Vaxigrip.
Instruções de uso da agulha de segurança com a seringa pré-carregada Luer Lock:
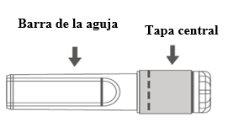
Imagem A: Agulha de segurança (dentro da barra) | Imagem B: Componentes da agulha de segurança (preparada para uso) |
|
|
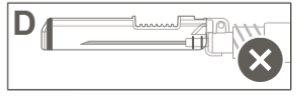
Paso 1:Para fixar a agulha à seringa, retire a tampa central para expor a barra da agulha, e gire suavemente a agulha no adaptador Luer Lock da seringa até que note uma ligeira resistência. |
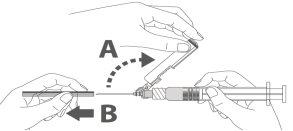
Paso 2:Extraia o protetor da agulha de segurança. A agulha está coberta pelo dispositivo de segurança e o protetor. |
Paso 3: A:Separe o dispositivo de segurança da agulha em direção ao corpo da seringa no ângulo que se mostra. B:Retire o protetor em linha recta. |
|
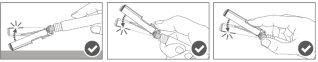
Paso 4:Uma vez finalizada a injeção, bloqueie (active) o dispositivo de segurança utilizando uma das três técnicas ilustradas (3) com uma única mão: ativação com uma superfície, com o polegar ou com o dedo indicador. Nota: A ativação é verificada por um "clic" audível e/ou táctil. |
|
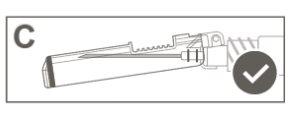
Paso 5:Inspeccione visualmente a ativação do dispositivo de segurança. O dispositivo de segurança deve estar completamente bloqueado (activado)como se mostra na figura C. A figura D mostra que o dispositivo de segurança NÃOestá completamente bloqueado (não activado). |
|
Precaução: Não tente desbloquear (desactivar) o dispositivo de segurança forçando a agulha fora do dispositivo de segurança.> |
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contacto com ele será realizada de acordo com a normativa local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDAForma farmacêutica: INJETÁVEL, 3,75 microgramasSubstância ativa: influenza, inactivated, split virus or surface antigenFabricante: Glaxosmithkline BiologicalsRequer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mlSubstância ativa: influenza, inactivated, split virus or surface antigenFabricante: Sanofi Winthrop IndustrieRequer receita médicaForma farmacêutica: INJETÁVEL, 60 microgramas de HASubstância ativa: influenza, inactivated, split virus or surface antigenFabricante: Sanofi Winthrop IndustrieRequer receita médica
Alternativas a VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA em Polónia
Alternativa a VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA em Ukraine
Médicos online para VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de VAXIGRIP SUSPENSÃO INJETÁVEL EM SERINGA PREENCHIDA – sujeita a avaliação médica e regras locais.