

Vaxigrip

Pergunte a um médico sobre a prescrição de Vaxigrip

Como usar Vaxigrip
folheto INCLUÍDO NA EMBALAGEM: INFORMAÇÃO PARA O UTILIZADOR
Vaxigrip, suspensão para injeção em seringa pré-cheia
Vacina trivalente contra a gripe (virião fendido), inativada
Deve ler atentamente o conteúdo do folheto antes de administrar a vacina, pois contém informações importantes para o paciente adulto ou criança.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de alguma dúvida, deve consultar um médico, farmacêutico ou enfermeiro.
- A vacina foi prescrita para uma pessoa específica. Não deve ser transmitida a outros.
- Se o paciente adulto ou criança apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto
- 1. O que é Vaxigrip e para que é utilizado
- 2. Informações importantes antes de administrar a vacina Vaxigrip
- 3. Como administrar a vacina Vaxigrip
- 4. Efeitos não desejados
- 5. Como conservar a vacina Vaxigrip
- 6. Conteúdo da embalagem e outras informações
1. O que é Vaxigrip e para que é utilizado
Vaxigrip é uma vacina.
Esta vacina administrada a adultos e crianças a partir de 6 meses de idade ajuda
a proteger contra a gripe.
Após a administração da vacina Vaxigrip, o sistema imunológico (sistema de defesa natural do organismo)
produzirá sua própria proteção contra a doença (anticorpos). A vacina administrada durante a gravidez
ajuda a proteger as mulheres grávidas, bem como o bebê desde o nascimento até os 6 meses de idade,
transmitindo a proteção da mãe para o bebê durante a gravidez (ver também pontos 2 e 3).
Nenhum dos componentes da vacina pode causar gripe.
A administração da vacina Vaxigrip deve ser feita de acordo com as recomendações oficiais.
A gripe é uma doença que pode se espalhar rapidamente e é causada por muitos diferentes
tipos de vírus, que podem mudar a cada ano. Devido a essa possível mudança anual
dos tipos de vírus, bem como devido ao período de duração da proteção fornecida pela
vacina, é recomendado realizar a vacinação todos os anos. O maior risco de contrair gripe ocorre durante os meses frios, entre outubro e março. No caso de adultos e crianças que não foram vacinados no outono, ainda é justificável se vacinar até a primavera, pois até essa época existe o risco de contrair gripe. O médico poderá recomendar o melhor momento para se vacinar.
A vacina Vaxigrip é destinada a proteger adultos e crianças contra os três tipos de vírus
contidos na vacina, cerca de 2-3 semanas após a vacinação.
Como o período de incubação da gripe é de alguns dias, no caso de exposição de um adulto ou criança
ao vírus da gripe logo antes ou depois da vacinação, ainda é possível contrair a doença.
A vacina não protege contra resfriados, embora alguns dos seus sintomas sejam semelhantes aos da gripe.
2. Informações importantes antes de administrar a vacina Vaxigrip
Deve informar o médico ou farmacêutico se alguma das seguintes afirmações se aplicar ao paciente adulto ou criança que vai receber a vacina Vaxigrip. Se algo não for claro, deve pedir ao médico ou farmacêutico para explicar.
Quando não administrar a vacina Vaxigrip
- Se o paciente adulto ou criança tiver alergia a:
- Substâncias ativas, ou
- Qualquer um dos outros componentes desta vacina (listados no ponto 6), ou
- Qualquer componente que possa estar presente em quantidades muito pequenas, como resíduos de ovo (albumina de ovo de galinha, proteínas de galinha), neomicina, formaldeído ou octoxinol-9.
Precauções e advertências
Antes de administrar a vacina Vaxigrip, deve conversar com o médico, farmacêutico ou
enfermeiro.
Antes da vacinação, deve informar o médico se o paciente adulto ou criança apresentar:
- Imunodeficiência (causada por deficiência imunológica ou uso de medicamentos que afetam o sistema imunológico),
- Sangramento ou tendência a hematomas. Se o paciente adulto ou criança tiver doença aguda com febre, a vacinação deve ser adiada até que a febre desapareça. O médico decidirá se o paciente adulto ou criança deve receber a vacina. A síncope pode ocorrer (especialmente em jovens) após, ou mesmo antes, de qualquer injeção. Portanto, deve informar o médico ou enfermeiro se o paciente ou seu filho teve síncope após injeções anteriores.
Assim como com qualquer vacina, a vacina Vaxigrip pode não fornecer proteção total a todas as pessoas vacinadas.
Nem todas as crianças com menos de 6 meses de idade, nascidas de mulheres vacinadas durante a gravidez,
serão protegidas.
Crianças
A administração da vacina Vaxigrip não é recomendada em crianças com menos de 6 meses de idade.
Vacina Vaxigrip e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos ou vacinas que o paciente adulto ou criança está tomando atualmente ou recentemente, bem como sobre medicamentos ou vacinas que planejam tomar.
- A vacina Vaxigrip pode ser administrada concomitantemente com outras vacinas, mas em membros diferentes.
- Em caso de uso de medicamentos ou terapias que reduzam a imunidade, como corticosteroides, medicamentos citotóxicos ou radioterapia, a resposta imunológica à vacinação pode ser reduzida.
Gravidez e amamentação
Se a paciente estiver grávida ou amamentando, suspeitar que possa estar grávida, deve consultar um médico ou farmacêutico antes de administrar esta vacina.
A vacina Vaxigrip pode ser administrada em todas as fases da gravidez.
A vacina Vaxigrip pode ser utilizada durante a amamentação.
O médico/farmacêutico decide sobre a possibilidade de administração da vacina Vaxigrip.
Condução de veículos e operação de máquinas
A vacina Vaxigrip não tem efeito ou tem efeito insignificante na capacidade de conduzir veículos e operar máquinas.
Vacina Vaxigrip contém potássio e sódio
Este medicamento contém menos de 1 mmol de potássio (39 mg) e menos de 1 mmol de sódio (23 mg) por dose, ou seja, o medicamento é considerado "livre de potássio" e "livre de sódio".
3. Como administrar a vacina Vaxigrip
Dosagem
Adultos recebem uma dose de 0,5 ml.
Administração em crianças e adolescentes
Crianças a partir de 6 meses de idade até 17 anos de idade recebem uma dose de 0,5 ml.
Crianças abaixo de 9 anos de idade que nunca foram vacinadas contra a gripe devem receber uma segunda dose de 0,5 ml após um intervalo de pelo menos 4 semanas.
No caso de mulheres grávidas, uma dose de 0,5 ml administrada durante a gravidez pode proteger o bebê desde o nascimento até os 6 meses de idade. Para obter mais informações, deve consultar um médico ou farmacêutico.
Como administrar a vacina Vaxigrip
O médico ou enfermeiro administrará a dose recomendada da vacina como uma injeção no músculo ou sob a pele.
Administração de dose maior do que a recomendada da vacina Vaxigrip
Em alguns casos, foi administrada uma dose maior do que a recomendada.
Nesses casos, quando foram relatados efeitos não desejados, eles foram consistentes com os relatados após a administração da dose recomendada (ver ponto 4).
Em caso de dúvidas adicionais sobre a administração desta vacina, deve consultar um médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, esta vacina pode causar efeitos não desejados, embora não ocorram em todos.
Deve entrar em contato imediatamente com um médico ou profissional de saúde, ou ir ao pronto-socorro mais próximo, se ocorrer uma reação alérgica.
Reações alérgicas
Podem ocorrer imediatamente após a administração da vacina e podem ser fatais.
Os sintomas podem incluir:
- erupção cutânea, coceira (prurido), dificuldade para respirar, falta de ar, inchaço (edema) do rosto, lábios, garganta ou língua, pressão arterial baixa, taquicardia e pulso fraco, pele fria e úmida, tontura, fraqueza ou síncope (reação anafilática, angioedema, choque).
Outros sintomas podem incluir:
- áreas de pele coçadas, vermelhas, inchadas (edema) e rachadas (dermatite atópica), rubor súbito, ondas de calor, sangue no branco dos olhos (conjuntivite),
vermelhidão e irritação dos olhos (conjuntivite), irritação da garganta, dor de garganta, irritação no interior do nariz, coriza, espirros, nariz entupido, seios ou garganta, formigamento ou sensação de queimadura na boca (parestesia na boca), erupção cutânea na boca (lesões na mucosa bucal), asma.
Essas reações alérgicas foram relatadas como ocorrendo raramente (podem afetar até 1 em 100 pessoas) ou muito raramente (podem afetar até 1 em 1000 pessoas).
Efeitos não desejados adicionais em adultos e idosos
Muito frequentes (podem afetar mais de 1 em 10 pessoas):
- dor de cabeça, dor muscular, mal-estar geral, dor no local da injeção.
Frequentes (podem afetar até 1 em 10 pessoas):
- febre, calafrios, reações no local da injeção: vermelhidão (eritema), endurecimento, inchaço.
Pouco frequentes (podem afetar até 1 em 100 pessoas):
- aumento do tamanho dos gânglios linfáticos na região do pescoço, axilas ou virilha (linfadenopatia), fraqueza incomum, sensação de fadiga, sonolência, tontura, suor excessivo, dor articular, diarreia, sensação de náusea (náusea), reações no local da injeção: hematoma (equimose), coceira, aquecimento, desconforto.
Muito raros (podem afetar até 1 em 1000 pessoas):
- sensação de formigamento ou queimadura (parestesia), vômitos, diminuição do apetite, sintomas semelhantes aos da gripe.
- fraqueza dos sentidos (hipestesia), dor abdominal, alergia no local da injeção: observada apenas em adultos.
- descamação da pele no local da injeção: observada apenas em adultos.
Efeitos não desejados adicionais em crianças de 3 a 17 anos
Muito frequentes (podem afetar mais de 1 em 10 pessoas):
- dor de cabeça, dor muscular, mal-estar geral, calafrios, reações no local da injeção: dor, vermelhidão, inchaço, endurecimento.
Frequentes (podem ocorrer menos frequentemente do que em 1 em 10 pessoas):
- febre, hematoma (equimose) no local da injeção. Pouco frequentes (podem afetar até 1 em 100 pessoas):
- sensação de fadiga, tontura, diarreia, reações no local da injeção: coceira, aquecimento.
- aumento do tamanho dos gânglios linfáticos na região do pescoço, axilas ou virilha, dor abdominal, vômitos, irritabilidade, choradeira, dor articular, diminuição do apetite: observada apenas em crianças de 3 a 8 anos.
- diminuição do número de certos tipos de células no sangue chamadas plaquetas; o número reduzido delas pode causar sangramento excessivo ou hematoma (trombocitopenia): observada apenas em uma criança de 3 anos.
- fraqueza incomum, desconforto no local da injeção: observada apenas em crianças de 9 a 17 anos.
Efeitos não desejados adicionais em crianças de 6 meses a 35 meses
Muito frequentes (podem afetar mais de 1 em 10 pessoas):
- irritabilidade, vômitos, dor muscular, mal-estar geral, febre, diminuição do apetite, reações no local da injeção: sensibilidade, vermelhidão.
- choro incomum, sonolência: observada apenas em crianças abaixo de 24 meses.
- dor de cabeça: observada apenas em crianças acima de 24 meses.
Frequentes (podem ocorrer menos frequentemente do que em 1 em 10 pessoas):
- diarreia, reações no local da injeção: endurecimento, hematoma (equimose), inchaço.
- calafrios: observada apenas em crianças acima de 24 meses. Muito raros (podem afetar até 1 em 1000 pessoas):
- sintomas semelhantes aos da gripe, reações no local da injeção: coceira, erupção cutânea.
A frequência de ocorrência dos seguintes efeitos não desejados é desconhecida (não pode ser estimada com base nos dados disponíveis) na população em geral, exceto na população para a qual o efeito não desejado é mencionado acima:
- aumento do tamanho dos gânglios linfáticos na região do pescoço, axilas ou virilha.
- sensação de formigamento ou queimadura (parestesia), dor ao longo dos nervos (neuralgia), convulsões, distúrbios neurológicos que podem causar rigidez no pescoço, desorientação, formigamento, dor e fraqueza nos membros, perda de equilíbrio, perda de reflexos, paralisia de parte ou todo o corpo (encefalite, neurite, síndrome de Guillain-Barré).
- vasculite, que pode levar a erupções cutâneas e, em casos muito raros, a distúrbios temporários da função renal.
- diminuição temporária do número de certos tipos de células no sangue chamadas plaquetas; o número reduzido delas pode causar sangramento excessivo ou hematoma (trombocitopenia transitória).
Notificação de efeitos não desejados
Se o paciente adulto ou criança apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Site: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao responsável pelo produto.
A notificação de efeitos não desejados pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar a vacina Vaxigrip
A vacina deve ser conservada em local não visível e inacessível a crianças.
Não deve ser administrada após o vencimento da data de validade impressa na etiqueta e embalagem
após "Validade (EXP)". A data de validade indica o último dia do mês indicado.
Conservar na geladeira (2 ° C–8 ° C). Não congelar. Conservar a seringa pré-cheia no embalagem exterior para proteger da luz.
Os medicamentos não devem ser jogados no esgoto ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais utilizados. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que a vacina Vaxigrip contém
As substâncias ativas são: Vírus da gripe (inativado, fendido) dos seguintes tipos*:
A/Victoria/4897/2022 (H1N1)pdm09-semelhante ao tipo (A/Victoria/4897/2022, IVR-238)
............................................................................................................. 15 microgramas HA**
A/Croácia/10136RV/2023 (H3N2)-semelhante ao tipo (A/Croácia/10136RV/2023, X-425A)
............................................................................................................. 15 microgramas HA**
B/Áustria/1359417/2021-semelhante ao tipo (B/Michigan/01/2021, tipo selvagem)
............................................................................................................. 15 microgramas HA**
em uma dose de 0,5 ml
*multiplicado em embriões de galinhas provenientes de rebanhos saudáveis
**hemaglutinina
A vacina é conforme as recomendações da Organização Mundial da Saúde (World Health Organization, WHO) para o hemisfério norte e as recomendações da União Europeia para a temporada 2025/2026.
Os outros componentes são: solução tampão contendo cloreto de sódio, cloreto de potássio, fosfato dissódico di-hidratado, fosfato de potássio di-hidratado, água para injeção.
Alguns componentes, como ovos (albumina de ovo de galinha, proteínas de galinha), neomicina, formaldeído ou octoxinol-9, podem estar presentes em quantidades muito pequenas (ver ponto 2).
Como é a vacina Vaxigrip e o que o embalagem contém
Após uma agitação suave, a vacina é um líquido incolor e opalescente.
A vacina Vaxigrip é uma suspensão para injeção em seringa pré-cheia de 0,5 ml, com agulha anexada, com agulha separada ou sem agulha ou com agulha separada em uma capa de proteção, em embalagem de 1 ou 10, todo em uma caixa de papelão. Nem todos os tamanhos de embalagem precisam estar disponíveis.
Responsável e fabricante
Responsável:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly, França
Fabricante:
Sanofi Winthrop Industrie, 1541 avenue Marcel Mérieux, 69280 Marcy l'Etoile, França
Sanofi Winthrop Industrie, Voie de l’Institut - Parc Industriel d'Incarville, B.P. 101, 27100 Val de
Reuil, França
Sanofi-Aventis Zrt., Edifício Dc5, Campona Utca 1, Budapest XXII, 1225, Hungria
Este medicamento é autorizado para comercialização nos países membros da Área Econômica Europeia sob os seguintes nomes:
| País membro | Nome |
| Áustria, Bélgica, Bulgária, Croácia, República Tcheca, Dinamarca, Estônia, Finlândia, França, Espanha, Holanda, Irlanda, Islândia, Lituânia, Luxemburgo, Letônia, Malta, Alemanha, Noruega, Polônia, Portugal, Romênia, Eslováquia, Eslovênia, Suécia, Hungria, Itália | Vaxigrip |
| Chipre, Grécia | Vaxigrip TIV |
Data da última atualização do folheto:junho de 2025
Outras fontes de informação
As informações atualmente aprovadas sobre este produto estão disponíveis
---------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico profissional:
Assim como com todas as vacinas administradas por injeção, é necessário garantir o tratamento e supervisão médica adequados em caso de ocorrência de reação anafilática após a administração da vacina.
Antes da administração, a vacina deve atingir a temperatura ambiente.
Agitar antes de usar. Verificar visualmente antes de administrar.
A vacina não deve ser administrada se houver partículas sólidas na suspensão.
A vacina não deve ser misturada com outros medicamentos na mesma seringa.
A vacina não deve ser injetada diretamente nos vasos sanguíneos.
Ver também o ponto 3. Como administrar a vacina Vaxigrip
| Instruções para o uso da agulha com capa de proteção com a seringa pré-cheia com ponta Luer | |
| Trava: | |
 | |
| Figura A: Agulha com capa de proteção (na embalagem) | Figura B: Componentes da capa de proteção da agulha (prontos para uso) |
| Passo 1: Para fixar a agulha na seringa, retire a capa da agulha (tampa do hub), para expor o hub da agulha e, em seguida, rosqueie a agulha no adaptador Luer Lock da seringa, até sentir uma ligeira resistência. | |
Passo 2: Retire a embalagem da agulha. A agulha é protegida por uma capa de proteção e uma capa de proteção adicional.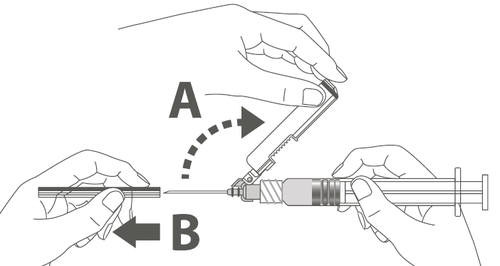 | |
| Passo 3: A: Afaste a capa de proteção da agulha na direção do corpo da seringa no ângulo mostrado. B: Retire a capa de proteção adicional. | 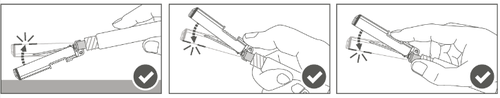 |
| Passo 4: Após a injeção, trave (ative) a capa de proteção, usando uma das três (3) técnicas de manipulação com uma mão: ativação em uma superfície plana, com o polegar ou o dedo indicador. Observação: A ativação é confirmada por um "clic" audível e (ou) palpável. | |
| Passo 5: Verifique visualmente o funcionamento da capa de proteção. A capa de proteção deve estar completamente travada (ativada), como mostrado na figura C. A figura D mostra que a capa de proteção NÃO está completamente travada (não está ativada). | 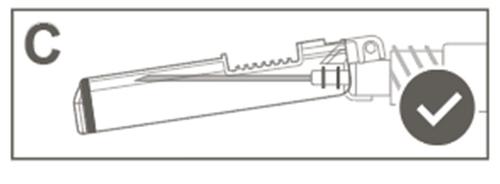 |
Aviso: Não tente desbloquear (desativar) o dispositivo de proteção empurrando a agulha para fora da capa de proteção.>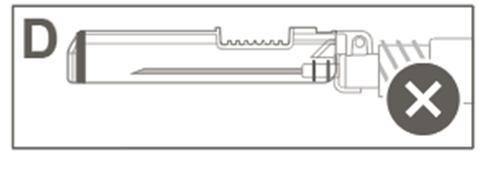 | |
Todos os resíduos não utilizados do medicamento ou seus resíduos devem ser eliminados de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorSanofi Winthrop Industrie Sanofi Winthrop Industrie Sanofi-Aventis Zrt.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a VaxigripForma farmacêutica: Suspensão, 60 mcg HA/cepa, 1 dose (0.7 ml)Substância ativa: influenza, inactivated, split virus or surface antigenRequer receita médicaForma farmacêutica: Suspensão, 60 mcg HA/cepa, 1 dose (0.5 ml)Substância ativa: influenza, inactivated, split virus or surface antigenRequer receita médicaForma farmacêutica: Suspensão, 1 dose (0.5 ml)Substância ativa: influenza, inactivated, split virus or surface antigenRequer receita médica
Alternativas a Vaxigrip noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Vaxigrip em Hiszpania
Alternativa a Vaxigrip em Ukraina
Médicos online para Vaxigrip
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Vaxigrip – sujeita a avaliação médica e regras locais.














