
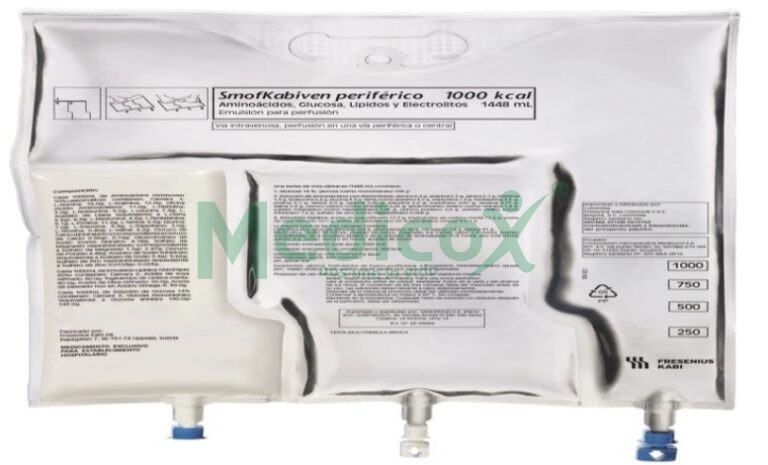
SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO

Como usar SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
SmofKabiven Periférico emulsão para perfusão
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto. Pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é SmofKabiven Periférico e para que se utiliza
- O que necessita saber antes de começar a usar SmofKabiven Periférico
- Como usar SmofKabiven Periférico
- Possíveis efeitos adversos
5 Conservação de SmofKabiven Periférico
- Conteúdo do envase e informação adicional
1. O que é SMOFKABIVEN PERIFÉRICO e para que se utiliza
SmofKabiven Periférico é uma emulsão para perfusão que se administra no seu sangue mediante um gotejador (perfusão intravenosa). O produto contém aminoácidos (componentes utilizados na formação de proteínas), glicose (carboidratos), lípidos (gordura) e sais (electrolitos) em uma bolsa de plástico, que pode ser administrada a adultos ou crianças a partir de 2 anos de idade
Um profissional de saúde lhe administrará SmofKabiven Periférico quando outras formas de alimentação não sejam suficientemente boas ou não sejam possíveis.
2. O que necessita saber antes de começar a usar SMOFKABIVEN PERIFÉRICO
Não use SmofKabiven Periférico:
-se é alérgico (hipersensível) aos princípios ativos ou a qualquer um dos outros componentes
deste medicamento (incluídos na secção 6).
-se é alérgico ao peixe ou ao ovo
-se é alérgico aos amendoins ou à soja, não deve utilizar este produto. SmofKabiven
Periférico contém óleo de soja.
-se tem demasiada gordura no seu sangue (hiperlipidemia)
-se padece uma alteração hepática grave
-se sofre problemas de coagulação do sangue (alterações da coagulação)
-se o seu organismo apresenta problemas para a utilização dos aminoácidos
-se sofre doença renal grave sem possibilidade de diálise
-se se encontra em choque agudo
-se tem demasiado açúcar no seu sangue (hiperglicemia), que não está controlada
-se tem níveis elevados no sangue (soro) dos sais (electrolitos) incluídos em
SmofKabiven Periférico
-se tem líquido nos pulmões (edema pulmonar agudo)
-se tem demasiado líquido no seu organismo (hiperhidratado)
-se apresenta insuficiência cardíaca que não está em tratamento
-se tem um defeito no seu sistema de coagulação do sangue (síndrome
hemofagocitótico)
-se se encontra em uma situação instável, como após um trauma grave, diabetes mellitus não controlada, ataque cardíaco agudo, derrame cerebral, coágulo de sangue, acidose metabólica (uma alteração que dá lugar a demasiado ácido no seu sangue), infecção severa (sepsis severa), coma, e se não tem suficiente líquido no seu organismo (deshidratação hipotónica).
-em crianças menores de 2 anos de idade
Advertências e precauções
Consulte o seu médico antes de começar a usar Smofkabiven periférico se tiver:
-problemas renais
-diabetes mellitus
-pancreatite (inflamação do pâncreas)
-problemas hepáticos
-hipotireoidismo (problemas da tiróide)
-sepsis (infecção grave)
Se durante a perfusão aparecer febre, erupção cutânea, inchaço, dificuldade para respirar, arrepios, suor, náuseas ou vómitos, informe o seu profissional de saúde imediatamente, porque estes sintomas poderiam ser causados por uma reação alérgica, ou porque está a receber demasiada quantidade do medicamento.
O seu médico necessitará regularmente controlar o seu sangue, para controlar os ensaios da função hepática e outros valores.
Crianças e adolescentes
SmofKabiven Periférico não está pensado para crianças recém-nascidas nem crianças de menos de 2 anos de idade. SmofKabiven Periférico pode ser administrado em crianças de 2 a 16/18 anos de idade.
Uso de Smofkabiven periférico com outros medicamentos
Informe o seu médico ou farmacêutico se está utilizando, utilizou recentemente ou poderia ter que utilizar qualquer outro medicamento, mesmo os adquiridos sem receita.
Gravidez e lactação
Não existe informação sobre o uso de SmofKabiven Periférico durante a gravidez ou no período de lactação. Por isso, SmofKabiven Periférico deveria ser administrado a mulheres grávidas ou em período de lactação apenas se o médico o considerar necessário. O uso de SmofKabiven Periférico pode ser considerado na gravidez e na lactação se o seu médico o aconselhar.
Consulte o seu médico ou farmacêutico antes de utilizar qualquer medicamento.
Condução e uso de máquinas
Não é relevante, pois este medicamento é administrado no hospital
3. Como usar SMOFKABIVEN PERIFÉRICO
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
O seu médico decidirá a dose para si de forma individual dependendo do seu peso corporal e da sua situação. SmofKabiven Periférico lhe será administrado por um profissional de saúde.
Se usar mais SmofKabiven Periférico do que devia:
É muito pouco provável que receba demasiada quantidade de medicamento, pois SmofKabiven Periférico lhe será administrado por um profissional de saúde.
4. Possíveis efeitos adversos
Como todos os medicamentos, SmofKabiven Periférico pode produzir efeitos adversos,
embora não todas as pessoas os sofram.
Frequentes(podem afetar até 1 de cada 10 doentes): um ligeiro aumento da temperatura
corporal. Inflamação em veias superficiais periféricas que estejam em contacto com o local de
injeção.
Pouco frequentes(podem afetar até 1 de cada 100 doentes): níveis elevados no sangue
(plasma) de componentes hepáticos, ausência de apetite, náuseas, vómitos, arrepios, tonturas e
dor de cabeça.
Raros(podem afetar até 1 de cada 1000 doentes): pressão sanguínea baixa ou elevada,
dificuldade para respirar, frequência cardíaca rápida (taquicardia). Reações de
hipersensibilidade (que podem dar sintomas como inchaço, febre, descida da pressão
sanguínea, erupções cutâneas, zonas vermelhas inchadas, rubor, dor de
cabeça). Sensações de frio e calor. Palidez. Lábios e
pele com coloração azulada (devido à falta de oxigénio no seu sangue). Dor no pescoço, nas costas, ossos, peito e zona lombar. .
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Español de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento..
5. Conservação de SMOFKABIVEN PERIFÉRICO
Mantenha este medicamento fora da vista e do alcance das crianças.
Mantenha na sobrebolsa. Não conserve por cima de 25º C. Não congele.
Não utilize este medicamento após a data de caducidade que aparece na bolsa e na caixa.
A data de caducidade é o último dia do mês que se indica.
6. Conteúdo do envase e informação adicional
Composição de SmofKabiven Periférico: | |
As substâncias ativas são | g por 1000 ml |
Glicose (como monohidrato) | 71 |
Alanina | 4,4 |
Arginina | 3,8 |
Glicina | 3,5 |
Histidina | 0,93 |
Isoluecina | 1,6 |
Leucina | 2,3 |
Lisina (como acetato) | 2,1 |
Metionina | 1,3 |
Fenilalanina | 1,6 |
Prolina | 3,5 |
Serina | 2,1 |
Taurina | 0,32 |
Treonia | 1,4 |
Triptófano | 0,63 |
Tirosina | 0,12 |
Valina | 2,0 |
Cloruro cálcico (como dihidrato) | 0,18 |
Glicerofosfato sódico (como hidrato) | 1,3 |
Sulfato magnésico (como heptahidrato) | 0,38 |
Cloruro potásico | 1,4 |
Acetato sódico (como trihidrato) | 1,1 |
Sulfato de zinco (como heptahidrato) | 0,004 |
Azeite de soja, refinado | 8,5 |
Triglicéridos de cadeia média | 8,5 |
Azeite de oliva, refinado | 7,0 |
Azeite de peixe, rico em ácidos graxos ômega-3 | 4,2 |
Os outros ingredientes são: glicerol, fosfolipídios de ovo purificados, todos-rac-α-tocoferol, hidróxido sódio (ajuste pH), oleato sódio, ácido acético (ajuste pH) e água para injetáveis
Aspecto do produto e conteúdo do envase
As soluções de glicose e aminoácidos são transparentes, incolores ou ligeiramente amarelas e livres de partículas. A emulsão lipídica é branca e homogênea.
Tamanhos do envase:
1 x 1.206 ml, 4 x 1.206 ml
1 x 1448 ml, 4 x 1448 ml
1 x 1.904 ml, 4 x 1.904 ml
Título da autorização de comercialização e responsável pela fabricação
Título:
Fresenius Kabi España S.A.U.
C/ Marina 16-18,
08005 Barcelona (Espanha)
Fabricante:
Fresenius Kabi AB, SE-751 74 Uppsala, Suécia
Fresenius Kabi Áustria GmbH, AT-8055 Graz, Áustria
Para qualquer informação sobre este produto, por favor contactar com o título da autorização de comercialização.
Data da última revisão deste prospecto: Março 2023
-----------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do setor sanitário:
Advertências e precauções especiais de uso
Para evitar os riscos associados a velocidades de perfusão demasiado rápidas, recomenda-se o uso de uma perfusão contínua e bem controlada, se possível mediante o uso de uma bomba de perfusão.
Como o uso de uma veia periférica está associado a um elevado risco de infecção, devem ser tomadas precauções assépticas estritas para evitar especialmente qualquer contaminação durante a inserção do catéter e a manipulação.
Devem ser monitorizados a glicose sérica, os eletrólitos e a osmolaridade, assim como o balanço hídrico, o equilíbrio ácido-base e os testes de enzimas hepáticas.
Ante qualquer sinal ou sintoma de reação anafiláctica (como febre, tremores, erupção cutânea ou dispnéia) deve ser interrompida imediatamente a perfusão.
SmofKabiven Periférico não deve ser administrado simultaneamente com sangue no mesmo equipamento de perfusão, devido ao risco de pseudoaglutinação.
Pode surgir tromboflebite se forem utilizadas as veias periféricas para infusão. O local de inserção do catéter deve ser avaliado diariamente por sintomas locais de tromboflebite.
Forma de administração
Via intravenosa, perfusão em uma veia periférica ou em uma veia central.
Para proporcionar uma nutrição parenteral completa, devem ser adicionados elementos traço, vitaminas e possivelmente eletrólitos a SmofKabiven Periférico (tendo em conta os eletrólitos já presentes em SmofKabiven Periférico), de acordo com as necessidades do paciente.
Posologia
Adultos
Dosagem: A faixa de doses de 20-40 ml SmofKabiven periférico/kg pc/dia aportará 0,6-1,3 g de aminoácidos/kg pc/dia (correspondentes a 0,10-0,20 g nitrogênio/kg pc/dia) e 14-28 kcal/kg pc/dia de energia total (11-22 kcal/kg pc/dia de energia não-proteica).
Velocidade de perfusão
A velocidade de perfusão máxima para glicose é 0,25 g/kg pc/h, para os aminoácidos 0,1 g/kg pc/h, e para lípidos 0,15 g/kg pc/h.
A velocidade de perfusão não deve exceder 3,0 ml/kg pc/hora (correspondente a 0,10 g de aminoácidos, 0,21 g de glicose e 0,08 g de lípidos/kg pc/h). O período de perfusão recomendado é de 14-24 horas.
Dose máxima diária: A dose máxima diária varia com a situação clínica do paciente e pode mesmo mudar de um dia para o outro. A dose diária máxima recomendada é de 40 ml/kg pc/dia.
População pediátrica
Crianças (2-11 anos)
Dosagem:
A dose de até 40 ml/kg pc/dia deve ser ajustada regularmente de acordo com os requisitos do paciente pediátrico que variam mais do que nos pacientes adultos.
Velocidade de perfusão:
A velocidade máxima de perfusão é de 3,0 ml/kg pc/h (correspondente a 0,10 g de aminoácidos/kg/h, 0,21 g/glicose/kg/h e 0,08 g lípidos/kg/h).
O período de perfusão recomendado é de 12-24 horas.
Se for usada a dose máxima diária recomendada, a dose deve ser perfundida durante um período de pelo menos 13 horas para não exceder a velocidade de perfusão máxima recomendada, exceto em casos particulares.
Dose máxima diária: A dose máxima diária varia com a condição clínica do paciente e pode mesmo mudar de dia a dia. A dose máxima diária é de 40 ml/kg pc/dia.
Adolescentes (12-16/18 anos)
SmofKabiven Periférico pode ser usado em adolescentes da mesma forma que em adultos.
Precauções para a utilização
Não utilizar o envase se estiver deteriorado.
Utilizar apenas se as soluções de aminoácidos e glicose são transparentes e incolores ou ligeiramente amarelas, e se a emulsão lipídica é branca e homogênea. Deve misturar-se o conteúdo das três câmaras separadas antes de utilizar, e antes de realizar qualquer adição através do porto de aditivos.
Depois da abertura das soldaduras tipo peel, a bolsa deve ser invertida várias vezes com o fim de garantir uma mistura homogênea, que não mostre evidência de uma separação de fases.
Para um único uso. Deve rejeitar-se qualquer mistura sobrante após a perfusão.
Compatibilidade
Existem dados de compatibilidade em quantidades definidas com os produtos de nome comercial Dipeptiven 200 mg/ml, Supliven, Glycophos 216 mg/ml, Vitalipid Adultos/Infantil e Soluvit liofilizado e genéricos de eletrólitos em concentrações definidas. Quando se realizem adições de eletrólitos, devem ser tidas em conta as quantidades já presentes na bolsa para satisfazer as necessidades clínicas do paciente. Os dados gerados apóiam as adições à bolsa ativada segundo a tabela resumo que se mostra a seguir.
Intervalo de compatibilidade estabelecido durante 7 dias, ou seja, 6 dias de armazenamento a 2-8ºC seguidos de 24 horas a 20-25ºC.
Unidades | Conteúdo total máximo | |||
Tamanho da bolsa de SmofKabiven Periférico | ml | 1206 | 1448 | 1904 |
Aditivo | Volume | |||
Dipeptiven | ml | 0 - 300 | 0 - 300 | 0 - 300 |
Supliven | ml | 0 - 10 | 0 - 10 | 0 - 10 |
Soluvit | vial | 0 - 1 | 0 - 1 | 0 - 1 |
Vitalipid Adultos/Infantil | ml | 0 - 10 | 0 - 10 | 0 - 10 |
Límites dos eletrólitos1 | Quantidade por bolsa | |||
Sódio | mmol | ≤ 180 | ≤ 225 | ≤ 300 |
Potássio | mmol | ≤ 180 | ≤ 225 | ≤ 300 |
Cálcio | mmol | ≤ 6 | ≤ 7,5 | ≤ 10 |
Magnésio | mmol | ≤ 6 | ≤ 7,5 | ≤ 10 |
Fosfato orgânico (Glycophos) | mmol | ≤ 18 | ≤ 22,5 | ≤ 30 |
Zinco | mmol | ≤ 0,2 | ≤ 0,25 | ≤ 0,3 |
Selênio | µmol | ≤ 1 | ≤ 1 | ≤ 1 |
1 inclui as quantidades de todos os produtos.
Nota: Esta tabela tem por objecto indicar a compatibilidade. Não é uma guia de dosagem. No caso dos produtos com nome comercial, antes de prescrevê-los, consulte a ficha técnica aprovada.
Existem dados sobre a compatibilidade com outros aditivos e o tempo de conservação das diferentes misturas, disponíveis sob pedido.
As adições devem ser realizadas assépticamente.
Período de validade após a mistura das câmaras da bolsa
Demonstrou-se a estabilidade física e química da bolsa de três câmaras misturada durante 48 horas a 20-25°C. Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente. Se não for utilizado imediatamente, o tempo de conservação até seu uso e as condições previas ao seu uso são responsabilidade do usuário e normalmente não devem ser superiores a 24 horas a 2-8 °C, a menos que a mistura tenha sido realizada em condições assépticas controladas e validadas.
Período de validade após a mistura com aditivos
Demonstrou-se estabilidade físico-química em uso da bolsa mista de três câmaras com aditivos até 7 dias, ou seja, 6 dias a 2-8ºC seguidos de 24 horas a 20-25ºC, incluindo a duração da administração. Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente após realizar as adições. Se não for utilizado imediatamente, o tempo de conservação até seu uso e as condições previas ao seu uso são responsabilidade do usuário. O tempo de conservação normalmente não deve ser superior a 24 horas a 2-8 °C, a menos que a mistura tenha sido realizada em condições assépticas controladas e validadas.
Instruções para o uso de SmofKabiven Periférico
A bolsa
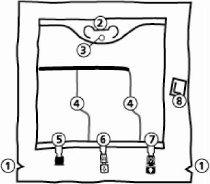
- Cortes na sobrebolsa
- Colgador
- Anel para colgar a bolsa
- Soldadura tipo Peel
- Porto sem saída (só se usa durante a fabricação)
- Porto de adição
- Porto de perfusão
- Absorvente de oxigênio
- Extração da sobrebolsa
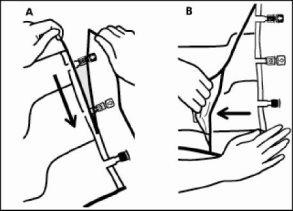
- Para extrair a sobrebolsa, segurá-la em posição horizontal e rasgar pela corte até os portos ao longo do bordo superior (A).
- Então, simplesmente rasgar ao longo do envase; separar a sobrebolsa e descartá-la junto com o absorvente de oxigênio (B).
- Mistura
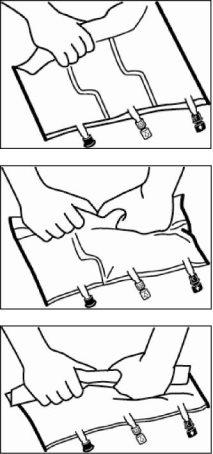
- Colocar a bolsa em uma superfície plana.
- Enrolar a bolsa com firmeza desde a parte do colgador até os portos, em primeiro lugar com a mão direita e exercendo a seguir uma pressão constante com a mão esquerda até que a soldadura vertical se rompa. A soldadura tipo peel se abre devido à pressão do fluido. As soldaduras tipo peel também podem abrir-se antes de retirar a sobrebolsa.
Nota:os líquidos se misturam com facilidade embora a soldadura horizontal permaneça fechada.
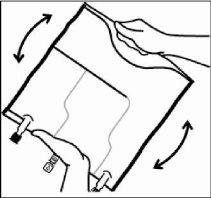
- Misturar o conteúdo das três câmaras por inversão da bolsa três vezes até que os componentes estejam misturados totalmente.
- Finalização da preparação:
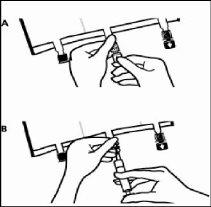
- Colocar de novo a bolsa em uma superfície plana. Pouco antes de injetar os aditivos, romper o porto de adição branco pela marca em forma de seta (A).
Nota:A membrana do porto de adição é estéril.
- Segurar a base do porto de adição. Introduzir a agulha, injetar os aditivos (de compatibilidade conhecida) pelo centro do ponto de injeção (B).
- Misturar totalmente entre cada adição, invertendo as bolsas três vezes. Utilizar seringas com agulhas de calibre 18 – 23 e uma longitude máxima de 40 mm.
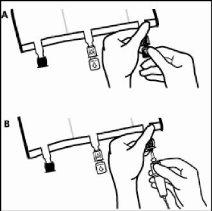
- Pouco antes de inserir o equipamento de perfusão, romper o porto de perfusão azul pela marca em forma de seta (A).
Nota:A membrana do porto de perfusão é estéril.
- Utilizar um equipamento de perfusão não ventilado ou fechar a entrada do ar do equipamento ventilado.
- Segurar a base do porto de perfusão.
- Introduzir a agulha através do porto de perfusão. O punção estará totalmente inserido para assegurar sua retenção.
Nota:A parte interna do porto de infusão é estéril.
- Suspensão da bolsa
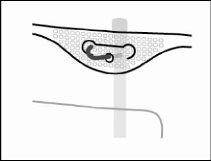
- Suspender a bolsa pelo anel que há sob o colgador.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 4,76 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 g / 3,5 g / 200 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: SOLUÇÃO INJETÁVEL PARA PERFUSÃO, 3,5 g / 200 g / 5,22 g / 1,88 g / 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 662 mg / 1,02 g / 4,76 g / 5,15 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 4,25 g / 300 g / 5,22 g / 1,54 g / 4,76 g / 1,53 g / 8,76 g / 4,08 g / 5,1 g / 6,2 g / 3,57 g / 3,4 g / 662 mg / 1,02 g / 5,78 g / 5,94 g / 6,16 g / 4,93 g / 17,6 g / 0,34 g / 9,78 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médica
Alternativas a SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO em Polónia
Alternativa a SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO em Ukraine
Médicos online para SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de SMOFKABIVEN PERIFÉRICA EMULSÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.














