
Finomel
Pergunte a um médico sobre a prescrição de Finomel

Como usar Finomel
Folheto informativo: Informação para o utilizador
Finomel, emulsão para infusão
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém
informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou a enfermeira.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou a enfermeira. Ver ponto 4.
Índice do folheto
- 1. O que é Finomel e para que é usado
- 2. Informações importantes antes de usar Finomel
- 3. Como usar Finomel
- 4. Efeitos não desejados
- 5. Como conservar Finomel
- 6. Conteúdo do pacote e outras informações
1. O que é Finomel e para que é usado
Finomel contém aminoácidos (componentes utilizados para construir proteínas), glicose (carboidratos),
lípidos (gorduras) e sais (eletrólitos).
Finomel é usado para nutrir adultos quando a alimentação normal por via oral não é
suficiente ou apropriada.
2. Informações importantes antes de usar Finomel
Quando não usar Finomel:
- se o doente tiver alergia a peixes, ovos, soja, proteínas de amendoins ou milho/ produtos que contenham milho (ver também ponto "Precauções e advertências" abaixo) ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6);
- se o doente tiver níveis elevados de gorduras no sangue;
- se o doente tiver doenças hepáticas graves;
- se o doente tiver distúrbios de coagulação do sangue;
- se o doente tiver doenças que afetam a capacidade do organismo de processar aminoácidos;
- se o doente tiver doenças renais graves;
- se o doente tiver níveis elevados de açúcar no sangue;
- se o doente tiver níveis elevados de eletrólitos (sódio, potássio, magnésio, cálcio e/ou fósforo) no sangue;
- se o doente tiver distúrbios durante a administração de grandes volumes de líquidos por via intravenosa, como edema pulmonar agudo, sobrecarga de líquidos e insuficiência cardíaca não controlada;
- se o doente tiver qualquer condição médica grave aguda, como lesões graves, diabetes não controlada, infarto do miocárdio, acidente vascular cerebral, embolia, acidose metabólica, septicemia grave (bactérias no sangue), desidratação hipotônica e coma hiperosmolar.
Em cada caso, o médico decidirá se o medicamento deve ser administrado com base em fatores como idade, peso corporal e condição clínica do doente, incluindo os resultados dos exames realizados.
Precauções e advertências
Antes de iniciar o uso de Finomel, deve discutir com o médico ou a enfermeira se o doente tiver:
- doenças renais graves. Também deve informar o médico se o doente está a fazer diálise (rim artificial) ou outros métodos de limpeza do sangue;
- doenças hepáticas graves;
- distúrbios de coagulação do sangue;
- função adrenal anormal (insuficiência adrenal). As glândulas adrenais são glândulas em forma de triângulo localizadas no topo dos rins;
- insuficiência cardíaca;
- doenças pulmonares;
- acúmulo de líquidos no organismo (sobrecarga de líquidos);
- falta de líquidos no organismo (desidratação);
- diabetes não tratada;
- infarto do miocárdio ou choque devido à insuficiência cardíaca aguda;
- acidose metabólica grave (pH do sangue muito ácido);
- infecção grave (septicemia).
Se ocorrerem sinais ou sintomas incomuns de reação alérgica, como febre, calafrios, erupções cutâneas ou dificuldade em respirar, deve interromper imediatamente a infusão. O medicamento contém óleo de peixe, óleo de soja e fosfatídios de proteína de ovo de galinha e glicose derivada do milho, que podem causar reações de sensibilidade. Foram observadas reações alérgicas cruzadas entre proteínas de soja e amendoins.
Dificuldade em respirar também pode ser um sinal de que se formaram pequenas partículas que bloqueiam os vasos sanguíneos nos pulmões (depósitos nos vasos pulmonares). Se ocorrerem dificuldades em respirar, deve informar o médico ou a enfermeira. Eles decidirão sobre a ação apropriada.
Em caso de dor, ardor, rigidez, inchaço ou alteração da cor da pele no local da infusão ou vazamento do líquido administrado por infusão, deve informar o médico ou a enfermeira. A administração do medicamento será interrompida imediatamente e, em seguida, reiniciada em outra veia.
Existe um risco especial de infecção ou septicemia (presença de bactérias ou toxinas no sangue) após a inserção de um cateter (cateter venoso) na veia do doente. O médico monitorará atentamente o doente para detectar qualquer sinal de infecção. O uso de "técnica asséptica" (ausência de microrganismos) durante a inserção e manutenção do cateter e durante a preparação do medicamento para nutrição pode reduzir o risco de desenvolvimento de infecção.
Em caso de uso de medicamentos semelhantes, foi relatado o ocorrido de síndrome de sobrecarga de gorduras.
A capacidade reduzida ou limitada do organismo de eliminar as gorduras contidas em Finomel pode resultar na chamada "síndrome de sobrecarga de gorduras" (ver ponto 4 - Efeitos não desejados).
Se o doente estiver gravemente desnutrido, de modo que precise receber alimentação por via intravenosa, é recomendável iniciar a nutrição parenteral lentamente e com cautela.
Exames adicionais de controle
Antes de iniciar a infusão, deve corrigir os distúrbios de equilíbrio hidroeletrolítico e metabólico do doente. O médico pode realizar exames clínicos e laboratoriais durante a administração deste medicamento para monitorar a eficácia e segurança da administração. O médico monitorará o doente e pode alterar a dose ou administrar um medicamento adicional.
Crianças e adolescentes
Não há experiência com o uso de Finomel em crianças e adolescentes.
Finomel e outros medicamentos
Deve informar o médico ou a enfermeira sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
Finomel contém cálcio. Não deve ser administrado juntamente ou pela mesma linha com um antibiótico chamado ceftriaxona, pois podem se formar partículas. Se esses medicamentos forem administrados sequencialmente usando o mesmo dispositivo, deve ser lavado cuidadosamente.
Óleo de oliva e óleo de soja presentes em Finomel contêm vitamina K. Normalmente, isso não afeta a ação de medicamentos anticoagulantes, como a cumarina. No entanto, se o doente estiver a tomar medicamentos anticoagulantes, deve informar o médico.
As gorduras presentes na emulsão podem interferir com os resultados de alguns exames laboratoriais, se a amostra de sangue para o exame for coletada antes que as gorduras sejam eliminadas da circulação sanguínea do doente (elas são eliminadas do sangue após 5 a 6 horas após a administração das gorduras).
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o médico antes de usar este medicamento. Não há dados sobre o uso de Finomel durante a gravidez e amamentação. Pode ser considerado o uso deste medicamento durante a gravidez e amamentação se o médico considerar necessário.
Condução de veículos e uso de máquinas
Não é relevante, pois este medicamento é administrado em um hospital.
3. Como usar Finomel
Este medicamento deve ser sempre usado de acordo com as recomendações do médico. Em caso de dúvidas, deve consultar o médico.
Este medicamento é administrado por infusão intravenosa (gotejamento) através de um pequeno tubo diretamente na veia.
O médico determinará a dose individualmente para cada doente, com base no peso corporal e na condição clínica do doente. Finomel será administrado por pessoal médico qualificado.
Uso em crianças
A segurança e eficácia do uso de Finomel não foram estabelecidas em crianças e adolescentes com menos de 18 anos.
Uso de dose maior do que a recomendada de Finomel
É pouco provável que o doente receba uma dose excessiva deste medicamento, pois Finomel é administrado por pessoal médico qualificado.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Foram relatados os seguintes efeitos não desejados com frequência desconhecida:
- reações de sensibilidade (que causam sintomas como inchaço, febre, queda da pressão arterial, erupções cutâneas, bolhas, rubor súbito, dor de cabeça).
- síndrome de realimentação (doença que ocorre após a alimentação após um longo período de jejum)
- níveis elevados de açúcar no sangue (hiperglicemia)
- tontura
- dor de cabeça
- inflamação das veias (tromboflebite)
- embolia pulmonar
- dificuldade em respirar
- náuseas
- vômitos
- temperatura corporal ligeiramente elevada
- níveis elevados no sangue (no soro) de compostos derivados do fígado
- síndrome de sobrecarga de gorduras
- vazamento da infusão para os tecidos circundantes (extravasamento)
Notificação de efeitos não desejados
Se ocorrerem qualquer efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados no folheto, deve informar o médico ou a enfermeira. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos
Al. Jerozolimskie 181C
PL 02-222 Varsóvia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
e-mail: [email protected]
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode permitir a coleta de mais informações sobre a segurança do medicamento.
5. Como conservar Finomel
O medicamento deve ser conservado em um local não visível e inacessível a crianças.
Conservar em sacos de proteção.
Não congelar.
Não usar este medicamento após a data de validade impressa na etiqueta do saco e na caixa após "Validade".
A data de validade é o último dia do mês indicado.
Não use este medicamento se notar partículas visíveis na solução ou se o saco estiver danificado.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não sejam necessários. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém Finomel
- Os componentes ativos do medicamento são por 1000 mlAlanina 10,52 Arginina 5,84 Glicina 5,23 Histidina 2,44 Isoluecina 3,05 Leucina 3,71 Lisina (na forma de lisina cloridrato) 3,68 Metionina 2,03 Fenilalanina 2,84 Prolina 3,45 Serina 2,54 Treonina 2,13 Triptofano 0,91 Tirosina 0,20 Valina 2,95 Octanato de sódio tri-hidratado 2,85 Cloruro de potássio 2,28 Cloruro de cálcio di-hidratado 0,38 Sulfato de magnésio heptahidratado 1,25 Glicerofosfato de sódio monohidratado 3,01 Sulfato de zinco heptahidratado 0,012 Glucose (na forma de glucose monohidratada) 139,5 Óleo de soja refinado 11,40 Óleo de oliva refinado 9,50 Triglicerídeos de ácidos graxos saturados de cadeia média 9,50
Óleo de peixe rico em ácidos graxos omega-3
7,60
- Os outros componentes são: ácido acético glacial, ácido clorídrico, fosfolipídios de ovo, glicerol, oleato de sódio, alfa-tocoferol, hidróxido de sódio, água para injeção.
Como é Finomel e que conteúdo tem o pacote
As soluções de glucose e aminoácidos são transparentes e incolores a ligeiramente amareladas e não contêm partículas sólidas.
A emulsão de gordura é branca e homogênea.
Após a mistura do conteúdo das 3 câmaras, o medicamento é uma emulsão branca.
Tamanhos do pacote:
4 x 1085 ml
4 x 1435 ml
4 x 1820 ml
Titular da autorização de comercialização e importador
Titular da autorização de comercialização:
Baxter Polska Sp. z o.o.
Ul. Kruczkowskiego 8
00-380 Varsóvia
Importador:
Baxter SA
Boulevard René Branquart 80
7860 Lessines
Bélgica
Este medicamento está autorizado para comercialização nos países membros da Área Económica Europeia sob as seguintes denominações:
| Áustria, República Checa, Alemanha, Grécia, Irlanda, Polônia, Espanha, Reino Unido | FINOMEL |
| Bélgica, Luxemburgo, Países Baixos | Omegomel |
| Dinamarca, Finlândia, Islândia, Itália, Noruega, Suécia | Finomel |
| França | FOSOMEL |
Data da última revisão do folheto:
--------------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
A. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Finomel é embalado em sacos de plástico tricâmara. Cada saco contém uma solução estéril e apirogênica de 42% de glucose, uma solução de 10% de aminoácidos com eletrólitos e uma emulsão de 20% de gordura.
A composição da emulsão final após a mistura do conteúdo das três câmaras é apresentada na tabela abaixo:
| Componentes ativos | 1085 ml | 1435 ml | 1820 ml |
| Óleo de peixe rico em ácidos graxos omega-3 | 8,24 g | 10,92 g | 13,84 g |
| Óleo de oliva refinado | 10,30 g | 13,65 g | 17,30 g |
| Óleo de soja refinado | 12,36 g | 16,38 g | 20,76 g |
| Triglicerídeos de ácidos graxos saturados de cadeia média | 10,30 g | 13,65 g | 17,30 g |
| Alanina | 11,41 g | 15,09 g | 19,13 g |
| Arginina | 6,34 g | 8,38 g | 10,63 g |
| Glicina | 5,68 g | 7,51 g | 9,52 g |
| Histidina | 2,64 g | 3,50 g | 4,44 g |
| Isoluecina | 3,31 g | 4,37 g | 5,54 g |
| Leucina | 4,02 g | 5,32 g | 6,75 g |
| Lisina (na forma de lisina cloridrato) | 3,20 g (3,99 g) | 4,23 g (5,29 g) | 5,36 g (6,70 g) |
| Metionina | 2,20 g | 2,92 g | 3,70 g |
| Fenilalanina | 3,09 g | 4,08 g | 5,17 g |
| Prolina | 3,75 g | 4,96 g | 6,28 g |
| Serina | 2,76 g | 3,65 g | 4,62 g |
| Treonina | 2,31 g | 3,06 g | 3,88 g |
| Triptofano | 0,99 g | 1,31 g | 1,66 g |
| Tirosina | 0,22 g | 0,29 g | 0,37 g |
| Valina | 3,20 g | 4,23 g | 5,36 g |
| Octanato de sódio tri-hidratado | 3,10 g | 4,10 g | 5,19 g |
| Cloruro de potássio | 2,47 g | 3,27 g | 4,14 g |
| Cloruro de cálcio di-hidratado | 0,41 g | 0,54 g | 0,68 g |
| Sulfato de magnésio heptahidratado | 1,36 g | 1,80 g | 2,28 g |
| Glicerofosfato de sódio monohidratado | 3,26 g | 4,32 g | 5,47 g |
| Sulfato de zinco heptahidratado | 0,013 g | 0,017 g | 0,021 g |
| Glucose (na forma de glucose monohidratada) | 137,8 g (151,5 g) | 181,9 g (200,0 g) | 231,0 g (254,1 g) |
B. POSOLOGIA E MODALIDADE DE ADMINISTRAÇÃO
Posologia
A posologia deve ser individualizada, com base no gasto energético, na condição clínica do doente, no peso corporal e na capacidade de metabolizar os componentes do medicamento Finomel, bem como nos componentes energéticos ou proteicos adicionais administrados por via oral ou enteral. Portanto, deve ser escolhido o tamanho apropriado do saco.
A necessidade diária média para doentes adultos é:
- para doentes com estado nutricional normal ou em condições de estresse catabólico leve: 0,6 - 0,9 g de aminoácidos/kg de peso corporal/dia (0,10 - 0,15 g de nitrogênio/kg de peso corporal/dia);
- para doentes com estresse metabólico moderado ou grave com ou sem desnutrição: 0,9 - 1,6 g de aminoácidos/kg de peso corporal/dia (0,15 - 0,25 g de nitrogênio/kg de peso corporal/dia);
- para doentes em condições especiais (por exemplo, com queimaduras ou anabolismo significativo), a necessidade de nitrogênio pode ser ainda maior.
A dose diária máxima é diferente dependendo da condição clínica do doente e pode mudar de um dia para o outro.
A velocidade de administração deve ser aumentada gradualmente durante a primeira hora.
A velocidade de administração deve ser ajustada com base na dose administrada, no volume diário e no tempo de duração da infusão.
O tempo de duração da infusão recomendado é de 14 a 24 horas.
A faixa de dose de 13 – 31 ml/kg de peso corporal/dia corresponde a 0,7 – 1,6 g de aminoácidos/kg de peso corporal/dia (o que corresponde a 0,11 – 0,26 g de nitrogênio/kg de peso corporal/dia) e 14 – 33 kcal/kg de peso corporal/dia de valor energético total (11 – 27 kcal/kg de peso corporal/dia de valor energético não proteico).
A velocidade máxima de administração de glucose é de 0,25 g/kg de peso corporal/hora, de aminoácidos 0,1 g/kg de peso corporal/hora e de gorduras 0,15 g/kg de peso corporal/hora.
A velocidade de administração não deve exceder 2,0 ml/kg de peso corporal/hora (o que corresponde a 0,10 g de aminoácidos, 0,25 g de glucose e 0,08 g de gorduras/kg de peso corporal/hora).
A dose diária máxima recomendada é de 35 ml/kg de peso corporal/dia e fornecerá 1,8 g de aminoácidos/kg de peso corporal/dia (o que corresponde a 0,29 g de nitrogênio/kg de peso corporal/dia), 4,5 g de glucose/kg de peso corporal/dia, 1,40 g de lipídios/kg de peso corporal/dia e um valor energético total de 38 kcal/kg de peso corporal/dia (o que corresponde a 30 kcal/kg de peso corporal/dia de valor energético não proteico).
Crianças e adolescentes
Não foram realizados estudos com Finomel em crianças e adolescentes.
Doentes com distúrbios renais ou hepáticos
Deve ser exercida cautela ao administrar Finomel a doentes com distúrbios hepáticos, incluindo colestase e/ou aumento da atividade de enzimas hepáticas. Os parâmetros de função hepática devem ser monitorados rigorosamente.
Modalidade de administração
Administração intravenosa, infusão em veia central.
Para instruções sobre a reconstituição do medicamento antes da administração, ver ponto E. Precauções especiais para a eliminação e preparação do produto para uso.
Para informações sobre a mistura com outros fluidos para infusão/sangue antes ou durante a administração, ver ponto C. Incompatibilidades farmacêuticas.
C. INCOMPATIBILIDADES FARMACÊUTICAS
Não deve ser misturado com outros medicamentos com os quais não tenha sido demonstrada compatibilidade.
Não deve ser misturado ou administrado com ceftriaxona, um antibiótico que contém cálcio, incluindo Finomel.
Não deve ser administrado Finomel juntamente com sangue pela mesma linha de infusão.
D. SOBREDOSAGEM
Em caso de sobredosagem, podem ocorrer náuseas, vômitos, calafrios, hiperglicemia e distúrbios eletrolíticos, bem como sinais de hiperolemia ou acidose. Nesses casos, a infusão deve ser interrompida imediatamente.
Em caso de hiperglicemia, deve ser instituído um tratamento apropriado para a condição clínica, administrando insulina e/ou ajustando a velocidade de infusão. Além disso, a sobredosagem pode causar sobrecarga de líquidos, distúrbios eletrolíticos e hiperosmolalidade.
Se os sintomas persistirem após a interrupção da infusão, pode ser considerada a realização de hemodiálise, hemofiltrção ou hemodiafiltrção.
E. PRECAUÇÕES ESPECIAIS PARA A ELIMINAÇÃO E PREPARAÇÃO DO PRODUTO PARA USO
Abrir:
- Remover o saco de proteção.
- Descartar o sachê que contém o adsorvente de oxigênio.
- Usar apenas se o saco estiver intacto e as soldas não estiverem danificadas (ou seja, o conteúdo das três câmaras não foi misturado), as soluções de aminoácidos e glucose são transparentes, incolores ou ligeiramente amareladas, sem partículas visíveis e a emulsão de gordura é homogênea e tem aparência leitosa.
Misturar o conteúdo das câmaras:
- Antes de romper as soldas, certifique-se de que o medicamento está à temperatura ambiente.
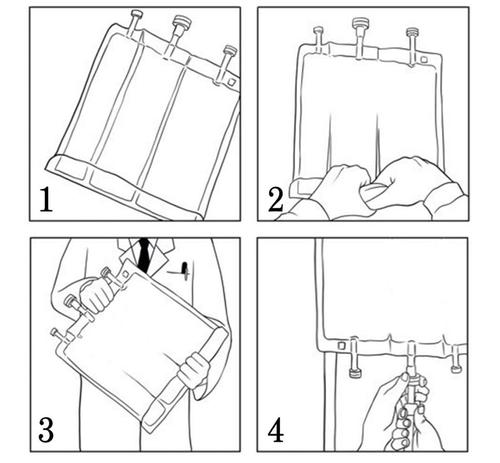
- Começando pelo topo do saco (perto da alça), role o saco com as duas mãos (Figura 1). As soldas desaparecerão a partir das extremidades. Continue a rolar o saco até que as soldas sejam rompidas até metade do comprimento. (Figura 2)
- Misture, girando o saco pelo menos 3 vezes. (Figura 3)
- Após a mistura, o medicamento tem a forma de uma emulsão homogênea e leitosa.
Após a remoção da tampa de proteção do porto de administração de medicamentos, pode adicionar componentes adicionais compatíveis através do porto de administração de medicamentos (ver subponto "Adição").
Remova a tampa de proteção do porto de infusão e conecte o conjunto de infusão. Pendure o saco no suporte de infusão e realize a infusão usando a técnica padrão. (Figura 4)
Após a abertura do saco, o conteúdo deve ser usado imediatamente e não deve ser armazenado para uma infusão posterior.
Não reconecte sacos parcialmente usados. Para evitar a possibilidade de formação de embolia aérea, não conecte sacos em série.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorBaxter S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FinomelForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médica
Alternativas a Finomel noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Finomel em Espanha
Alternativa a Finomel em Ukraine
Médicos online para Finomel
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Finomel – sujeita a avaliação médica e regras locais.














