
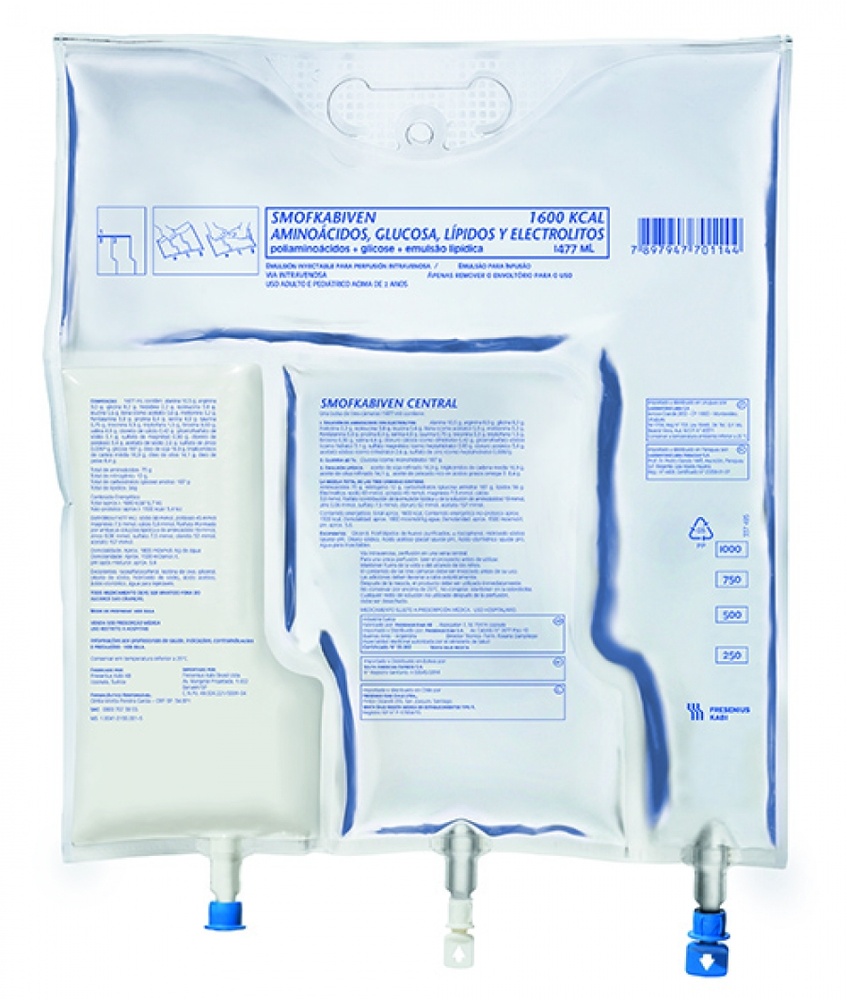
SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO

Como usar SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
SmofKabiven central emulsão para perfusão
Leia todo o prospecto detenidamente antes de começar a usar o medicamento, porque contém informações importantes para si
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto:
- O que é SmofKabiven central e para que é utilizado
- O que precisa saber antes de começar a usar SmofKabiven central
- Como usar SmofKabiven central
- Possíveis efeitos adversos
- Conservação de SmofKabiven central
- Conteúdo do envase e informação adicional
1. O que é SmofKabiven central e para que é utilizado
SmofKabiven central é uma emulsão para perfusão que é administrada no seu sangue mediante um gotejador (perfusão intravenosa). O produto contém aminoácidos (componentes utilizados na formação de proteínas), glicose (carboidratos), lípidos (gordura) e sais (electrolitos), em uma bolsa de plástico e pode ser administrado a adultos e crianças a partir de 2 anos de idade.
Um profissional de saúde irá administrar SmofKabiven central quando outras formas de alimentação não forem suficientemente boas ou não forem possíveis.
2. O que precisa saber antes de começar a usar SmofKabiven central
Não use SmofKabiven central:
-se é alérgico (hipersensível) aos princípios ativos ou a qualquer um dos outros componentes deste medicamento (incluídos na seção 6)
-se é alérgico ao peixe ou ao ovo
-se é alérgico aos amendoins ou à soja, não deve utilizar este produto. SmofKabiven central contém óleo de soja
-se tem demasiados lípidos no seu sangue (hiperlipidemia)
-se padece uma alteração hepática grave
-se sofre problemas de coagulação do sangue (alterações da coagulação)
-se o seu organismo apresenta problemas para a utilização dos aminoácidos
-se sofre doença renal grave sem possibilidade de diálise
-se se encontra em choque agudo
-se tem demasiado açúcar no seu sangue (hiperglicemia), que não está controlada
-se tem níveis elevados no sangue (soro) das sais (electrolitos) incluídas em SmofKabiven central
-se tem líquido nos pulmões (edema pulmonar agudo)
-se tem demasiado líquido no seu organismo (hiperhidratado)
-se apresenta insuficiência cardíaca que não está em tratamento
-se tem um defeito no seu sistema de coagulação do sangue (síndrome hemofagocitótico)
-se se encontra em uma situação instável, como após um trauma grave, diabetes mellitus não controlada, ataque cardíaco agudo, derrame cerebral, coágulo de sangue, acidose metabólica (uma alteração que dá lugar a demasiado ácido no seu sangue), infecção severa (sepsis severa), coma, e se não tem suficiente líquido no seu organismo (deshidratação hipotónica).
-em crianças menores de 2 anos
Advertências e precauções
Consulte o seu médico antes de começar a usar Smofkabiven central se tiver:
problemas renais
diabetes mellitus
pancreatite (inflamação do pâncreas)
problemas hepáticos
hipotireoidismo (problemas da tiróide)
sepsis (infecção grave)
Se durante a perfusão aparecer febre, erupção cutânea, inchaço, dificuldade para respirar, arrepios, suor, náuseas ou vómitos, informe o seu profissional de saúde imediatamente, porque estes sintomas poderiam ser causados por uma reação alérgica, ou porque está a receber demasiada quantidade do medicamento.
O seu médico necessitará regularmente controlar o seu sangue, para controlar os ensaios da função hepática e outros valores.
Crianças e adolescentes
SmofKabiven central não está pensado para crianças recém-nascidas nem crianças de menos de 2 anos de idade.
SmofKabiven central pode ser administrado a crianças de 2 a 16/18 anos de idade.
Uso de Smofkabiven central com outros medicamentos:
Informe o seu médico se está a tomar, tomou recentemente ou poderia ter que tomar qualquer outro medicamento, mesmo os adquiridos sem receita.
Gravidez e lactação:
Não existe informação sobre o uso de SmofKabiven central durante a gravidez ou no período de lactação. Por isso, SmofKabiven central deveria ser administrado a mulheres grávidas ou em período de lactação, apenas se o médico o considerar necessário. No entanto, o uso de SmofKabiven central pode ser considerado na gravidez e na lactação, se o seu médico o aconselhar.
Condução e uso de máquinas:
Não é relevante, porque este medicamento é administrado no hospital.
3. Como usar SmofKabiven central
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico. Em caso de dúvida, consulte novamente o seu médico.
O seu médico decidirá a dose para si de forma individual, dependendo do seu peso corporal e da sua situação. SmofKabiven central será administrado por um profissional de saúde.
Se usar mais SmofKabiven central do que deve
É muito pouco provável que use demasiada quantidade de medicamento, porque SmofKabiven central será administrado por um profissional de saúde.
4. Possíveis efeitos adversos
Como todos os medicamentos, SmofKabiven central pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Frequentes(podem afetar até 1 de cada 10 pacientes): um ligeiro aumento da temperatura corporal.
Pouco frequentes(podem afetar até 1 de cada 100 pacientes): níveis elevados no sangue (plasma) de componentes hepáticos, ausência de apetite, náuseas, vómitos, arrepios, tonturas e dor de cabeça.
Raros(podem afetar até 1 de cada 1000 pacientes): pressão sanguínea baixa ou elevada, dificuldade para respirar, frequência cardíaca rápida (taquicardia). Reações de hipersensibilidade (que podem dar sintomas como inchaço, febre, descenso da pressão sanguínea, erupções cutâneas, ronchas (zonas vermelhas inchadas), rubor, dor de cabeça). Sensações de frio e calor. Palidez. Lábios e pele com coloração azulada (devido à falta de oxigénio no seu sangue). Dor no pescoço, nas costas, nos ossos, no peito e na zona lombar.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Español de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de SmofKabiven central
Mantenha este medicamento fora da vista e do alcance das crianças. Mantenha na sobrebolsa. Não conserve acima de 25º C. Não congele.
Não utilize este medicamento após a data de validade que aparece na bolsa e na caixa. A data de validade é o último dia do mês que se indica.
6. Conteúdo do envase e informação adicional
SmofKabiven central contém
As substâncias ativas sãog por 1000 ml
Alanina 7,1
Arginina 6,1
Glicina 5,6
Histidina 1,5
Isoluecina 2,5
Leucina 3,8
Lisina (como acetato) 3,4
Metionina 2,2
Fenilalanina 2,6
Prolina 5,7
Serina 3,3
Taurina 0,5
Treonia 2,2
Triptófano 1,0
Tirosina 0,20
Valina 3,1
Cloruro cálcico (como dihidrato) 0,28
Glicerofosfato sódico (como hidrato) 2,1
Sulfato magnésico (como heptahidrato) 0,61
Cloruro potássico 2,3
Acetato sódico (como trihidrato) 1,7
Sulfato de zinco (como heptahidrato) 0,0066
Glucosa (como monohidrato) 127
Azeite de soja, refinado 11,4
Triglicéridos de cadeia média 11,4
Azeite de oliva, refinado 9,5
Azeite de peixe, rico em ácidos graxos ômega-3 5,7
Os demais componentes são: glicerol, fosfolipídios de ovo purificados, todo-rac-α-tocoferol, hidróxido sódio (ajuste pH), oleato sódio, ácido acético (ajuste pH), ácido clorídrico (ajuste pH) e água para injetáveis.
Aspecto do produto e conteúdo do envase
As soluções de glucosa e aminoácidos são transparentes, incolores ou ligeiramente amarelas e livres de partículas. A emulsão lipídica é branca e homogênea.
Tamanhos do envase:
1 x 493 ml, 6 x 493 ml
1 x 986 ml, 4 x 986 ml
1 x 1.477 ml, 4 x 1.477 ml
1 x 1.970 ml, 4 x 1.970 ml
1 x 2.463 ml, 3 x 2.463 ml
Título da autorização de comercialização e responsável pela fabricação
Título:
Fresenius Kabi España S.A.U. C/ Marina 16-18.
08005 Barcelona (Espanha )
Fabricante:
Fresenius Kabi AB, SE-751 74 Uppsala, Suécia
ou
Fresenius Kabi Áustria GmbH, Graz, Áustria
Data da última revisão deste prospecto:
Janeiro 2023
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
Esta informação está destinada apenas a profissionais do setor sanitário:
Advertências e precauções especiais de uso
Para evitar os riscos associados a velocidades de perfusão demasiado rápidas, recomenda-se o uso de uma perfusão contínua e bem controlada, se possível mediante o uso de uma bomba de perfusão.
Como o uso de uma veia central está associado a um elevado risco de infecção, devem ser tomadas precauções assépticas estritas para evitar qualquer contaminação durante a inserção do catéter e a manipulação.
Devem ser monitorizados a glucosa sérica, os eletrólitos e a osmolaridade, bem como o balanço hídrico, o equilíbrio ácido-base e os testes de enzimas hepáticas.
Ante qualquer sinal ou sintoma de reação anafiláctica (como febre, tremores, erupção cutânea ou dispnéia) deve ser interrompida imediatamente a perfusão.
SmofKabiven central não deve ser administrado simultaneamente com sangue no mesmo equipamento de perfusão, devido ao risco de pseudoaglutinação.
Forma de administração
Via intravenosa, perfusão em uma veia central.
Para proporcionar uma nutrição parenteral completa, devem ser adicionados a SmofKabiven central: elementos traço, vitaminas e possivelmente eletrólitos (levando em conta os eletrólitos já presentes em SmofKabiven central), de acordo com as necessidades do paciente.
Posologia
Adultos
Dosagem: A faixa de doses de 13-31 ml SmofKabiven central/kg pc/dia aportará 0,6-1,6 g de aminoácidos/kg pc/dia (correspondentes a 0,10-0,25 g nitrogênio/kg pc/dia) e 14-35 kcal/kg pc/dia de energia total (12-27 kcal/kg pc/dia de energia não-proteica).
Velocidade de perfusão
A velocidade de perfusão máxima para glucosa é 0,25 g/kg pc/h, para os aminoácidos 0,1 g/kg pc/h, e para lípidos 0,15 g/kg pc/h.
A velocidade de perfusão não deve exceder 2,0 ml/kg pc/hora (correspondente a 0,25 g de glucosa, 0,10 g de aminoácidos e 0,08 g de lípidos/kg pc/h). O período de perfusão recomendado é de 14-24 horas.
Dose máxima diária: A dose máxima diária varia com a situação clínica do paciente e pode mesmo mudar de um dia para o outro. A dose diária máxima recomendada é de 35 ml/kg pc/dia.
População pediátrica
Crianças (2-11 anos)
Dosagem:
A dose de até 35 ml/kg pc/dia deve ser ajustada regularmente de acordo com os requisitos do paciente pediátrico que variam mais do que nos pacientes adultos.
Velocidade de perfusão:
A velocidade máxima de perfusão é de 2,4 ml/kg pc/h (correspondente a 0,12 g de aminoácidos /kg/h, 0,30 g/glucosa/kg/h e 0,09 g lípidos/kg/h). Na velocidade de perfusão máxima recomendada, não usar períodos de perfusão maiores de 14 horas e 30 minutos, exceto em casos excepcionais e sob estreita monitorização.
O período de perfusão recomendado é de 12-24 horas.
Dose máxima diária: A dose máxima diária varia com a condição clínica do paciente e pode mesmo mudar de dia a dia. A dose máxima diária é de 35 ml/kg pc/dia.
Adolescentes (12-16/18 anos)
SmofKabiven central pode ser usado em adolescentes da mesma forma que em adultos.
Precauções para a utilização
Não utilizar o envase se estiver deteriorado.
Utilizar apenas se as soluções de aminoácidos e glucosa são transparentes e incolores ou ligeiramente amarelas, e se a emulsão lipídica é branca e homogênea. Deve misturar o conteúdo das três câmaras separadas antes de utilizar, e antes de realizar qualquer adição através do porto de aditivos.
Depois da abertura das soldaduras tipo peel, a bolsa deve ser invertida várias vezes com o fim de garantir uma mistura homogênea, que não mostre evidência de uma separação de fases.
Para um único uso. Deve rejeitar qualquer mistura sobrante após a perfusão.
Compatibilidade
Existem dados de compatibilidade em quantidades definidas com os produtos de nome comercial Dipeptiven 200 mg/ml, Supliven, Glycophos 216 mg/ml, Vitalipid Adultos/Infantil e Soluvit liofilizado e genéricos de eletrólitos em concentrações definidas. Quando se realizem adições de eletrólitos, devem ser consideradas as quantidades já presentes na bolsa para satisfazer as necessidades clínicas do paciente. Os dados gerados apoiam as adições à bolsa ativada segundo a tabela resumo que se mostra a seguir.
Rango de compatibilidade estabelecido durante 8 dias, ou seja, 6 dias de armazenamento a 2-8ºC seguidos de 48 horas a 20-25ºC.
Unidades | Conteúdo total máximo | |||||
Tamanho da bolsa de SmofKabiven | ml | 493 | 986 | 1477 | 1970 | 2463 |
Aditivo | Volume | |||||
Dipeptiven | ml | 0-100 | 0 - 300 | 0 - 300 | 0 - 300 | 0 - 300 |
Supliven | ml | 0 - 10 | 0 - 10 | 0 - 10 | 0 - 10 | 0 - 10 |
Soluvit | vial | 0 - 1 | 0 - 1 | 0 - 1 | 0 - 1 | 0 - 1 |
Vitalipid Adultos/Infantil | ml | 0 - 10 | 0 - 10 | 0 - 10 | 0 - 10 | 0 - 10 |
Límites dos eletrólitos1 | Quantidade por bolsa | |||||
Sódio | mmol | ≤ 75 | ≤ 150 | ≤ 225 | ≤ 300 | ≤ 375 |
Potássio | mmol | ≤ 75 | ≤ 150 | ≤ 225 | ≤ 300 | ≤ 375 |
Cálcio | mmol | ≤ 2,5 | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
Magnésio | mmol | ≤ 2,5 | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
Fosfato orgânico (Glycophos)2 | mmol | ≤ 7,5 | ≤ 15 | ≤ 22,5 | ≤ 30 | ≤ 37,5 |
Zinco | mmol | ≤ 0,1 | ≤ 0,2 | ≤ 0,25 | ≤ 0,3 | ≤ 0,35 |
Selênio | µmol | ≤ 1 | ≤ 1 | ≤ 1 | ≤ 1 | ≤ 1,15 |
1inclui as quantidades de todos os produtos.
2As adições de Glycophos podem ser duplicadas com uma estabilidade de 7 dias, ou seja, 6 dias de armazenamento a 2-8ºC seguidos de 24 horas a 20-25ºC.
Nota: Esta tabela tem por objetivo indicar a compatibilidade. Não é uma guia de dosagem. No caso dos produtos com nome comercial, antes de prescrevê-los, consulte a ficha técnica aprovada.
Existem dados sobre a compatibilidade com outros aditivos e o tempo de conservação das diferentes misturas, disponíveis sob pedido.
As adições devem ser realizadas assépticamente.
Período de validade após a mistura das câmaras da bolsa
Tem-se demonstrado a estabilidade física e química da bolsa de três câmaras misturada durante 48 horas a 20-25°C. Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente. Se não for utilizado imediatamente, o tempo de conservação até seu uso e as condições prévias ao seu uso são responsabilidade do usuário e normalmente não devem ser superiores a 24 horas a 2-8 ?C, a menos que a mistura tenha sido realizada em condições assépticas controladas e validadas.
Período de validade após a mistura com aditivos
Tem-se demonstrado estabilidade físico-química em uso da bolsa mista de três câmaras com aditivos até 8 dias, ou seja, 6 dias a 2-8ºC seguidos de 48 horas a 20-25ºC, incluyendo a duração da administração. Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente após realizar as adições. Se não for utilizado imediatamente, o tempo de conservação até seu uso e as condições prévias ao seu uso são responsabilidade do usuário. O tempo de conservação normalmente não deve ser superior a 24 horas a 2-8 ?C, a menos que a mistura tenha sido realizada em condições assépticas e validadas.
Instruções para o uso de SmofKabiven central
A bolsa
493 ml 986 ml, 1477 ml, 1970 ml, 2463 ml
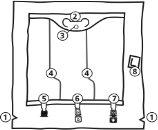
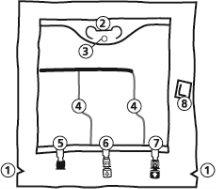
- Cortes na sobrebolsa
- Alça
- Orifício para pendurar a bolsa
- Selos rompíveis
- Porto cego (utilizado apenas durante a fabricação)
- Porto de adição
- Porto de perfusão
- Absorvente de oxigênio
- Abertura da sobrebolsa
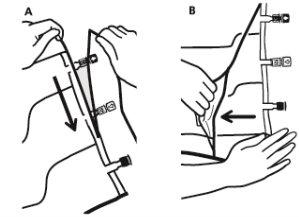
- Para extrair a sobrebolsa, segurá-la em posição horizontal e rasgar pela corte até os portos ao longo do bordo superior (A)
- Então, simplesmente rasgar ao longo do envase; separar a sobrebolsa e descartá-la junto com o absorvente de oxigênio (B).
- Mistura
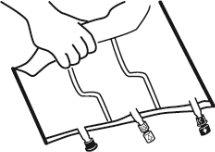
- Colocar a bolsa em uma superfície plana.
- Enrolar a bolsa desde a parte do pendurador até a parte dos portos, primeiro com a mão direita e a seguir aplicando uma pressão constante com a mão esquerda até que as soldaduras verticais se abram. As soldaduras peel verticais se abrem devido à pressão do líquido. As soldaduras peel também podem ser abertas antes de retirar a sobrebolsa.
Nota:os líquidos se misturam facilmente embora a soldadura horizontal permaneça fechada.
493 ml, 986 ml, 1477 ml, 1970 ml, 2463 ml
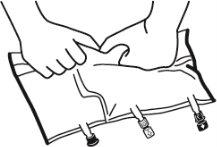
- Misturar os conteúdos das três câmaras invertendo a bolsa três vezes até que os componentes estejam completamente misturados.
- Finalização da preparação:
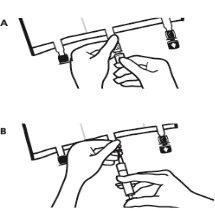
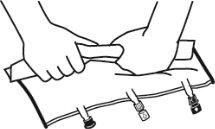
- Colocar a bolsa de novo sobre uma superfície plana. Pouco antes de injetar os aditivos, romper o porto de adição branco pela marca em forma de seta (A).
Nota:A membrana do porto de aditivos é estéril.
- Segurar a base do porto de aditivos. Inserir a agulha, injetar os aditivos (de compatibilidade conhecida) pelo centro do ponto de injeção (B).
- Misturar completamente entre cada adição, invertendo a bolsa três vezes. Utilizar seringas com agulhas de calibre 18-23 e uma longitude máxima de 40 mm.
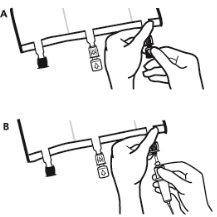
- Pouco antes de inserir o conjunto de perfusão, romper o porto de perfusão azul pela marca em forma de seta (A).
Nota:A membrana do porto de perfusão é estéril.
- Usar um equipamento de perfusão não ventilado ou fechar a entrada do ar do equipamento ventilado.
- Segurar a base do porto de perfusão.
- Introduzir o punção através do porto de perfusão. O punção deve estar totalmente inserido para assegurar sua retenção.
Nota:A parte interna do porto de perfusão é estéril.
- Pendurado da bolsa
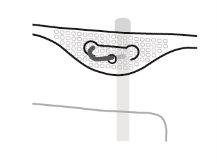
- Pendurar a bolsa pela argola que há sob o pendurador
.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 4,76 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 g / 3,5 g / 200 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: SOLUÇÃO INJETÁVEL PARA PERFUSÃO, 3,5 g / 200 g / 5,22 g / 1,88 g / 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 662 mg / 1,02 g / 4,76 g / 5,15 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 4,25 g / 300 g / 5,22 g / 1,54 g / 4,76 g / 1,53 g / 8,76 g / 4,08 g / 5,1 g / 6,2 g / 3,57 g / 3,4 g / 662 mg / 1,02 g / 5,78 g / 5,94 g / 6,16 g / 4,93 g / 17,6 g / 0,34 g / 9,78 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médica
Alternativas a SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO em Polónia
Alternativa a SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO em Ukraine
Médicos online para SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de SMOFKABIVEN CENTRAL EMULSÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.














