
NUMETA G16%E, EMULSÃO PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de NUMETA G16%E, EMULSÃO PARA PERFUSÃO

Como usar NUMETA G16%E, EMULSÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o utilizador
NUMETA G16%E emulsão para perfusão
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que o ler novamente.
- Se tiver alguma dúvida, consulte o médico, farmacêutico ou enfermeiro do seu filho.
- Se o seu filho experimentar efeitos adversos, consulte o médico, farmacêutico ou enfermeiro do seu filho, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Numeta G16%E e para que é utilizado
- O que precisa saber antes que Numeta G16%E seja administrado ao seu filho
- Como será administrado Numeta G16%E
- Possíveis efeitos adversos
- Conservação de Numeta G16%E
- Conteúdo do envase e informações adicionais
1. O que é Numeta G16%E e para que é utilizado
Numeta G16%E é uma nutrição especializada concebida para os bebés recém-nascidos a termo e até aos 2 anos. É administrado através de um tubo conectado à veia do seu filho, quando não é capaz de comer todos os alimentos pela boca
Numeta apresenta-se sob a forma de uma bolsa tricompartmental com três câmaras independentes que contêm:
uma solução de glicose a 50%
uma solução pediátrica de aminoácidos a 5,9% com eletrólitos
uma emulsão de lípidos (gorduras) a 12,5%
Consoante as necessidades do seu filho, duas (ou três) dessas soluções são misturadas na bolsa antes de ser administrada ao seu filho.
Numeta G16%E só deve ser utilizado sob supervisão médica.
2. O que precisa saber antes que Numeta G16%E seja administrado ao seu filho
Não useNumetaG16%E nos seguintes casos:
Com 2 soluções misturadas na bolsa (“2 em1”):
- Se o seu filho é alérgico a qualquer uma das proteínas do ovo, da soja ou dos amendoins ou aos ingredientes da bolsa de glicose ou de aminoácidos (incluídos na secção 6).
- Se o organismo do seu filho tem problemas utilizando os constituintes das proteínas.
- Se o seu filho tem no sangue concentrações altas de qualquer um dos eletrólitos incluídos em Numeta G16%E.
- Se o seu filho é um recém-nascido (≤ 28 dias de idade) Numeta G16%E (ou outras soluções que contêm cálcio) não deve ser administrado ceftriaxona (um antibiótico) ao mesmo tempo, mesmo que se usem linhas para a perfusão por separado. Há um risco de formação de partículas no sangue do recém-nascido que pode ser mortal)
- Se o seu filho tem hiperglicemia (níveis especialmente altos de açúcar no sangue).
Com 3 soluções misturadas na bolsa (“3 em1”).
- Todas as situações mencionadas em “2 em 1” mais a seguinte:
- Se o seu filho tem um nível particularmente elevado de gorduras no sangue.
Em todos os casos, o médico do seu filho decidirá se deve ser administrado este medicamento ao seu filho com base em factores como a idade, peso e estado clínico, juntamente com os resultados de todas as provas realizadas.
Advertências e precauções
Consulte o médico ou enfermeiro do seu filho antes de que lhe administrem Numeta G16%E.
Quando se utilizar em recém-nascidos e crianças menores de 2 anos, a emulsão (nas bolsas e equipamentos de administração) deve ser protegida da exposição à luz até que termine a administração. A exposição de Numeta G16%E à luz ambiente, especialmente após a mistura com oligoelementos ou vitaminas, gera peróxidos e outros produtos de degradação que podem ser reduzidos se o produto for protegido da exposição à luz.
Reacções alérgicas
A perfusão deve ser interrompida imediatamente se aparecer qualquer sinal ou sintoma de reacção alérgica (como febre, suor, calafrios, cefaleia, erupções cutâneas ou dificuldade respiratória). Este medicamento contém óleo de soja, que raramente pode produzir reacções de hipersensibilidade. Em casos raros, observou-se que algumas pessoas que são alérgicas às proteínas do amendoim também o são às proteínas da semente de soja.
Numeta G16%E contém glicose procedente de amido de milho, por isso deve ser utilizado com precaução em pacientes com alergia conhecida ao milho ou aos seus produtos.
Risco de formação de partículas com a ceftriaxona (antibiótico):
Não se deve misturar nem administrar um antibiótico específico chamado ceftriaxona ao mesmo tempo que uma solução que contenha cálcio (incluindo Numeta G16%E) através de um gotejamento na veia do seu filho.
O médico do seu filho está ciente disso e não os administrará conjuntamente, nem mesmo através de linhas de perfusão separadas.
No entanto, o médico do seu filho pode administrar cálcio e ceftriaxona sequencialmente um após o outro se forem utilizadas linhas de infusão em diferentes pontos, ou se as linhas de infusão forem substituídas ou se forem bem lavadas com solução salina fisiológica para evitar a formação de precipitados.
Formação de pequenas partículas nos vasos sanguíneos dos pulmões:
A dificuldade respiratória também pode ser um sinal da formação de pequenas partículas, que obstruem os vasos sanguíneos dos pulmões (precipitados vasculares pulmonares). Se o seu filho notar dificuldade respiratória, informe o médico ou enfermeiro do seu filho. Eles decidirão as medidas que devem ser tomadas.
Infecção e sepsis
O médico do seu filho observará atentamente o seu filho para detectar qualquer sintoma de infecção. A aplicação de uma “técnica asséptica” (técnica sem germes) ao colocar e manter o catéter, bem como ao preparar a fórmula de nutrição, pode reduzir o risco de infecção.
Por vezes, as crianças podem desenvolver infecções e sepsis (bactérias no sangue) quando têm um tubo conectado à veia (catéter intravenoso). Certos medicamentos e doenças podem aumentar o risco de desenvolver sepsis ou infecção. Os pacientes que necessitam de nutrição parenteral (nutrição administrada através de um tubo conectado à veia do seu filho) têm mais probabilidade de desenvolver uma infecção devido ao seu estado clínico.
Síndroma de sobrecarga de gordura
Foram descritos casos de síndroma de sobrecarga de gordura com produtos semelhantes. Uma redução da capacidade de eliminação dos lípidos que contém Numeta G16%E, ou uma sobredosagem, pode causar um "síndroma de sobrecarga de gordura" (ver secções 3 e 4 Posíveis efeitos adversos).
Mudança nos níveis de substâncias químicas do sangue
O médico do seu filho verificará e reverá os líquidos no organismo, os níveis de substâncias químicas no sangue e outros níveis no sangue do seu filho, pois por vezes, a realimentação a alguém que está gravemente desnutrido pode dar origem a mudanças nos níveis de química sanguínea. Também pode ocorrer um excesso de fluido nos tecidos e inchaço. É recomendável iniciar a nutrição parenteral lentamente e sob supervisão.
Níveis elevados de magnésio no sangue
A quantidade de magnésio presente em Numeta G16%E pode dar origem a níveis elevados de magnésio no sangue. Entre os sinais destes níveis elevados incluem-se debilidade, lentidão de reflexos, náuseas, vómitos, níveis baixos de cálcio no sangue, dificuldades de respiração, pressão arterial baixa e batimentos irregulares do coração. Dado que é possível que seja difícil detectar estes sinais, o médico pode controlar os valores no sangue do seu filho, especialmente se o seu filho tiver factores de risco relacionados com níveis elevados de magnésio no sangue, o que inclui uma função renal alterada. Se os níveis de magnésio no sangue forem elevados, a perfusão será interrompida ou reduzida.
Supervisão e ajuste
O médico do seu filho supervisionará e adaptará a dose de Numeta G16%E para que se ajuste às necessidades individuais do seu filho se apresentar os seguintes estados:
- estado pós-traumático grave
- diabetes mellitus grave
- choque
- infarto
- infecção grave
- certos tipos de coma
Uso com precaução:
Numeta G16%E deve ser utilizado com precaução se o seu filho tiver:
- edema pulmonar (líquido nos pulmões) ou insuficiência cardíaca,
- problemas hepáticos graves,
- problemas para assimilar nutrientes,
- níveis altos de açúcar,
- problemas renais,
- alterações metabólicas graves (quando o organismo não consegue eliminar as substâncias de forma normal),
- alterações da coagulação do sangue.
Os níveis de líquidos no organismo do seu filho, os valores da análise do fígado e/ou os valores do sangue serão cuidadosamente controlados.
Uso de Numeta G16%E com outros medicamentos
Informa o médico do seu filho se o seu filho está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Numeta G16%Enão deve ser administrado ao mesmo tempo que:
- ceftriaxona(um antibiótico) nem mesmo em vias de perfusão separadas, devido ao risco de formação de partículas.
- sangueatravés da mesma via de perfusão. Devido ao risco de pseudoaglutinação (os glóbulos vermelhos ficam empilhados)
- ampicilina,fosfenitoina e furosemidaatravés da mesma via de perfusão,pois existe o risco de formação de partículas.
Cumarina e warfarina (anticoagulantes)
O médico do seu filho observará atentamente o seu filho se este estiver a tomar cumarina ou warfarina. O óleo de oliva e de soja contêm vitamina K1. A vitamina K1 pode interferir com a ação de medicamentos como a cumarina e a warfarina. Estes medicamentos são anticoagulantes que são utilizados para evitar a coagulação do sangue.
Provas de laboratório
Os lípidos incluídos nesta emulsão podem interferir com os resultados de certas provas de laboratório. As provas de laboratório podem ser realizadas após um período de 5 a 6 horas se não forem administrados mais lípidos.
Interacção de Numeta G16%Ecom medicamentos que podem afetar os níveis/metabolismo do potássio:
Numeta G16%E contém potássio. Os níveis altos de potássio no sangue podem causar um ritmo cardíaco anormal. Deve prestar-se especial atenção aos pacientes que tomam diuréticos (medicamentos que reduzem a retenção de fluidos), inibidores da ECA ou antagonistas do receptor II da angiotensina (todos eles medicamentos utilizados para o tratamento da pressão arterial elevada) ou com imunossupressores (medicamentos que podem diminuir as defesas naturais do organismo). Este tipo de medicamentos pode aumentar os níveis de potássio.
3. Como será administrado Numeta G16%E
Seu filho sempre deve receber Numeta G16%E exatamente como o médico indicou. Consulte o médico se tiver dúvidas.
Intervalo de idade
Numeta G16%E foi concebido para atender às necessidades nutricionais de crianças nascidas a termo e crianças até dois anos.
O médico decidirá se este medicamento é adequado para o seu filho.
Administração
Este medicamento é uma emulsão para perfusão. É administrado através de um tubo de plástico conectado a uma veia do braço ou a uma veia grande do peito do seu filho.
O médico do seu filho pode optar por não administrar lípidos ao seu filho. O design da bolsa de Numeta G16%E permite quebrar apenas o selo não permanente do compartimento entre as câmaras dos aminoácidos/eletrólitos e glicose, se necessário. O selo entre as câmaras de aminoácidos e lípidos é mantido intacto neste caso. O conteúdo da bolsa pode ser perfundido sem lípidos.
Quando se utilizar em recém-nascidos e crianças menores de 2 anos, a emulsão (nas bolsas e equipamentos de administração) deve ser protegida da exposição à luz até que termine a administração (ver secção 2).
Dosagem e duração do tratamento
O médico do seu filho decidirá a dose que o seu filho precisará e por quanto tempo será administrado. A dose depende das necessidades nutricionais do seu filho e será baseada no peso, estado médico e capacidade do corpo do seu filho para digerir e absorver os ingredientes de Numeta G16%E. Também podem ser administradas proteínas ou nutrição adicionais de forma oral ou intestinal.
Se ao seu filho forem administrados maisNumetaG16%Edo que o necessário
Em caso de sobredosagem ou ingestão acidental, consulte o Serviço de Informação Toxicológica. Telefone 915.620.420
Sintomas
Receber demasiado medicamento ou fazê-lo muito rapidamente pode provocar:
- náuseas (sentir-se indisposto)
- vómitos
- calafrios
- alterações electrolíticas (quantidades inapropriadas de eletrólitos no sangue)
- sinais de hipervolemia (aumento do volume de circulação sanguínea)
- acidose (aumento da acidez do sangue)
Nestes casos, a perfusão deve ser interrompida imediatamente. O médico do seu filho decidirá se é necessário realizar outras ações.
Uma sobredosagem das gorduras contidas em Numeta G16%E pode provocar um "síndroma de sobrecarga de gordura", que geralmente é reversível uma vez interrompida a infusão. Em recém-nascidos (neonatos) e crianças pequenas (bebês), o síndroma de sobrecarga de gordura está associado a distúrbios respiratórios que provocam uma redução do oxigénio no corpo (dificuldade respiratória) e afecções que provocam um aumento da acidez do sangue (acidose).
Para evitar que se produzam estas reacções, o médico do seu filho supervisionará regularmente o estado do seu filho e analisará os níveis sanguíneos durante o tratamento.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as crianças os sofram.
Se observar algum cambio na forma como se sente o seu filho durante o tratamento ou após ele, comunique-o imediatamente ao médico ou enfermeiro.
As provas que o médico realizará ao seu filho enquanto recebe este medicamento devem minimizar o risco de efeitos adversos.
Se se apresentarem sintomas de uma reacção alérgica, a perfusão deve ser interrompida e contactará-se o médico imediatamente. Isto pode ser grave e os sintomas podem incluir:
- Sudor
- Calafrios
- Dor de cabeça
- Erupções cutâneas
- Dificuldade para respirar
Outros efeitos adversos que se têm observado são:
Frequentes: podem afetar até 1 de cada 10 pessoas
- Baixo nível de fosfato no sangue (hipofosfatemia)
- Alto nível de açúcar no sangue (hiperglicemia)
- Alto nível de cálcio no sangue (hipercalcemia)
- Alto nível de triglicéridos no sangue (hipertrigliceridemia)
- Alterações electrolíticas (hiponatremia)
Pouco frequentes: podem afetar até 1 de cada 100 pessoas
- Alto nível de lípidos no sangue (hiperlipidemia)
- Um distúrbio em que a bile não pode fluir desde o fígado até ao duodeno (colestase). O duodeno é parte do intestino
Desconhecidos: a frequência não pode ser estimada a partir dos dados disponíveis (estes efeitos adversos foram comunicados com Numeta G13%E e G16%E quando foram administrados por via periférica com uma diluição insuficiente)
- Necrose da pele
- Dano em tecido mole
- Extravasação
Foram notificados os seguintes efeitos adversos com outros produtos para nutrição parenteral:
- A capacidade reduzida ou limitada para eliminar os lípidos que contém Numeta pode dar origem a um “síndroma de sobrecarga de gordura”. Os seguintes sinais e sintomas deste síndroma geralmente são reversíveis quando se detém a perfusão da emulsão de lípidos:
- Piora súbita e brusca do estado médico do paciente
- Alto nível de gordura no sangue (hiperlipidemia)
- Febre
- Infiltração gordurosa do fígado (hepatomegalia)
- Piora da função hepática
- Diminuição dos glóbulos vermelhos, o que pode fazer empalidecer a pele e produzir fraqueza ou dificuldade para respirar (anemia)
- Baixo recuento de glóbulos brancos, o que pode aumentar o risco de infecção (leucocitopenia)
- Baixo recuento de plaquetas, o que pode aumentar o risco de hematomas e/ou hemorragias (trombocitopenia)
- Distúrbios da coagulação, o que afeta a capacidade do sangue para coagular
- Distúrbio respiratório que produz uma redução do oxigénio no corpo (dificuldade respiratória)
- Condições que provocam um aumento da acidez do sangue (acidose)
- Estado de coma que requer hospitalização
- Formação de pequenas partículas que podem provocar a obstrução dos vasos sanguíneos dos pulmões (precipitados vasculares pulmonares) ou dificuldade para respirar
Comunicação de efeitos adversos:
Se o seu filho experimentar qualquer tipo de efeito adverso, consulte o médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Numeta G16%E
Mantenha este medicamento fora da vista e do alcance das crianças quando não estiver a ser administrado.
Quando se utilizar em recém-nascidos e crianças menores de 2 anos, a emulsão (nas bolsas e equipamentos de administração) deve ser protegida da exposição à luz até que termine a administração (ver secção 2).
Não utilize este medicamento após a data de validade que aparece na bolsa e no embalagem exterior (MM/AAAA). A data de validade é o último dia do mês que se indica.
Não congele.
Conservar na sobrebolsa.
Os medicamentos não devem ser jogados fora pelos esgotos nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Aspecto do produto e conteúdo do envase
Numeta G16%E apresenta-se em forma de bolsa com três câmaras. Cada bolsa contém uma combinação estéril de uma solução de glicose, uma solução pediátrica de aminoácidos com eletrólitos e uma emulsão de lípidos, tal como se descreve a seguir:
Tamanho do envase | Solução deglicose a 50% | Solução de aminoácidos a 5,9% com eletrólitos | Emulsão delípidos a 12,5% |
500 ml | 155 ml | 221 ml | 124 ml |
Aspecto antes da reconstituição:
- As soluções das câmaras de aminoácidos e glicose são transparentes, incolores ou ligeiramente amareladas.
- A câmara da emulsão de lípidos tem um aspecto leitoso e esbranquiçado.
Aspecto após a reconstituição:
- A solução “2 em 1” é transparente, incolor ou ligeiramente amarelada.
- A emulsão para perfusão “3 em 1” tem um aspecto uniforme leitoso e esbranquiçado.
A bolsa com três compartimentos é uma bolsa de plástico multicamada.
Para evitar o contato com o ar, Numeta está envasada no interior de uma sobrebolsa de barreira de oxigênio que contém um sachê com um absorbente de oxigênio e um indicador de oxigênio.
Tamanhos de envase
Bolsa de 500 ml: 6 unidades por caixa
1 bolsa de 500 ml
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Baxter, S.L.
Pouet de Camilo 2, 46394 Ribarroja del Turia (Valência)
Responsável pela fabricação
Baxter S.A.
Boulevard Rene Branquart, 80
7860 Lessines
Bélgica
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Áustria Alemanha | Numeta G16 % E Emulsão para infusão |
Bélgica Luxemburgo | Numetzah G16%E, emulsão para perfusão |
França | Numetah G16 %E emulsão para perfusão |
Dinamarca Noruega Suécia | Numeta G16E |
República Checa Grécia | Numeta G16 % E |
Holanda | Numeta G16%E emulsão para infusão |
Irlanda Reino Unido | Numeta G16%E, Emulsão para infusão |
Itália | Numeta G16%E emulsão para infusão |
Finlândia | Numeta G16E infusão, emulsão |
Polônia | Numeta G16 % E |
Portugal | Numeta G16%E |
Espanha | Numeta G16%E, emulsão para perfusão |
Data da última revisão deste prospecto: Maio 2024
A informação detalhada e atualizada deste medicamento está disponível na página web da Agência Espanhola do Medicamento e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
---------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do setor sanitário:*
(*) Tenha em conta que, em certos casos, estes medicamentos podem ser administrados em casa pelos pais ou outros cuidadores. Nesses casos, os pais/cuidadores devem ler a seguinte informação.
Não deve ser adicionado nenhum medicamento à bolsa sem verificar primeiro a compatibilidade. Podem formar-se partículas ou decompor-se a emulsão de lípidos, o que pode bloquear os vasos sanguíneos.
Numeta G16%E deve estar à temperatura ambiente antes do seu uso.
Antes de administrar Numeta G16%E, deve preparar a bolsa como se mostra a seguir.
Certifique-se de que a bolsa não esteja danificada e utilize-a apenas se não apresentar danos. Uma bolsa não danificada tem este aspecto:
- Os selos não permanentes estão intactos. Isso é observado porque não existe uma mistura das três câmaras.
- A solução de aminoácidos e de glicose é transparente, incolor ou ligeiramente amarelada e sem partículas visíveis.
- A emulsão de lípidos é um líquido de aspecto leitoso e esbranquiçado.
Antes de abrir a sobrebolsa, examine a cor do absorbente de oxigênio.
- Compare-o com a cor de referência impressa junto ao símbolo de OK e mostrada na área impressa da etiqueta do indicador.
- Não utilize o produto se a cor do absorbente de oxigênio não corresponder à cor de referência impressa junto ao símbolo OK.
As figuras 1 e 2 ilustram como remover a sobrebolsa. Descarte-a juntamente com o indicador de oxigênio e o absorbente de oxigênio.
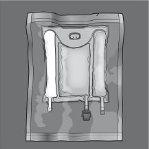
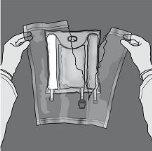
Figura 1 Figura 2
Preparação da mistura
- Certifique-se de que o produto esteja à temperatura ambiente antes de romper os selos não permanentes.
- Coloque a bolsa em uma superfície limpa e plana.
Ativação da bolsa de 3 câmaras (ruptura dos dois selos não permanentes)
Paso 1: Enrole a bolsa desde o lado do suporte em D
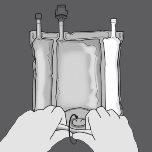
Paso 2: Pressione até que se abram os selos não permanentes.
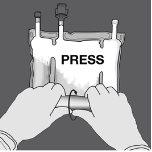
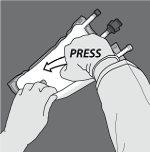
Paso 3: Mude o sentido e enrole a bolsa em direção ao suporte em D até que o selo esteja completamente aberto. Siga os mesmos passos para abrir o segundo selo não permanente.
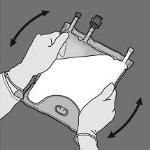
Paso 4: Dê a volta à bolsa pelo menos três vezes para misturar bem o conteúdo. O aspecto da solução misturada deve ser uma emulsão de cor branca leitosa.
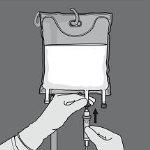
Paso 5: Retire o plugue protetor do ponto de administração e insira o equipamento de administração intravenosa.
Ativação da bolsa de 2 câmaras (ruptura do selo não permanente situado entre as câmaras de aminoácidos e glicose)
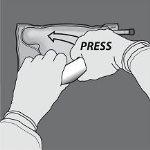
Paso 1: Para romper apenas o selo não permanente de aminoácidos/glicose, comece a enrolar a bolsa desde a esquina do suporte em D do selo que separa as câmaras de aminoácidos e glicose e pressione para abrir o selo que separa ambos os compartimentos.

Paso 2: Coloque a bolsa de forma que o compartimento com emulsão de lípidos esteja mirando em direção ao operador e enrole a bolsa enquanto protege o compartimento com emulsão de lípidos nas palmas das mãos.
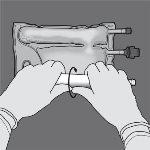
Paso 3: Com uma mão, aplique pressão enrolando a bolsa em direção aos tubos.
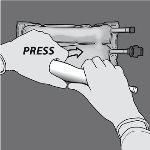
Paso 4: Em seguida, mude o sentido e enrole a bolsa em direção ao suporte em D, pressionando com a outra mão até que o selo que separa as soluções de aminoácidos e glicose se abra completamente.
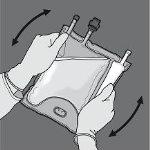
Paso 5: Dê a volta à bolsa pelo menos três vezes para misturar bem o conteúdo. O aspecto da solução misturada deve ser transparente, incolor ou ligeiramente amarelado.
Paso 6: Retire o plugue protetor do ponto de administração e insira o equipamento de administração intravenosa.
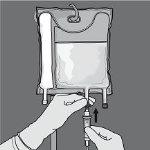
A velocidade de administração deve ser aumentada gradualmente durante a primeira hora e ajustada em função dos seguintes fatores:
A dose que será administrada
A ingestão do volume diário
A duração da perfusão.
Forma de administração
Quando for utilizado em recém-nascidos e crianças menores de 2 anos, a emulsão (na bolsa e no equipamento de administração) deve ser protegida da exposição à luz até que termine a administração.
Recomenda-se o uso de um filtro de 1,2 micras para a administração de Numeta G16%E.
Devido à sua alta osmolaridade, Numeta G16%E só pode ser administrada sem diluir através de uma veia central; no entanto, uma diluição apropriada de Numeta G16%E com água para preparações injetáveis reduz a osmolaridade e permite a perfusão periférica.
A seguinte fórmula indica o impacto da diluição sobre a osmolaridade das bolsas.
Osmolaridade final | = | Volume da bolsa x osmolaridade inicial |
Água adicionada + Volume da bolsa |
A seguinte tabela mostra exemplos de osmolaridade para as adições das bolsas de 2 e 3 câmaras ativadas após a adição de água para preparações injetáveis:
Aminoácidos e glicose(B2C ativada) | Aminoácidos, glicose elípidos (B3C ativada) | |
Volume inicial na bolsa (ml) | 376 | 500 |
Osmolaridade inicial (mOsm/l aprox) | 1585 | 1230 |
Volume de água adicionada (ml) | 376 | 500 |
Volume final após adição (ml) | 752 | 1000 |
Osmolaridade após adição (mOsm/l aprox) | 792,5 | 615 |
Adição de medicação
As misturas que incluem oligoelementos e vitaminas devem ser protegidas da luz, desde o ponto de administração e durante a administração. A exposição à luz ambiente gera peróxidos e outros produtos de degradação, os quais podem ser reduzidos com fotoproteção
Podem ser adicionados medicamentos compatíveis na mistura reconstituída (após abrir os selos não permanentes e misturar o conteúdo das duas ou três câmaras) através do ponto de injeção.
Também podem ser adicionadas vitaminas à câmara de glicose antes de reconstituir a mistura (antes de abrir os selos não permanentes e misturar as soluções e a emulsão).
Nas Tabelas 1-6 são mostradas as possíveis adições de soluções de oligoelementos disponíveis comercialmente (identificadas como TE1, TE2 e TE4), vitaminas (identificadas como liofilizado V1 e emulsão V2) e eletrólitos em quantidades definidas.
1 Compatibilidade com TE4, V1 e V2
Tabela 1: Compatibilidade de 3-em-1 (B3C ativada) com ou sem diluição em água
Por 500 ml (mistura 3 em 1 com lípidos) | ||||||
Mistura sem diluir | Mistura diluída | |||||
Aditivos | Nível incluído | Adição máxima | Nível máximo total | Nível incluído | Adição máxima | Nível máximo total |
Sódio (mmol) | 12,0 | 25,6 | 37,6 | 12,0 | 25,6 | 37,6 |
Potássio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
Magnésio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
Cálcio (mmol) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
Fosfato* (mmol) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
Oligoelementos e vitaminas | - | 10 ml TE4 +1 vial V1 +30 ml V2 | 10 ml TE4 +1 vial V1 +30 ml V2 | - | 5 ml TE4+ ½ vial V1 +5 ml V2 | 5 ml TE4+ ½ vial V1 +5 ml V2 |
Água para preparações injetáveis | - | - | - | - | 350 ml | 350 ml |
- Fosfato orgânico
Tabela 2: Compatibilidade de 2-em-1 (B2C ativada) com ou sem diluição em água
Por 376 ml (mistura 2 em 1 sem lípidos)) | ||||||
Mistura sem diluir | Mistura diluída | |||||
Aditivos | Nível incluído | Adição máxima | Nível máximo total | Nível incluído | Adição máxima | Nível máximo total |
Sódio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
Potássio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
Magnésio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
Cálcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
Fosfato* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
Oligoelementos e vitaminas | - | 5ml TE4+ ½ vial V1 | 5ml TE4+ ½ vial V1 | - | 5ml TE4+ ½ vial V1 | 5ml TE4+ ½ vial V1 |
Água para preparações injetáveis | - | - | - | - | 450 ml | 450 ml |
- Fosfato orgânico
2 Compatibilidade com TE1, V1 e V2
Tabela 3: Compatibilidade de 3-em-1 (B3C ativada) com ou sem diluição em água
Por 500 ml (mistura 3 em 1 com lípidos) | ||||||
Mistura sem diluir | Mistura diluída | |||||
Aditivos | Nível incluído | Adição máxima | Nível máximo total | Nível incluído | Adição máxima | Nível máximo total |
Sódio (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
Potássio (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
Magnésio (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
Cálcio (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
Fosfato* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
Oligoelementos e vitaminas | - | 5 ml TE1 +½ vial V1 + 5 ml V2 | 5 ml TE1 +½ vial V1 + 5 ml V2 | - | 5 ml TE1 +½ vial V1 + 5 ml V2 | 5 ml TE1 +½ vial V1 + 5 ml V2 |
Água para preparações injetáveis | - | - | - | - | 350 ml | 350 ml |
- Fosfato orgânico
Tabela 4: Compatibilidade de 2-em-1 (B2C ativada) com ou sem diluição em água
Por 376 ml (mistura 2 em 1 sem lípidos)) | ||||||
Mistura sem diluir | Mistura diluída | |||||
Aditivos | Nível incluído | Adição máxima | Nível máximo total | Nível incluído | Adição máxima | Nível máximo total |
Sódio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
Potássio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
Magnésio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
Cálcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
Fosfato* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
Oligoelementos e vitaminas | - | 5 ml TE1+ ½ vial V1 | 5 ml TE1+ ½ vial V1 | - | 5 ml TE1+ ½ vial V1 | 5 ml TE1+ ½ vial V1 |
Água para preparações injetáveis | - | - | - | - | 450 ml | 450 ml |
- Fosfato orgânico
3 Compatibilidade com TE2, V1 e V2
Tabela 5: Compatibilidade de 3-em-1 (B3C ativada) com ou sem diluição em água
Por 500 ml (mistura 3 em 1 com lípidos) | ||||||
Mistura sem diluir | Mistura diluída | |||||
Aditivos | Nível incluído | Adição máxima | Nível máximo total | Nível incluído | Adição máxima | Nível máximo total |
Sódio (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
Potássio (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
Magnésio (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
Cálcio (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
Fosfato* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
Oligoelementos e vitaminas | - | 5 ml TE1 +½ vial V1 + 5 ml V2 | 5 ml TE1 +½ vial V1 + 5 ml V2 | - | 5 ml TE1 +½ vial V1 + 5 ml V2 | 5 ml TE1 +½ vial V1 + 5 ml V2 |
Água para preparações injetáveis | - | - | - | - | 350 ml | 350 ml |
- Fosfato orgânico
Composição de Numeta G16%E
Os princípios ativos são:
Composição | 500 ml | |
Princípio ativo | B2C ativada (376 ml) | B3C ativada (500 ml) |
Compartimento de aminoácidos | ||
Princípio ativo | ||
Alanina | 1,03 g | 1,03 g |
Arginina | 1,08 g | 1,08 g |
Ácido aspártico | 0,77 g | 0,77 g |
Cisteína | 0,24 g | 0,24 g |
Ácido glutâmico | 1,29 g | 1,29 g |
Glicina | 0,51 g | 0,51 g |
Histidina | 0,49 g | 0,49 g |
Isoluecina | 0,86 g | 0,86 g |
Leucina | 1,29 g | 1,29 g |
Lisina monohidratada (equivalente a Lisina) | 1,59 g (1,42 g) | 1,59 g (1,42 g) |
Metionina | 0,31 g | 0,31 g |
Ornitina HCl (equivalente a Ornitina) | 0,41 g (0,32 g) | 0,41 g (0,32 g) |
Fenilalanina | 0,54 g | 0,54 g |
Prolina | 0,39 g | 0,39 g |
Serina | 0,51 g | 0,51 g |
Taurina | 0,08 g | 0,08 g |
Treonina | 0,48 g | 0,48 g |
Triptófano | 0,26 g | 0,26 g |
Tirosina | 0,10 g | 0,10 g |
Valina | 0,98 g | 0,98 g |
Cloruro de sódio | 0,30 g | 0,30 g |
Acetato de potássio | 1,12 g | 1,12 g |
Cloruro de cálcio dihidratado | 0,46 g | 0,46 g |
Acetato magnésico tetrahidratado | 0,33 g | 0,33 g |
Glicerofosfato de sódio hidratado | 0,98 g | 0,98 g |
Compartimento de glicose | ||
Glicose monohidratada (equivalente a glicose anidra) (equivalente a glicose anidra) | 85,25 g (77,50 g) | 85,25 g (77,50 g) |
Compartimento de lípidos | ||
Óleo de soja refinado (aprox. 80%) + óleo de oliva refinado (aprox. 20%) | - | 15,5 g |
A solução/emulsão reconstituída proporciona o seguinte:
Composição | |||||
B2C ativada | B3C ativada | 100 | 500 | 100 | |
Por unidade de volume (ml) | 376 | 100 | 500 | 100 | |
Nitrogênio (g) | 2,0 | 0,52 | 2,0 | 0,39 | |
Aminoácidos (g) | 13,0 | 3,5 | 13,0 | 2,6 | |
Glicose (g) | 77,5 | 20,6 | 77,5 | 15,5 | |
Lípidos (g) | 0 | 0 | 15,5 | 3,1 | |
Energia | |||||
Calorias totais (kcal) | 362 | 96 | 517 | 103 | |
Calorias não proteicas (kcal) | 310 | 82 | 465 | 93 | |
Calorias de glicose (kcal) | 310 | 82 | 310 | 62 | |
Calorias de lípidos (kcal) | 0 | 0 | 155 | 31 | |
Calorias não proteicas / nitrogênio (kcal/g N) | 158 | 158 | 237 | 237 | |
Calorias de lípidos (% calorias não proteicas) | NA | N/A | 33 | 33 | |
Calorias de lípidos (% calorias totais) | NA | N/A | 30 | 30 | |
Eletrólitos | |||||
Sódio (mmol) | 11,6 | 3,1 | 12,0 | 2,4 | |
Potássio (mmol) | 11,4 | 3,0 | 11,4 | 2,3 | |
Magnésio (mmol) | 1,6 | 0,41 | 1,6 | 0,31 | |
Cálcio (mmol) | 3,1 | 0,82 | 3,1 | 0,62 | |
Fosfato (mmol) | 3,2 | 0,85 | 4,4 | 0,87 | |
Acetato (mmol) | 14,5 | 3,9 | 14,5 | 2,9 | |
Malato (mmol) | 4,3 | 1,1 | 4,3 | 0,86 | |
Cloruro (mmol) | 13,8 | 3,7 | 13,8 | 2,8 | |
pH (aprox.) | 5,5 | 5,5 | 5,5 | 5,5 | |
Osmolaridade aprox. (mOsm/L) | 1585 | 1585 | 1230 | 1230 |
(a) Inclui calorias de fosfolípidos de ovo para perfusão.
(b) Inclui o fosfato proporcionado pelos fosfolípidos de ovo para perfusão.
Os demais componentes são:
Ácido L-Málico |
Ácido clorídrico |
Fosfolípidos de ovo para perfusão |
Glicerol |
Oleato de sódio |
Hidróxido de sódio |
Água para preparações injetáveis |
para o ajuste do pH
Baxter e Numeta são marcas registradas de Baxter International Inc.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a NUMETA G16%E, EMULSÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 4,76 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 g / 3,5 g / 200 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: SOLUÇÃO INJETÁVEL PARA PERFUSÃO, 3,5 g / 200 g / 5,22 g / 1,88 g / 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 662 mg / 1,02 g / 4,76 g / 5,15 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 4,25 g / 300 g / 5,22 g / 1,54 g / 4,76 g / 1,53 g / 8,76 g / 4,08 g / 5,1 g / 6,2 g / 3,57 g / 3,4 g / 662 mg / 1,02 g / 5,78 g / 5,94 g / 6,16 g / 4,93 g / 17,6 g / 0,34 g / 9,78 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médica
Alternativas a NUMETA G16%E, EMULSÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a NUMETA G16%E, EMULSÃO PARA PERFUSÃO em Poland
Alternativa a NUMETA G16%E, EMULSÃO PARA PERFUSÃO em Ukraine
Médicos online para NUMETA G16%E, EMULSÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de NUMETA G16%E, EMULSÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.














