
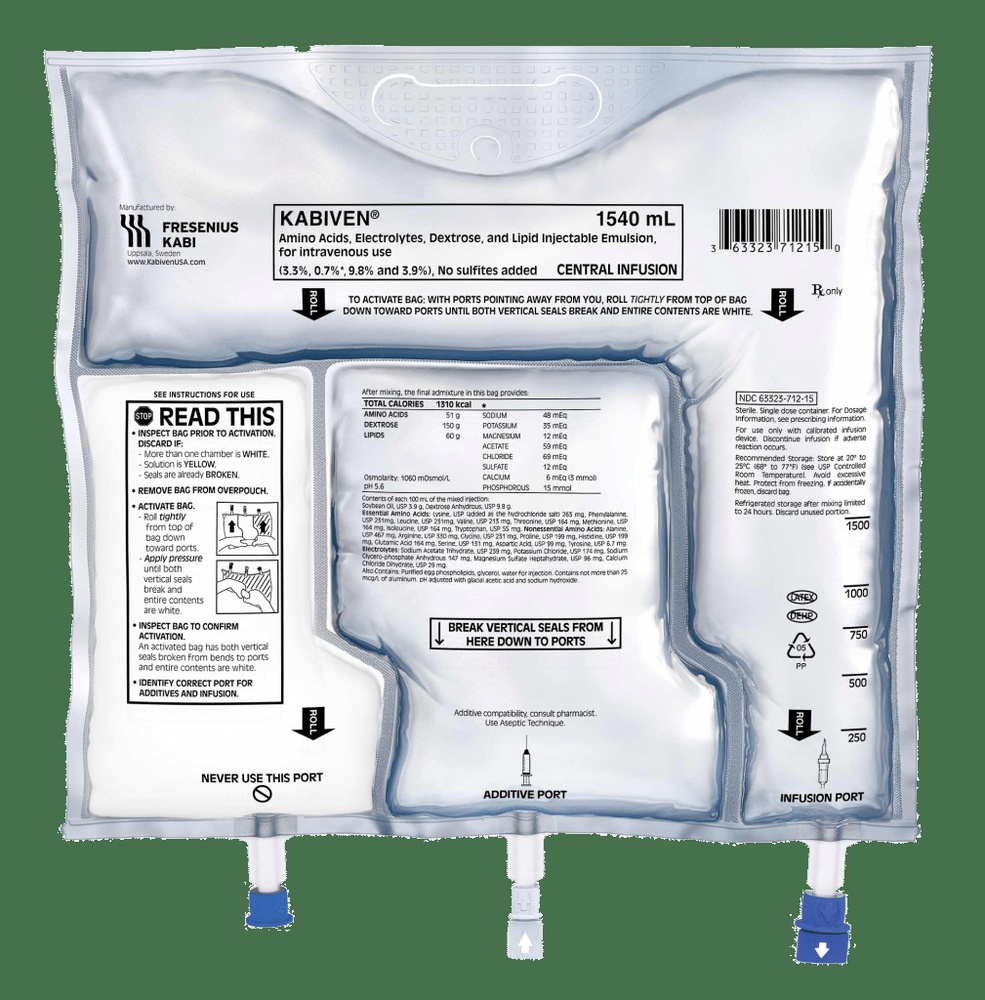
KABIVEN EMULSÃO PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de KABIVEN EMULSÃO PARA PERFUSÃO

Como usar KABIVEN EMULSÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o paciente
Kabiven emulsão para perfusão
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informações importantes para si:
- Conservar este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4
Conteúdo do prospecto:
- O que é Kabiven e para que é utilizado
- O que precisa saber antes de começar a usar Kabiven
- Como usar Kabiven
- Efeitos adversos possíveis
- Conservação de Kabiven
- Conteúdo do envase e informação adicional
-
1. O que é Kabiven e para que é utilizado
Kabiven apresenta-se em uma bolsa de três câmaras com sobrebolsa. Kabiven contém os seguintes medicamentos: aminoácidos (componentes utilizados para construir proteínas), lípidos, glicose e eletrólitos. Fornece energia (na forma de açúcar e lípidos) e aminoácidos ao seu fluxo sanguíneo quando não pode alimentar-se normalmente.
É utilizado como parte de uma dieta intravenosa equilibrada, conjuntamente com sais, elementos traço e vitaminas para cumprir de forma completa com as suas necessidades nutricionais.
2. O que precisa saber antes de começar a usar Kabiven
Não use Kabiven:
- se é alérgico a alguma substância ativa ou a algum dos componentes deste medicamento (listados na seção 6).
- se é alérgico a produtos que contenham ovo, soja ou amendoim
- se tem muitas substâncias gordas(como colesterol) no seu sangue
- se tem a sua função hepáticagravemente diminuída
- se sofre choque agudo(dando origem a perda de sangue importante ou reação alérgica)
- se tem alterações hemorrágicasassociadas a uma situação conhecida (como síndrome hemofagocitótico) ou se o seu sangue não coagula adequadamente
- se apresenta uma situação em que o seu organismo tem problemas na utilização de proteínas ou aminoácidos
- se tem problemas graves nos rim
- se apresenta hiperglicemia (muito açúcar no seu sangue) que requer a administração de mais de 6 unidades de insulina por hora
- se tem níveis elevados de eletrólitos(sais) no seu sangue
- se tem acidose metabólica(os níveis de ácido nos seus líquidos corporais e tecidos são demasiado elevados)
- se apresenta muito líquidono seu organismo (hiperhidratação)
- se tem líquido nos seus pulmões(edema pulmonar agudo)
- se está em coma
- se padece problemas de coração
- se está desidratadocom baixos níveis de sais
- se tem sepsis grave(uma situação em que o seu organismo padece uma infecção grave)
Advertências e precauções
Informar o seu médico antes de que lhe seja administrado Kabiven se tem:
- função hepáticadiminuída
- diabetesdescompensada
- uma situação em que o seu organismo apresenta problemas na utilização de lípidosde forma adequada
- alteração nos rim
- qualquer problema no pâncreas
- problemas de tireoide– hipotireoidismo
- sepsis(uma situação em que o seu organismo sofre uma infecção)
- o seu organismo tem problemas para a eliminação de eletrólitos
- uma situação em que não há suficiente oxigénionos seus células corporais
- osmolaridade sérica incrementada
Se durante a perfusão você sofrer febre, erupção cutânea, arrepios ou dificuldade para respirar, informe o profissional de saúde imediatamente. Estes sintomas podem ser causados por uma reação alérgica ou porque você recebeu demasiado medicamento (ver seção 4).
Este medicamento pode afetar os resultados de outros testesque lhe sejam realizados. É importante que comunique ao médico que vai realizar os testes, que está a receber Kabiven.
O seu médico pode realizar-lhe de forma regular análises de sangue para garantir que o seu organismo está a receber Kabiven corretamente.
Crianças
Kabiven não será administrado a recém-nascidos ou crianças menores de dois anos de idade.
Uso de Kabiven com outros medicamentos
Informar o seu médico ou farmacêutico, se está a tomar, tomou recentemente ou poderia ter que tomar outros medicamentos.
Informar o seu médico se está a tomar
- um fármaco conhecido como heparina que é utilizado para prevenir a formação de coágulos de sangue e para ajudar à dispersão dos mesmos
- warfarina como vitamina K1, que se encontra no óleo de soja e que poderia afetar a capacidade de coagulação do sangue
- insulina para o tratamento da diabetes
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que poderia estar grávida ou tem intenção de ficar grávida, consulte com o seu médico ou farmacêutico antes de utilizar este medicamento. A segurança do uso de Kabiven durante a gravidez e a amamentação não foi comprovada. Se for necessária a nutrição através das suas veias (nutrição parenteral) durante a gravidez ou a amamentação, o seu médico lhe administrará Kabiven apenas após uma consideração exhaustiva.
Condução e uso de máquinas
Não se espera que Kabiven afete a habilidade para conduzir e usar maquinaria.
3. Como usar Kabiven
Receberá o seu medicamento mediante perfusão apenas através de uma veia central. A dose de Kabiven e que tamanho de bolsa é utilizado, depende do seu peso corporal em quilogramas e da capacidade do seu organismo para utilizar lípidos e açúcar. Kabiven será perfundido lentamente durante um período de 12-24 horas. O seu médico decidirá a dose correta que deve receber você ou o seu filho. Pode ser monitorizado durante o tratamento.
Crianças
Kabiven não é adequado para o seu uso em recém-nascidos ou em crianças de menos de dois anos de idade.
Se tomar mais Kabiven do que deve
É muito pouco provável que receba mais perfusão do que deveria, já que o seu médico ou enfermeiro o monitorizarão durante o tratamento. Os efeitos de uma sobredose podem incluir náuseas, vómitos, arrepios e retenção de líquidos. Também se tem reportado hiperglicemia (muito açúcar no seu sangue) e alterações de eletrólitos. No caso de sobredose, existe o risco de receber demasiados lípidos. É o chamado “síndrome de sobrecarga lipídica”. Para mais informações, ver a seção 4 “Efeitos adversos possíveis”. Se você experimentar qualquer um dos sintomas descritos acima ou acredita que recebeu demasiado Kabiven, informe o seu médico ou enfermeiro imediatamente. A perfusão pode ser detida imediatamente ou continuar a dose reduzida.
Se tiver alguma dúvida relacionada com o uso deste produto, pergunte ao seu médico ou enfermeiro.
4. Efeitos adversos possíveis
Assim como todos os medicamentos, Kabiven pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Kabiven pode causar uma reação alérgica (muito rara, pode afetar até 1 de cada 10.000 pacientes). Informe o seu médico imediatamente se:
- aparece no seu organismo uma erupção cutânea com comichão
- você tem temperatura muito elevada
- você tem dificuldades para respirar
Outros efeitos adversos incluem:
Efeitos adversos frequentes (pode afetar até 1 de cada 10 pacientes)
- ligeiro aumento da temperatura corporal
Efeitos adversos pouco frequentes (pode afetar até 1 de cada 100 pacientes)
- arrepios
- cansaço
- dor de estômago
- dor de cabeça
- sensação de doença
- aumento dos enzimas hepáticos. O seu médico lhe indicará se isso ocorre
Muito raros (pode afetar até 1 de cada 10.000 pacientes)
- pressão sanguínea elevada ou baixa
- dificuldade para respirar
- ereções prolongadas e dolorosas em homens
- problemas no seu sangue
Síndrome de sobrecarga lipídica
Isso poderia ocorrer se o seu organismo tivesse problemas na utilização dos lípidos, e você tivesse recebido demasiado Kabiven. Também pode ocorrer devido a uma mudança repentina na sua situação (como problemas nos rins ou infecção). Os sintomas possíveis são febre, níveis elevados de lípidos no seu sangue, nas suas células e nos seus tecidos, alterações em vários órgãos e coma. Todos estes sintomas geralmente desaparecerão se a perfusão for detida.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM.es. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Kabiven
Mantenha este medicamento fora da vista e do alcance das crianças
O seu médico ou o farmacêutico do hospital são responsáveis pela correta conservação, utilização e eliminação da perfusão Kabiven. Não conserve por cima de 25°C. Não congele e mantenha sempre o envase no contenedor externo.
A emulsão não deve ser utilizada após a data de caducidade indicada na etiqueta. Qualquer resto de emulsão sobrante deve ser retirado através dos procedimentos hospitalares autorizados.
.
6. Conteúdo do envase e informação adicional
Composição de Kabiven
Kabiven está disponível em um sistema de bolsa de três câmaras. Cada bolsa contém os seguintes volumes diferentes, dependendo dos quatro tamanhos de envase:
2566 ml | 2053 ml | 1540 ml | 1026 ml | |
Glicose (Glicose 19 %) Aminoácidos e eletrólitos (Vamin 18 Novum) Emulsão lipídica (Intralipid 20%) | 1316 ml 750 ml 500 ml | 1053 ml 600 ml 400 ml | 790 ml 450 ml 300 ml | 526 ml 300 ml 200 ml |
- As substâncias ativas são
Óleo de soja purificado Glicose monohidrato Glicose (anidra) | 100 g 275 g 250 g | 80 g 220 g 200 g | 60 g 165 g 150 g | 40 g 110 g 100 g |
Aminoácidos Alanina Arginina Ácido aspártico Ácido glutâmico Glicina Histidina Isoluecina Leucina Lisina Metionina Fenilalanina Prolina Serina Treonina Triptófano Tirosina Valina Cloruro cálcico 2H2O Correspondente a Cloruro cálcico Glicerofosfato sódico (anidro) Sulfato magnésico 7H2O Correspondente a Sulfato magnésico Cloruro potássico Acetato sódico 3H2O Correspondente a acetato sódico | 12,0 g 8,5 g 2,6 g 4,2 g 5,9 g 5,1 g 4,2 g 5,9 g 6,8 g 4,2 g 5,9 g 5,1 g 3,4 g 4,2 g 1,4 g 0,17 g 5,5 g 0,74 g 0,56 g 3,8 g 2,5 g 1,2 g 4,5 g 6,1 g 3,7 g | 9,6 g 6,8 g 2,0 g 3,4 g 4,7 g 4,1 g 3,4 g 4,7 g 5,4 g 3,4 g 4,7 g 4,1 g 2,7 g 3,4 g 1,1 g 0,14 g 4,4 g 0,59 g 0,44 g 3,0 g 2,0 g 0,96 g 3,6 g 4,9 g 2,9 g | 7,2 g 5,1 g 1,5 g 2,5 g 3,6 g 3,1 g 2,5 g 3,6 g 4,1 g 2,5 g 3,6 g 3,1 g 2,0 g 2,5 g 0,86 g 0,10 g 3,3 g 0,44 g 0,33 g 2,3 g 1,5 g 0,72 g 2,7 g 3,7 g 2,2 g | 4,8 g 3,4 g 1,0 g 1,7 g 2,4 g 2,0 g 1,7 g 2,4 g 2,7 g 1,7 g 2,4 g 2,0 g 1,4 g 1,7 g 0,57 g 0,07 g 2,2 g 0,29 g 0,22 g 1,5 g 0,99 g 0,48 g 1,8 g 2,5 g 1,5 g |
- Os outros ingredientes são
Fosfolipídios de ovo purificados
Glicerol
Hidróxido sódio
Ácido acético glacial
Água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
As soluções de glicose e aminoácidos são transparentes e incolores ou ligeiramente amareladas, e a emulsão lipídica é branca. Kabiven consiste em uma bolsa de três câmaras e uma sobrebolsa. Entre a bolsa interna e a sobrebolsa, é colocado um absorvente de oxigênio. A bolsa interna está separada em três câmaras por meio de soldaduras do tipo peel. Os conteúdos das três câmaras devem ser misturados antes do uso, mediante a abertura das soldaduras peel.
Tamanhos do envase
1 x 1026 ml, 4 x 1026 ml
1 x 1540 ml, 4 x 1540 ml
1 x 2053 ml, 4 x 2053 ml
1 x 2566 ml, 3 x 2566 ml
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Fresenius Kabi AB
SE-751 74 Uppsala, Suécia
Responsável pela fabricação
Fresenius Kabi AB
SE-751 74 Uppsala, Suécia
Este produto medicinal está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Bélgica | Kabiven |
Dinamarca | Kabiven |
Finlândia | Kabiven |
França | Kabiven |
Alemanha | Kabiven |
Grécia | Kabiven |
Islândia | Kabiven |
Irlanda | Kabiven |
Itália | Kabiven |
Luxemburgo | Kabiven |
Países Baixos | Kabiven |
Portugal | Kabiven |
Espanha | Kabiven |
Suécia | Kabiven |
Reino Unido | Kabiven |
Data da última revisão deste prospecto: Abril 2019
A informação detalhada e atualizada deste medicamento está disponível na página Web da Agência Española del Medicamento y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
--------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário
Advertências e precauções de uso
Para evitar o risco associado a uma velocidade de perfusão demasiado rápida, recomenda-se realizar uma perfusão contínua e bem controlada, se possível utilizando uma bomba volumétrica.
Tendo em conta o elevado risco de infecção associado ao uso de uma veia central, devem ser tomadas precauções assépticas estritas para evitar qualquer contaminação durante a inserção do catéter e a manipulação.
Devem ser monitorizados os níveis séricos de glicose, eletrólitos e osmolaridade, bem como o balanço hídrico, o equilíbrio ácido-base e os testes de enzimas hepáticas.
Ante qualquer sinal ou sintoma de reação anafiláctica (como febre, calafrios, erupção cutânea ou dispnéia) deve ser interrompida imediatamente a perfusão.
Kabiven não deve ser administrado simultaneamente com sangue no mesmo equipamento de perfusão, devido ao risco de pseudoaglutinação.
Método de administração
Via intravenosa, perfusão em uma veia central.
Velocidade de perfusão
A velocidade de perfusão máxima para glicose é 0,25 g/kg pc/h.
A dosagem de aminoácidos não deve exceder 0,1 g/kg pc/h.
A dosagem de lípidos não deve superar 0,15 g/kg pc/h.
A velocidade de perfusão não deve exceder 2,6 ml/kg peso corporal/hora (correspondente a 0,25 g de glicose, 0,09 g de aminoácidos e 0,1 g de lípidos/kg peso corporal). O período de perfusão recomendado é de 12-24 horas.
Precauções para a eliminação
Não utilizar o envase se não estiver intacto. Utilizar apenas se as soluções de glicose e aminoácidos forem transparentes e incolores ou ligeiramente amareladas, e a emulsão lipídica for branca e homogênea. Os conteúdos das três câmaras separadas devem ser misturados antes do uso e previamente a qualquer adição realizada através do porto de aditivos.
Depois da separação das soldaduras peel, a bolsa deve ser invertida várias vezes, para garantir uma mistura homogênea que não mostre evidência de separação de fases.
Para um único uso. Deve ser rejeitada qualquer mistura sobrante após a perfusão.
Compatibilidade
Existem dados de compatibilidade em quantidades definidas com os produtos de marca Dipeptiven, Supliven, Glycophos, Vitalipid Adultos/Infantil e Soluvit e genéricos de eletrólitos em concentrações definidas. Quando se realizarem adições de eletrólitos, devem ser consideradas as quantidades já presentes na bolsa para satisfazer as necessidades clínicas do paciente. Os dados gerados apoiam as adições à bolsa ativada de acordo com a tabela de resumo que se segue:
Intervalo de compatibilidade estabelecido durante 8 dias, ou seja, 6 dias de armazenamento a 2-8 °C seguidos de 48 horas a 20-25 °C
Unidades | Conteúdo total máximo | ||||
Tamanho da bolsa Kabiven | ml | 1026 | 1540 | 2053 | 2566 |
Aditivo | Volume | ||||
Dipeptiven | ml | 0 - 200 | 0 - 300 | 0 - 300 | 0 - 300 |
Supliven | ml | 0 - 10 | 0 - 10 | 0 - 20 | 0 - 20 |
Soluvit | vial | 0 - 1 | 0 - 1 | 0 - 2 | 0 - 2 |
Vitalipid Adulto/Infantil | ml | 0 - 10 | 0 - 10 | 0 - 20 | 0 - 20 |
Limite eletrólitos1 | Quantidade por bolsa | ||||
Sódio | mmol | ≤ 154 | ≤ 231 | ≤ 308 | ≤ 385 |
Potássio | mmol | ≤ 154 | ≤ 231 | ≤ 308 | ≤ 385 |
Cálcio | mmol | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
Magnésio | mmol | ≤ 5 | ≤ 7,5 | ≤ 10 | ≤ 12,5 |
Fosfato orgânico (Glycophos) | mmol | ≤ 15 | ≤ 22,5 | ≤ 30 | ≤ 37,5 |
- inclui as quantidades de todos os produtos
Nota: Esta tabela pretende indicar compatibilidade. Não é uma guia de dosagem. No caso dos produtos com nome comercial, antes de prescrevê-los, consulte a ficha técnica aprovada.
Existem dados sobre a compatibilidade com outros aditivos e o tempo de conservação das diferentes misturas, disponíveis sob pedido.
As adições devem ser realizadas assépticamente.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele, será realizada de acordo com a normativa local.
Validade após misturar as câmaras da bolsa
Após a abertura das soldaduras peel, demonstrou-se uma estabilidade química e física da bolsa de três câmaras misturada, de 48 horas a 20-25 °C, incluindo duração de administração. Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente. Se não for utilizado imediatamente, o tempo de conservação até seu uso e as condições previstas para seu uso são responsabilidade do usuário e normalmente não excederão as 24 horas a 2-8 °C, a menos que a mistura tenha sido realizada em condições assépticas controladas e validadas.
Validade após a mistura com aditivos
Após romper as soldaduras peel e misturar as três soluções, podem ser realizadas adições através do porto de adição de medicamentos. Demonstrou-se a estabilidade físico-química em uso da bolsa de três câmaras misturada com aditivos durante um máximo de 8 dias, ou seja, 6 dias a 2-8 °C seguidos de 48 horas a 20-25 °C, incluindo a duração da administração.
Desde um ponto de vista microbiológico, o produto deve ser utilizado imediatamente após realizar as adições. Se não for utilizado imediatamente, o tempo de conservação até seu uso e as condições previas para seu uso são responsabilidade do usuário e normalmente não devem ser superiores a 24 horas a 2-8 °C, a menos que a mistura tenha sido realizada em condições assépticas controladas e validadas.
Instruções de uso Kabiven
A bolsa
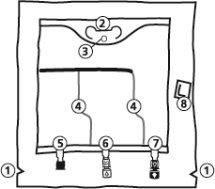
- Cortes na sobrebolsa
- Colgador
- Anel para colgar a bolsa
- Soldaduras peel
- Porto sem saída (só é usado durante a fabricação)
- Porto de adição
- Porto de perfusão
- Absorvente de oxigênio
- Retirada da sobrebolsa
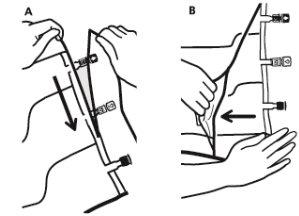
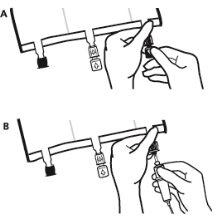
- Para retirar a sobrebolsa, segurá-la em posição horizontal e rasgar pela corte até os portos ao longo do bordo superior (A).
- Então, simplesmente rasgar ao longo do envase; separar a sobrebolsa e descartá-la junto com o absorvente de oxigênio (B).
- Mistura
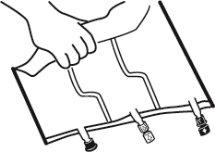
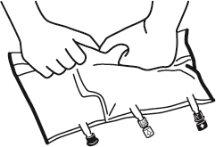
- Colocar a bolsa em uma superfície plana.
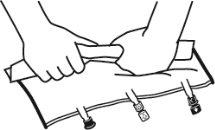
- Enrolar a bolsa desde a parte do colgador até a parte dos portos, primeiro com a mão direita e a seguir aplicando uma pressão constante com a mão esquerda até que as soldaduras verticais se abram. As soldaduras peel verticais se abrem devido à pressão do líquido. As soldaduras peel também podem ser abertas antes de retirar a sobrebolsa.
Nota:os líquidos se misturam facilmente embora a soldadura horizontal permaneça fechada.
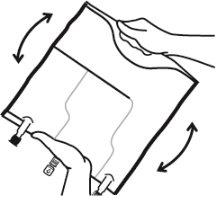
- Misturar os conteúdos das três câmaras invertendo a bolsa três vezes até que os componentes estejam completamente misturados.
- Finalização da preparação
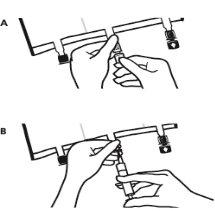
- Colocar a bolsa de novo sobre uma superfície plana. Pouco antes de injetar os aditivos, romper o porto de adição branco pela marca em forma de seta (A).
Nota:A membrana do porto de aditivos é estéril
- Segurar a base do porto de aditivos. Inserir a agulha, injetar os aditivos (de compatibilidade conhecida) pelo centro do ponto de injeção (B).
- Misturar completamente entre cada adição, invertendo a bolsa três vezes. Utilizar seringas com agulhas de calibre 18-23 e uma longitude máxima de 40 mm.
- Pouco antes de inserir o conjunto de perfusão, romper o porto de perfusão azul pela marca em forma de seta (A).
Nota:A membrana do porto de perfusão é estéril
- Usar um equipamento de perfusão não ventilado ou fechar a entrada do ar do equipamento ventilado.
- Segurar a base do porto de perfusão.
- Introduzir o punção através do porto de perfusão. O punção deve estar totalmente inserido para assegurar sua retenção.
Nota:A parte interna do porto de perfusão é estéril
- Suspensão da bolsa
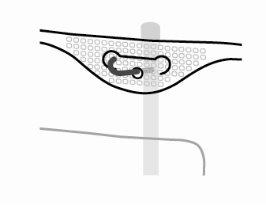
Suspender a bolsa pelo anel que há sob o colgador.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a KABIVEN EMULSÃO PARA PERFUSÃOForma farmacêutica: PERFURAÇÃO INJETÁVEL, 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 4,76 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 g / 3,5 g / 200 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: SOLUÇÃO INJETÁVEL PARA PERFUSÃO, 3,5 g / 200 g / 5,22 g / 1,88 g / 3,92 g / 1,26 g / 7,21 g / 3,36 g / 4,2 g / 5,11 g / 2,94 g / 2,8 g / 662 mg / 1,02 g / 4,76 g / 5,15 g / 5,07 g / 4,06 g / 14,49 g / 0,28 g / 8,05 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 4,25 g / 300 g / 5,22 g / 1,54 g / 4,76 g / 1,53 g / 8,76 g / 4,08 g / 5,1 g / 6,2 g / 3,57 g / 3,4 g / 662 mg / 1,02 g / 5,78 g / 5,94 g / 6,16 g / 4,93 g / 17,6 g / 0,34 g / 9,78 gSubstância ativa: combinationsFabricante: Baxter S.L.Requer receita médica
Alternativas a KABIVEN EMULSÃO PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a KABIVEN EMULSÃO PARA PERFUSÃO em Polónia
Alternativa a KABIVEN EMULSÃO PARA PERFUSÃO em Ukraine
Médicos online para KABIVEN EMULSÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de KABIVEN EMULSÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.














